探讨sPD-1和sPD-L1在原发性肾病综合征患者中的表达及其临床意义
2020-05-14吕治安王娟妮杨艳艳
吕治安 王娟妮 杨艳艳
710004 西安,西安交通大学第二附属医院肾内科
原发性肾病综合征(primary nephrotic syndrome,PNS)是以高脂血症、血浆白蛋白<30 g/L、蛋白尿>3.5 g/24 h、水肿为临床特征的一组症候群,不同程度足细胞损伤为其病理特点[1-2]。近年有研究发现[3]足细胞损伤与免疫抑制有关。可溶性程序性死亡蛋白1(soluble programmed death protein1,sPD-1)和可溶性程序性死亡蛋白配体1(soluble programmed death protein ligand 1,sPD-L1)是人体重要的免疫抑制分子,主要表达于活化T细胞表层[4-5]。相关研究显示sPD-1、sPD-L1在系统性红斑狼疮(systemic lupus erythematosus,SLE)、非胰岛素依赖型糖尿病(non-insulin dependent diabetes,NIDD)等多种自身免疫性疾病发展过程中起着重要作用[6],但其是否与PNS发生发展有关尚不清楚。因此,本研究就sPD-1和sPD-L1在PNS患者中的表达及临床意义进行了探讨,以期为临床诊治PNS提供参考,现报告如下。
资料与方法
一、研究对象
选择2016年4月~2019年4月西安交通大学第二附属医院收治的PNS患者87例作为病例组,男54例,女33例;平均年龄(46.0±10.2)岁;病理类型:肾小球微小病变(minimal changes of glomerulus,MCD)29例,局灶节段性肾小球硬化(focal segmental glomerular sclerosis,FSGS)26例,膜性肾病(membranous nephropathy,MN)32例;病情转归情况[2]:完全缓解21例,部分缓解32例,未缓解34例。另选同期在我院健康体检者87例作为对照组,男56例,女31例,平均年龄(45.3±9.3)岁。本研究经西安交通大学第二附属医院伦理委员会批准,所有入选者或家属对本研究内容知情并同意。
纳入标准:(1)符合PNS诊断标准[2];(2)年龄18~80岁;(3)临床资料完善;(4)未合并恶性肿瘤或严重传染性疾病;(5)无精神疾病且可配合完成检查者;(6)未合并肝脏疾病、动脉粥样硬化(atherosclerosis,AS)、败血症、自身免疫病。排除标准:(1)继发性肾病综合征,如乙肝病毒相关性肾炎、糖尿病肾病、肥胖相关性肾损害、高血压肾损害、狼疮性肾炎等;(2)合并过敏性疾病;(3)合并紫癜性肾炎或狼疮性肾炎;(4)有遗传肾病家族史;(5)哺乳期或妊娠期女性;(6)合并肝、心、肺功能不全;(7)近1个月内感染和使用抗菌药物者。
二、检测方法
采集对照组外周静脉血5 mL,采集病例组治疗前、治疗2个月后的外周静脉血各5 mL,于EDTA抗凝管(南通市卫宁实验器材有限公司),用离心机(上海领成生物科技有限公司)以1 000 r/min离心20 min,收集上清液,采用酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)检测血清sPD-1、sPD-L1水平,sPD-1检测试剂盒由上海仁捷生物科技有限公司提供,sPD-L1检测试剂盒由上海科顺生物科技有限公司提供。所有操作由同一名经验丰富的检验科医师严格按照说明书进行。
三、统计学处理
采用SPSS22.0软件对本研究数据进行统计分析,采用t检验比较两组血清sPD-1、sPD-L1水平,采用F检验比较不同病理类型PNS患者血清sPD-1、sPD-L1水平,采用F检验比较不同转归情况PNS患者血清sPD-1、sPD-L1水平,采用Pearson相关分析PNS患者血清sPD-1、sPD-L1水平的相关性,采用多因素Logistic回归分析PNS发生的危险因素,P<0.05表示差异具有统计学意义。
结 果
一、两组基本资料比较
两组年龄、性别、肾小球滤过率(GFR)、体质量指数(BMI)等基线资料无显著差异(P>0.05)。(表1)
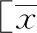
表1 两组基线资料比较±s,n(%)]
二、两组治疗前血清sPD-1、sPD-L1水平比较
病例组治疗前血清sPD-1、sPD-L1水平明显高于对照组,差异具有统计学意义(P<0.05)。(表2)

表2 两组治疗前血清sPD-1、sPD-L1水平比较±s)
三、不同病理类型PNS患者治疗前后血清sPD-1、sPD-L1水平比较
病理类型为MCD的PNS患者治疗前、后血清sPD-1、sPD-L1水平显著低于病理类型为MN和FSGS的PNS患者,差异具有统计学意义(P<0.05);病理类型为MN的PNS患者治疗前、后血清sPD-1、sPD-L1水平显著低于病理类型为FSGS的PNS患者,差异具有统计学意义(P<0.05);3种病理类型的PNS患者治疗后血清sPD-1、sPD-L1水平较治疗前血清sPD-1、sPD-L1水平差异均具有统计学意义(P<0.05)。(表3)

表3 不同病理类型PNS患者治疗前后血清sPD-1、sPD-L1水平比较±s)
注:与MCD比较,aP<0.05;与MN比较,bP<0.05;与治疗前比较,cP<0.05
四、不同转归情况治疗后PNS患者血清sPD-1、sPD-L1水平比较
完全缓解的PNS患者治疗后血清sPD-1、sPD-L1水平显著低于部分缓解和未缓解的PNS患者,差异具有统计学意义(P<0.05);部分缓解的PNS患者治疗后血清sPD-1、sPD-L1水平显著低于未缓解的PNS患者,差异具有统计学意义(P<0.05)。(表4)

表4 不同转归情况PNS患者治疗后血清sPD-1、sPD-L1水平比较±s)
注:与完全缓解比较,aP<0.05;与部分缓解比较,bP<0.05
五、Pearson相关性分析
PNS患者血清sPD-1、sPD-L1水平呈正相关(r= 0.826,P<0.01)。(图1)

图1 PNS患者血清sPD-1、sPD-L1水平的相关性
六、多因素Logistic回归分析
sPD-1、sPD-L1为PNS的影响因素(P<0.05)。(表5~8)

表5 赋值表

表6 Hosmer和Lemeshow检验

表7 分类表
注:切割值为0.500

表8 多因素Logistic回归分析PNS发生的影响因素
讨 论
PNS是一种常见慢性肾脏疾病[7]。MN、MCD、FSGS是PNS最常见的3种病理类型,均以不同程度的足细胞损伤为病理特点,故PNS又称为原发性足细胞病[8]。相关研究发现免疫病理损伤是足细胞损伤的常见原因之一[3],而有学者认为PD-1/PD-L1共刺激信号的异常可能与原发性肾病综合征患者免疫病理损伤有关[9]。
PD-1可以抑制免疫T细胞增殖及降低干扰素-γ(interferon-γ,IFN-γ)、白细胞介素10(interleukin 10,IL-10)水平[10]。PD-1的配体(PD-L1)表达于抗原提呈细胞(antigen presenting cells,APCS)及非造血细胞,PD-L1与PD-1结合可通过调节T、B细胞而影响机体免疫应答[11]。有研究发现PD-1/PD-L1信号通路可参与狼疮肾炎、肾小球肾炎、紫癜性肾炎等免疫相关性肾脏疾病的发生及发展[12]。另有研究发现临床应用抗PD-1抗体治疗肿瘤后患者出现肾病综合征,因此推测PD-1/PD-L与免疫病理损伤有一定联系[13]。有报道显示sPD-1主要通过PD-1基因剪切体阻止PD-1与其配体结合而减少T细胞抑制[14]。sPD-L1主要通过基质金属蛋白酶(matrix metalloproteinases,MMP)与PD-L1以同样方式与其受体PD-1结合而发挥负性调节作用[15]。多因素Logistic回归分析显示sPD-1、sPD-L1为PNS的影响因素,说明高水平sPD-1、sPD-L1可能提示PNS的发生。进一步分析血清sPD-1、sPD-L1水平与PNS患者预后关系发现不同转归情况PNS患者血清sPD-1、sPD-L1水平具有显著差异,其异常表达可能与PNS患者预后有密切关系,推测sPD-1、sPD-L1水平越高的原发性肾病综合征患者预后可能越差。Pearson相关分析显示PNS患者血清sPD-1、sPD-L1水平呈正相关,其原因可能是当PNS患者外周血中sPD-1、sPD-L1水平升高,T细胞激活受到抑制,细胞和体液免疫应答紊乱,引发机体产生免疫失调反应,导致足细胞损伤,从而导致PNS发生。
综上所述,sPD-1、sPD-L1在原发性肾病综合征患者血清中呈高表达,sPD-1、sPD-L1检测对肾病综合征预后评估有潜在价值,但其具体生物学意义有待进一步研究。
