图示法推导标准电极电势与平衡常数关系初探*
2020-05-13王会生
游 丹,王会生
(1 武汉工程大学邮电信息学院,湖北 武汉 430073;2 武汉工程大学化学与环境工程学院,湖北 武汉 430205)
对于大一新生来说,通过能斯特方程计算有关电极的标准电极电势会存在畏难心理,且学习效果不理想[1-3]。在无机化学教材中,涉及标准电极电势的计算有很多,如弱电解质、难溶电解质及配离子电解质等。教学中发现,学生往往不能有效的把氧化还原平衡那章有关能斯特方程的理论很好的应用到这些非简单离子对构成的电极的标准电极电势计算上,认为这些知识点非常杂乱,从而导致部分学生在这方面计算时出现大量的丢分,教学效果很不理想。一般的无机化学教材在推导这些电对标准电极电势与其平衡常数关系时[4-5],介绍了两种方法:(1)直接由相关电对推导;(2)由待求电对与相关电对组成原电池推导。第一种方法估计也是多数高校教师采用的方法,它要把这些弱电解质、难溶电解质和配离子的电对标准态看成由相应简单离子构成的电对非标准态,然后由能斯特方程推导出弱电解质、难溶电解质和配离子电极的标准电极电势φӨ与其相应的简单离子的φ的关系。我们认为,学生难以进行这些计算的根源在于他们对弱电解质、难溶电解质和配离子电极的标准电极电势φӨ等于它们所对应的简单离子的非标准电极电势φ这一概念不能真正理解,导致很多学生不会使用上述转换关系,转而采取机械的记忆方式;然而,这不容易记牢,而在考试时又不会推导,从而导致许多该类型题目丢分。第二种方法,要把待求的电对和相关的标准电对建立成原电池推导,同样很多学生在考试时不会通过建立原电池推导相应公式,因为对于大多数学生来说,他们又不那么善于建立原电池。总之,关于这几类电解质标准电极电势的计算成为无机化学中一个很大的教学难点,需要引起参与无机化学教学的老师关注。在本文中,我们尝试了使用图示的方法进行推导弱电解质、难溶电解质及配离子所形成的电对的标准电极电势与其平衡常数的关系,该方法较为直观,学生一目了然,容易掌握。
1 问题的提出

方法是在金属银与硝酸银溶液组成的半电池加入HCl,直到溶液中c(Cl-)为1.0 mol·L-1,
这时半电池中存在两种反应,一是电极反应,二是AgCl的沉淀反应。达到平衡时:




方法是用电对[Cu(NH3)4]2+/Cu与Cu2+/Cu设计如下原电池:
(-)Cu︱Cu2+(1.0 mol·L-1)║[Cu(NH3)4]2+(1.0 mol·L-1),NH3(1.0 mol·L-1)︱Cu(+)
正极反应:


由原电池标准电动势EӨ与原电池反应的平衡常数KӨ的关系:


因此有:
弱电解质、难溶电解质及配离子所形成的电对的标准电极电势与其平衡常数的关系实质是体系生成弱电解质或沉淀或配离子引起相关离子浓度变化,从而引起电极电势的改变, 即离子浓度对电极电势的影响,这是氧化还原平衡的重点。由待求电对与相关电对组成原电池推导弱电解质、难溶电解质及配离子所形成的电对的标准电极电势与其平衡常数的关系的方法涉及氧化还原的多个知识点,但却忽略了离子浓度对电极电势的影响这一重点。不利学生掌握这一重要的知识点。
为解决教学中出现的问题,我们探索了用图示的方法推导弱电解质、难溶电解质及配离子所形成的电对的标准电极电势与其平衡常数的关系。在教学中采用这一方法,发现方法直观,学生易懂,突出了浓度对电极电势的影响,即能斯特方程的应用。
2 图示推导方法
图示推导方法需要三个步骤:
(1)设计用于讲解的相关示意图;
(2)由图列出体系的电极反应并写出相关的能斯特方程,重点指出同一溶液中仅有一个电极电势;
(3)推导相关电对标准电极电势与其平衡常数的关系。
现用实例介绍图示推导方法的教学。
2.1 沉淀生成对电极电势的影响
(1)设计示意图
在盛有Fe(OH)3和Fe(OH)2沉淀的溶液的烧杯中插入铂丝,溶液中必存在Fe3+、Fe2+和OH-离子,如图1所示。

图1 沉淀生成对电极电势的影响示意图
(2)写出体系有关电对的电极反应和相关的能斯特方程
体系一定存在Fe3+/Fe2+和Fe(OH)3/Fe(OH)2两个电对。
电对Fe3+/Fe2+:

电对Fe(OH)3/Fe(OH)2:

电对Fe3+/Fe2+和电对Fe(OH)3/Fe(OH)2在同一体系,这一体系只有一个电极电势值,因此两个电对的电极电势值相等,即φFe3+/Fe2+=φFe(OH)3/Fe(OH)2。
因此,当cOH-=1.0 mol·L-,即[OH-]=1.0时,即金属难溶电极处于标准状态时,
(3)推导电对Fe(OH)3/Fe(OH)2标准电极电势与其平衡常数的关系,因为:


当沉淀溶解反应达到平衡,则有:
可见平衡体系。电对Fe(OH)3/Fe(OH)2标准电极电势与电对Fe3+/Fe2+的标准电极电势及有关的溶度积常数有关。因此生成沉淀后溶度积常数是影响电极电势的主要因素。电对的氧化型物质生成沉淀电极电势下降,生成沉淀的溶度积常数越小,电极电势下降得越多。而电对的还原型物质生成沉淀电极电势上升,生成沉淀的溶度积常数越小,电极电势上升得越多。
2.2 弱电解质生成对电极电势的影响
(1)设计示意图
将氢电极的溶液换成HAc溶液。溶液中必存在H+、Ac-离子和HAc,如图2所示。

图2 弱电解质生成对标准电极电势的影响示意图
(2)写出体系有关电对的电极反应和相关的能斯特方程
体系一定存在H+/H2和HAc/H2两个电对。
电对H+/H2:

电对H+/H2和电对HAc/H2在同一体系,这一体系只有一个电极电势值,因此两个电对的电极电势值相等,φH+/H2=φHAc/H2。

(3)推导电对HAc/H2标准电极电势与其平衡常数的关系
因为:




图3 配离子生成对电极电势的影响示意图
2.3 配离子生成对电极电势的影响
(1)设计示意图
在有[Co(NH3)6]3+、[Co(NH3)6]2+配离子存在的溶液的烧杯中插入铂丝,溶液中必存在Co3+、Co2+、[Co(NH3)6]3+和[Co(NH3)6]2+离子及NH3分子,如图3所示。
(2)写出体系有关电对的电极反应和相关的能斯特方程
体系一定存在Co3+/Co2+和[Co(NH3)6]3+/[Co(NH3)6]2+两个电对。
电对Co3+/Co2+:
电对[Co(NH3)6]3+/[Co(NH3)6]2+:
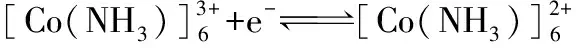

因此,当c[Co(NH3)6]3+=c[Co(NH3)6]+时(此例是电对氧化型和还原型同时生成配离子,且配位体数相同,因此只需要求c[Co(NH3)6]3+=c[Co(NH3)6]+,且与溶液中NH3的浓度无关,否则溶液中所有配离子和配位体的浓度必需为1.0 mol·L-1,即配离子电极处于标准状态),
(3)推导电对[Co(NH3)6]3+/[Co(NH3)6]2+标准电极电势与其平衡常数的关系



3 特 点
在教学时,用图示法讲解推导弱电解质、难溶电解质及配离子所形成的电对的标准电极电势与其平衡常数的关系与直接由相关电对推导及由待求电对与相关电对组成原电池推导相比,我们认为图示推导方法用于教学有如下特点。
(1)直观,学生一目了然。在示意图中学生能清楚地看到体系中与推导有关的物质;并清楚地了解体系中只有一个电极,因此体系只有一个电极电势值,不能体系有多少电对,它们的电极电势应相同。这就比较容易解释两个电对的电极电势相等的问题。
(2)明确了为何这三种电解质的φӨ等于它们相应简单阳离子的φ。通过图示法清楚地表明了,在一个体系中仅有一个电极电势。此外,通过这些图示法推导的示例可见,整个推导过程都只一个知识点:浓度对电极电势的影响,即能斯特方程的应用。生成弱电解质、难溶电解质及配离子影响电极电势只是溶液中物质的浓度,而与参与电极反应的固体、气体无关,当电对的氧化型和还原型物质都生成配离子,且配体的个数相同,则配体的浓度不影响电极电势。这样学生就容易理解生成弱电解质、难溶电解质及配离子影响电极电势是因为溶液中电对氧化型和还原型离子浓度的改变,并通过推导直接说明了只有当弱电解质电极,难溶电极和配离子电极处于标准状态,即电对的电极反应中所有物质的浓度为1.0 mol·L-1,气体分压为100 kPa,其标准电极电势与其对应的电对的非标准状态的电极电势相等。

4 结 语
我们对2017级和2018级两届学生使用该方法教学,并对他们的期末考试成绩进行分析。研究发现,使用图示法推导标准电极电势与平衡常数关系教学后,学生的学习兴趣和学习积极性有明显提升,对这些电解质标准电极电势的认识也更加清晰。通过统计相关电极电势计算题目的分数发现,能拿到该类题目80%以上分数的学生人数占总人数71.2%。在卷面难度相当情况下,这比使用该方法之前,仅60%学生能拿到这个分数的比率约提高11%。此外,该类题目满分学生约占总人数23%,这比使用该教学方法前大约提高5%。
