RP-HPLC法同时测定翅碱蓬中四种黄酮化合物的含量
2020-05-13郭丽霞宁寰宇谭成玉
郭丽霞, 宁寰宇, 曹 苇, 李 慧, 孔 亮, 谭成玉
RP-HPLC法同时测定翅碱蓬中四种黄酮化合物的含量
郭丽霞, 宁寰宇, 曹 苇, 李 慧, 孔 亮, 谭成玉
(大连海洋大学 海洋科技与环境学院, 辽宁 大连 116023)
建立RP-HPLC(反相高效液相色谱法)同时测定翅碱蓬中四种黄酮化合物-芸香苷、槲皮素3-β-D-葡萄糖苷、水仙苷和槲皮素的含量。采用Kromasil C18色谱柱( 4.6 mm × 250 mm, 5 μm) , 检测波长为361 nm, 柱温为30℃, 流动相为甲醇-0.4%冰乙酸(55︰45), 流速1.0 mL/min, 四种黄酮类化合物得到很好的分离。芸香苷、槲皮素3-β-D-葡萄糖苷、水仙苷和槲皮素浓度均为0.001~0.01 mg/mL范围内呈现良好线性关系, 相关系数2在0.999 0~0.999 6, 加标回收率(=3)范围为82.39%~99.03%。该方法简单、快速、高效, 可以用于翅碱蓬中四种黄酮化合物的含量分析。
翅碱蓬; 反相高效液相色谱; 芸香苷; 槲皮素3-β-D-葡萄糖苷; 水仙苷; 槲皮素
翅碱蓬(Kitag.), 亦称黄蓿菜、黄须菜、盐地碱蓬等, 为被子植物藜科(Chenopodiaceae)碱蓬属()的一年生盐生植物, 也是一种典型的盐碱指示植物。现代医学研究表明, 碱蓬属植物具有降血糖、降血压、保护心脏、增强免疫等作用[1-2]。目前对该属植物研究较多的为生理生长及耐盐方面[3-4], 而对其化学成分的研究报道较少, 主要含有黄酮类化合物[5-7]、脂肪酸类、萜类、多酚类[8]以及脂类[9]等活性成分, 包括具有较好生物活性的黄酮类化合物芸香苷、水仙苷、槲皮素-3-O-β-D-吡喃葡萄糖苷、槲皮素等。
近几年, 滨海湿地的翅碱蓬呈现明显的退化趋势, 每年都有大面积的翅碱蓬非自然性死亡, 甚至很多地方都已经变为了滩涂, 对当地的湿地功能和生态旅游价值造成了极大影响。赵肖依[10]、何洁等[11]研究了外界条件——盐度、铜离子及农药胁迫对翅碱蓬发芽率和生长的影响, 本文通过建立RP-HPLC对翅碱蓬黄酮类化合物的含量分析方法, 对盘锦滨海湿地的翅碱蓬植株样本中的黄酮类化合物含量进行测定, 为分析翅碱蓬退化原因及充分利用翅碱蓬植物的药用价值提供一定的理论参考。
1 仪器与试药
1.1 仪器
高效液相色谱仪Waters 600(Waters 2487双波长检测器, Empower工作站), Kromasil C18(大连中汇达科学仪器有限公司), 旋转蒸发仪RE201C(上海亚荣生化仪器厂), 闪式提取器JHBE-50T(河南金鼐科技发展有限公司), 紫外-可见光分光光度仪Lambda 35(Perkin Elmer), 电子分析天平AB104-N(梅特勒-托利多仪器公司), 超声波清洗器SB-5200D(宁波新芝生物科技有限公司), 超纯水净化仪CM-230(帕恩特公司)。
1.2 试药
翅碱蓬()植株, 于2018年10月在辽宁盘锦红海滩湿地的接官厅(40°54′01.21″N, 121°49′33.16″E)、廊桥爱梦(40°48′42.21″N, 121°52′45.71″E)、小岛闲情(40°51′48.53″N, 121°49′59.12″E)、依水云舟(40°55′11.80″N, 121°55′34.92″E)四个景观点采集, 经粉碎、过筛待用。标准品芸香苷和槲皮素为本实验室从槐米中分离纯化、精制得到(纯度98%), 标准品槲皮素3-β-D葡萄糖苷和水仙苷购于阿拉丁(上海)有限公司。所用甲醇为色谱纯, 其余试剂均为分析纯。
2 方法和结果
2.1 溶液制备
2.1.1 标准品储备液
精密称取芸香苷、槲皮素-3-β-D葡萄糖苷、水仙苷和槲皮素各2.5 mg, 分别置于4个小烧杯中加适量甲醇溶解, 移入容量瓶, 并定容至刻度, 摇匀, 制成含上述四种黄酮标准品储备溶液。各取上述储备液5 mL, 混匀, 制得四种黄酮混合溶液。
2.1.2 供试品溶液
精密称取四个不同采样点的翅碱蓬植株各5 g, 加入250 mL甲醇进行闪式破碎提取5 min, 70℃下水浴加热1.5 h, 回流两次, 倾出上清液, 用四层纱布过滤, 获得翅碱蓬提取液, 摇匀, 0.45mm有机针式滤膜过滤, 取滤过液为供试品溶液。
2.2 色谱条件
色谱柱: Kromasil C18(I.D. 4.6×250 mm, 5 μm), 流动相: 甲醇-0.4%冰乙酸(55︰45), 流速: 1 mL/min, 检测波长: 361 nm, 柱温: 30℃, 进样量: 20 μL。在此色谱条件下, 四种黄酮化合物——芸香苷、槲皮素3-β-D葡萄糖苷、水仙苷和槲皮素的色谱峰得以较好分离, 其色谱图见图1a。
2.3 方法学验证
2.3.1 线性回归分析
分别吸取如2.1.1中配制的四种黄酮混合储备液适量, 置于容量瓶中, 色谱级甲醇稀释至刻度线, 摇匀, 滤膜过滤, 制得芸香苷、槲皮素-3-β-D-葡萄糖苷、水仙苷、槲皮素浓度均为0.001、0.002、0.004、0.006、0.008、0.01 mg/mL的标准混合溶液。
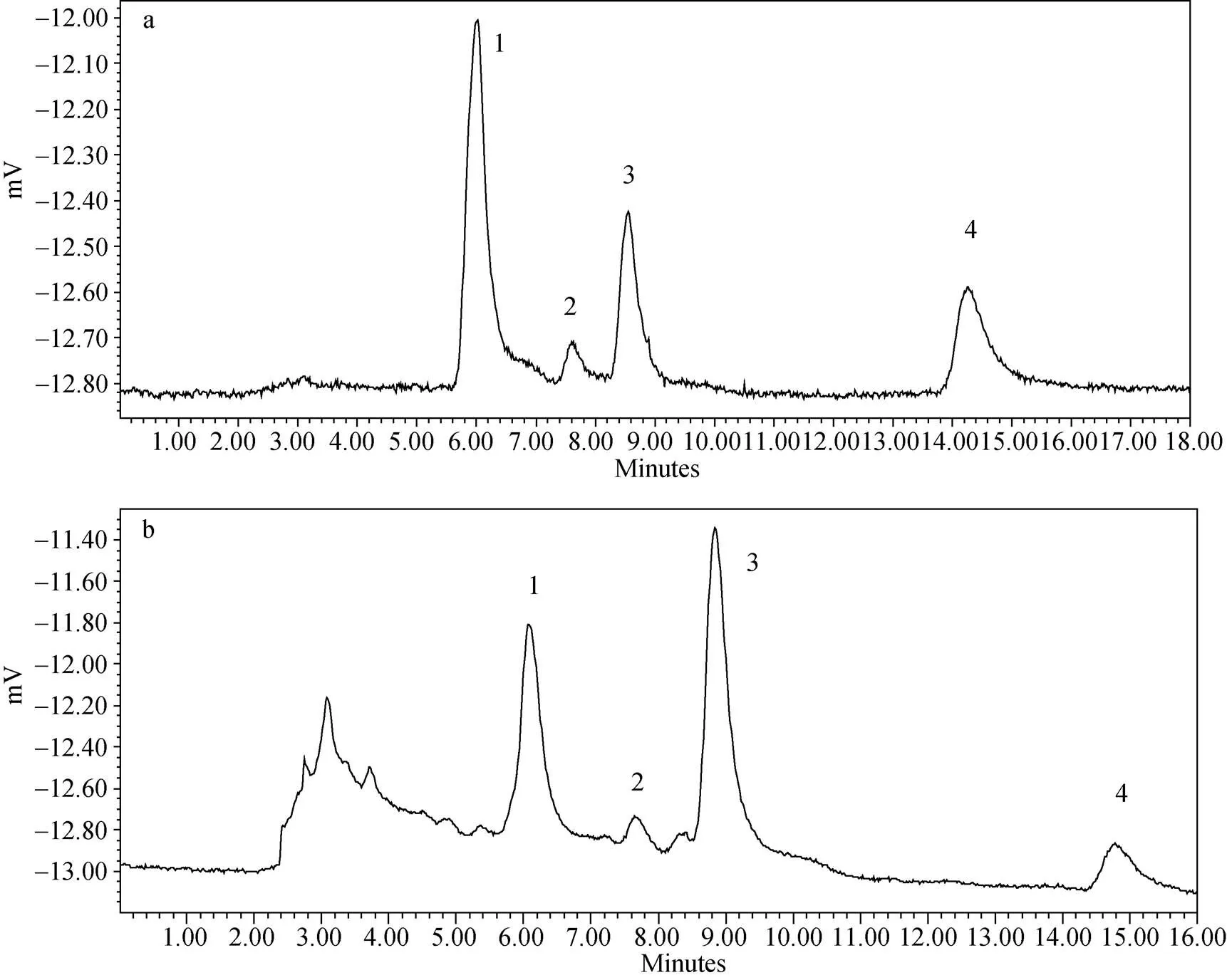
图1 标准品(a)及样品(b)的HPLC谱图
注: 1: 芸香苷; 2: 槲皮素-3-β-D葡萄糖苷; 3: 水仙苷; 4: 槲皮素
按照上述的色谱条件进样检测分析, 以四种黄酮化合物的质量浓度()为横坐标, 吸收峰面积()为纵坐标, 分别绘制四种黄酮化合物的标准曲线, 得到线性回归方程(见表1), 可以看出四种黄酮化合物在浓度为0.001~0.01 mg/mL时呈现良好的线性关系。
2.3.2 精密度试验
分别精密吸取2.3.1中同一标准混合溶液20mL, 在2.2色谱条件下连续进样6次, 通过峰面积6次积分, 求得芸香苷、槲皮素3-β-D葡萄糖苷、水仙苷、槲皮素各峰面积的RSD值分别为3.54%、2.69%、2.20%、3.37%, 表明该条件下色谱仪器的精密度良好。
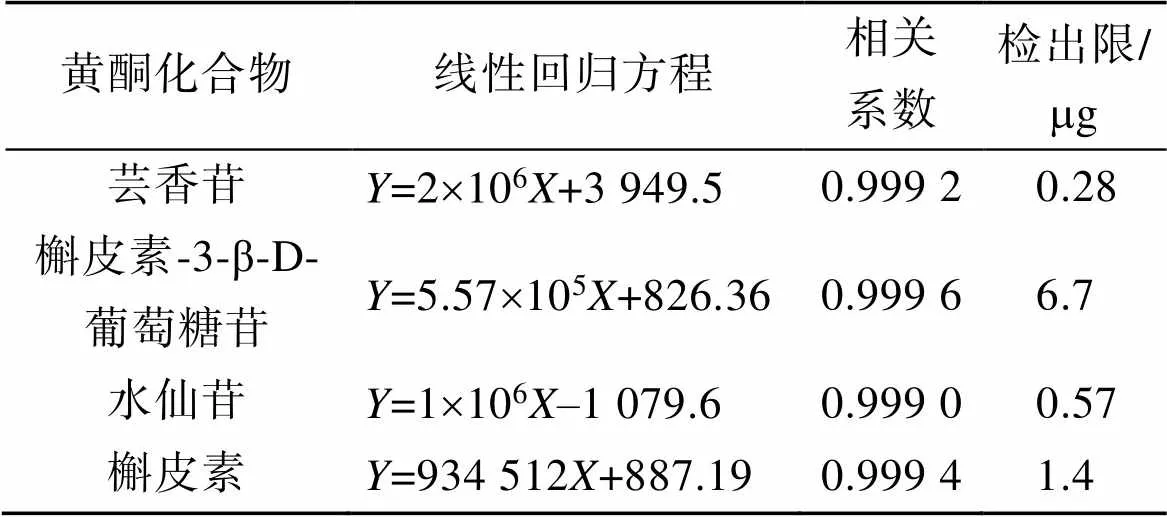
表1 峰面积与浓度的线性关系
2.3.3 重现性试验
平行制备6份供试样品的溶液, 在2.2色谱条件下连续进样6次, 测定供试品中芸香苷、槲皮素-3- β-D-葡萄糖苷、水仙苷和槲皮素峰面积积分值, 外标法计算其含量。通过计算得出芸香苷、槲皮素-3-β-D-葡萄糖苷、水仙苷、槲皮素的RSD分别为3.48%、4.23%、3.85%、1.55%, 表明该检测方法重现性良好。
2.3.4 稳定性试验
分别在0、3、6、9、12、24、48小时精密吸取同一供试品溶液进行分析。记录峰面积, 并计算出芸香苷、槲皮素-3-β-D-葡萄糖苷、水仙苷、槲皮素的RSD值, 依次为2.34%、3.80%、4.04%、3.96%。表明供试品溶液在制备后的48 h内稳定性良好。
2.3.5 最低检测限试验
用色谱纯甲醇逐级稀释浓度均为0.001 mg/mL的芸香苷、槲皮素3-β-D葡萄糖苷、水仙苷和槲皮素的混合标准品溶液, 逐一注入HPLC中进行检测, 记录色谱峰, 以到样品峰响应信号为噪声3倍(S/N≈3)时作为最小可检测信号, 此时的进样量为样品的最低检测限, 记录四种黄酮化合物的最低检测限度。实验结果显示, 芸香苷、槲皮素3-β-D葡萄糖苷、水仙苷、槲皮素标准品的最低检测限分别为0.28、6.7、0.57、1.4mg。
2.3.6 加样回收率实验
取同一景观采样点翅碱蓬植株9份, 各约0.5 g, 分别向其中加入高、中、低三个水平的芸香苷、槲皮素-3-β-D-葡萄糖苷、水仙苷、槲皮素), 依照2.1.2项下进行提取, 获得供试液。将得到的9份滤液供试品, 按照2.2色谱条件, 测得峰面积, 计算四种黄酮化合物的平均回收率和RSD值(见表2)。

表2 加样回收率实验结果
2.4 样品含量测定
精密吸取2.1.2下的供试品溶液各20mL, 按2.2项下的色谱条件进样测定样品中四种黄酮峰面积的积分值, 外标法测定其含量, 色谱图见图1b, 计算结果见表3。根据表3可以得出, 翅碱蓬中的芸香苷、槲皮素3-β-D葡萄糖苷、水仙苷和槲皮素的含量在不同的采样点各有不同, 有的甚至差异极大。其中, 廊桥爱梦、小岛闲情两个采样点的翅碱蓬中四种黄酮化合物的含量均较高, 而接官厅和依水云舟两处的翅碱蓬植株中黄酮类成分的含量较少, 这与采集的翅碱蓬植株的新鲜度有一定关系。
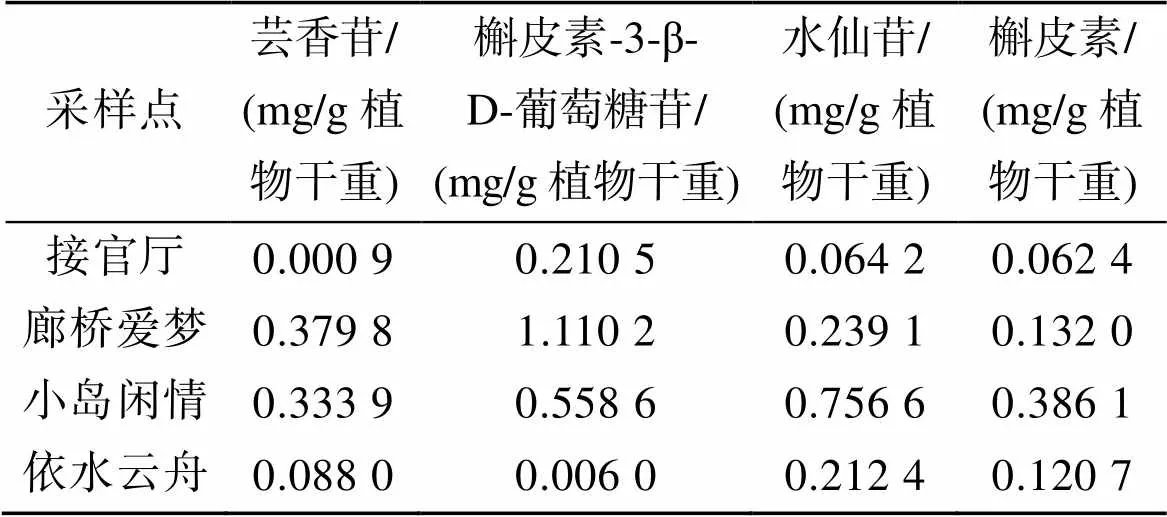
表3 四个采样点的四种黄酮化合物的含量
3 讨论
黄酮类化合物具有抗氧化性、抗肿瘤、抗肝炎病毒、消炎、解痉、抑菌、抑制异常的毛细血管通透性增加及阻力下降、增加冠脉流量、扩张冠状动脉、影响血压、改善微循环、改变体内酶活性等重要生物活性[5, 12-15]。滨海湿地植物翅碱蓬中富含黄酮类化合物, 本实验建立了RP-HPLC法定量分析翅碱蓬样品中的芸香苷、槲皮素3-β-D葡萄糖苷、水仙苷和槲皮素的含量。在选择检测波长时, 采用紫外-可见光分光光度计在200~700 nm波长扫描, 确定361 nm为其最大吸收波长。另外, 在配制流动相中向甲醇-水体系加入一定量的冰乙酸[16], 主要是考虑四种黄酮化合物在结构上存在较多的酚羟基, 具有一定的酸性, 故加入一定量的冰乙酸可以减小色谱峰的拖尾; 因此本实验中选择Kromasil C18色谱柱, 甲醇-0.4%冰醋酸(55︰45)为流动相, 出峰时间控制在20 min以内, 色谱峰峰形较好, 芸香苷、槲皮素3-β-D葡萄糖苷、水仙苷和槲皮素在此条件下能与样品中其他杂质峰有效分离。
本文实验中廊桥爱梦和小岛闲情两个采样点采到的翅碱蓬植株新鲜, 呈紫红色; 接官厅和依水云舟两处采集的植株干枯, 为深褐色。实验结果显示采样点不同, 新鲜程度不同, 翅碱蓬中四种黄酮化合物的含量差异较大, 翅碱蓬越鲜活, 黄酮化合物含量越高, 这也为滨海湿地植物翅碱蓬的退化作用机制研究提供一定的思路, 是否考虑后续设计实验, 在翅碱蓬植株生长的重要时期, 喷洒一定浓度的黄酮类化合物, 来看是否对翅碱蓬植株的生长有一定作用, 是否会对翅碱蓬的正常生长具有一定的促进作用及能否在一定程度上降低翅碱蓬种群的退化。
4 结论
建立了简单、快速、高效的RP-HPLC法同时测定翅碱蓬中四种黄酮化合物-芸香苷、槲皮素3-β-D-葡萄糖苷、水仙苷和槲皮素的含量。使用Kromasil C18色谱柱, 在检测波长361 nm, 柱温30°C, 流动相为甲醇-0.4%冰乙酸(55:45), 流速1.0 mL/min的条件下, 四种黄酮类化合物得到很好的分离。在此条件下对采自辽宁盘锦红海滩湿地四个景观点的翅碱蓬植株体内四种黄酮类化合物进行了含量分析, 发现植株越鲜活, 其中的黄酮化合物含量越高。本实验亦可以为翅碱蓬中黄酮类化合物的后续研究与应用提供一定的科学参考。
[1] 丁海荣, 洪立洲, 杨智青, 等. 盐生植物碱蓬及其研究进展[J]. 江西农业学报, 2008, 20 (8): 35-37. Ding Hairong, Hong Lizhou, Yang Zhiqing, et al. Progress of Study on Halophyte[J]. Acta Agriculturae Jiangxi, 2008, 20(8): 35-37.
[2] 王瑞轩, 李峰, 郭丽霞, 等. 滨海湿地植物翅碱蓬总黄酮的制备及其抑制ACE活性研究[J]. 精细与专用化学品, 2019, 27(3): 9-12. Wang Ruixuan, Li Feng, Guo Lixia, et al. Preparation on the total flavonoids fromand its ACE inhibitory activity[J]. Fine and Specialty Chemicals, 2019, 27(3): 9-12.
[3] Song Jie, Fan Hai, Zhao Yuanyuan, et al. Effect of salinity on germination, seedling emergence, seedling growth and ion accumulation of a euhalophytein an intertidal zone and on saline inlind[J]. Aquatic Botany, 2008, 88: 331-337.
[4] Qi Cuihua, Chen Min, Song Jie, et al. Increase in aquaporin activity is involved in leaf succulence of the euhalophyteunder salinity[J]. Plant Science, 2009, 176: 200-205.
[5] 高健. 盐地碱蓬中黄酮类物质的提取及抗氧化性研究[J]. 盐城工学院学报, 2005, 18(2): 55-57. Gao Jian. A Study of the Extraction of Flavonoids and in[J]. Journal of Yancheng Institute of Technology (Natural Science), 2005, 18(2): 55-57.
[6] 张泽生, 王丽, 杨建波, 等. 盐地碱蓬的化学成分研究[J]. 天然产物研究与开发, 2012, 24(6): 775-776. Zhang Zesheng, Wang Li, Yang Jianbo, et al. Chemical Constitutes of[J]. Natural Product Research and Development, 2012, 24(6): 775-776.
[7] Men R Z, Li N, Xing Y C, et al. Chemical constituents and ACE inhibitory activity of desert plantPall[J]. Acta Pharmaceutica Sinica B, 2013, 3(5): 328-332.
[8] 胡博路, 杭瑚. 翅碱蓬的抗氧化活性研究[J]. 中国海洋药物, 2001, (4): 29-31. Hu Bolu, Hang Hu, Study on the antioxidative effects ofKitag.[J]. Chinese Journal of Marine Drugs, 2001, (4): 29-31.
[9] 陈然然, 邵荣, 杨剑, 等. 碱蓬籽油脂的超临界CO2提取工艺优化[J], 化学工程师, 2015, 232(1): 61-64, 71. Chen Ranran, Shao Rong, Yang Jian, et al. Optimization of supercritical CO2extraction of oils and fats from suaeda salsa seed[J]. Chemical Engineer, 2015, 232(1): 61-64, 71.
[10] 赵肖依, 魏海峰, 胡蝶, 等. 盐度、铜离子及草甘膦对翅碱蓬发芽率和生长的影响[J], 大连海洋大学学报, 2019, 2: 185-190. Zhao Xiaoyi, Wei Haifeng, Hu Die, et al. Effects of salinity, and concentrations of copper ions and glyphosate on germination and growth rates of saline seepweed[J]. Journal of Dalian Ocean University, 2019, 2: 185-190.
[11] 何洁, 何晓彤, 刘远, 等. 丁草胺和马拉硫磷对翅碱蓬生长及抗氧化酶系统的影响[J]. 大连海洋大学学报, 2016, 5: 511-558. He Jie, He Xiaotong, Liu Yuan, et al. Effect of butachlor and malathion on growth and antioxidant enzyme system in common seepweed herb[J]. Journal of Dalian Ocean University, 2016, 5: 511-558.
[12] 石雪萍, 余芳. RP-HPLC测定小茴香中槲皮素和山奈酚含量[J]. 中国调味品, 2015, 40(5): 93-96. Shi Xueping, Yu Fang. Determination of quercetin and kaempferol in Foeniculum vulgare Mill. by RP-HPLC[J]. China Condiment, 2015, 40(5): 93-96.
[13] 王洪彪, 王鹏辉, 秦嘉驹, 等. 植物黄酮类化合物的提纯和含量测定方法研究概况[J]. 吉林化工学院学报, 2018, 35(7): 44-47. Wang Hongbiao, Wang Penghui, Qin Jiaju, et al. Research Profile of the extraction, purification and determination of flavonoids in plants[J]. Journal of Jilin Institute of Chemical Technology, 2018, 35(7): 44-47.
[14] 赵学思, 师仁丽, 李岩, 等. 碱蓬黄酮提取物的体外抗氧化及抑菌性研究[J]. 食品工业科技, 2016, 37(13): 1-10. Zhao Xuesi, Shi Renli, Li Yan, et al. Antioxidation and antibacterial property of flavonoids compounds extracted from[J]. Science and Technology of Food Industry, 2016, 37(13): 1-10.
[15] 张泽生, 王婷婷, 韩顺凯, 等. 盐地碱蓬提取物对高脂血症仓鼠血脂的影响[J]. 食品科技, 2012, (12): 227- 230. Zhang Zesheng, Wang Tingting, Han Shunkan, et al. Effect of Suaeda salsa extracts on blood lipid in hyperlipemia hamsters[J]. Food Science and Technology, 2012, (12): 227-230.
[16] 波拉提·马卡比力, 孟繁桐, 孔亮, 等. RP-HPLC同时测定全缘叶蓝刺头地上部分两种黄酮醇[J]. 中国药学杂志, 2018, 53(2): 136-139. Makabel Bolat, Meng Fantong, Kong Liang, et al. Simultaneous determination of contents of two flavonols in the aerial parts ofby RP-HPLC[J]. Chinese Pharmaceutical Journal, 2018, 53(2): 136-139.
Simultaneous determination of four flavonoids inby RP-HPLC
GUO Li-xia, NING Huan-yu, CAO Wei, LI Hui, KONG Liang, TAN Cheng-yu
(College of Marine Science and Environment, Dalian Ocean University, Dalian 116023, China)
In this study, we established a reversed-phase high-performance liquid chromatography (RP-HPLC) method for the simultaneous determination of four flavonoids—rutin, quercetin 3-β-D-glucoside, narcissoside, and quercetin—in. The separation was achieved using a Kromasil C18 column (4.6 mm × 250 mm, 5 μm) at 30℃, with methanol-0.4% glacial acetic acid (55︰45) as the mobile phase at a flow rate of 1.0 mL.min–1and a detection wavelength of 361 nm. The correlation coefficients ranged between 0.999 0 and 0.999 6 with calibration curves in the range of 0.001–0.01 mg·mL–1for the four flavones. The average recoveries (= 9) obtained were 82.39%–99.03%. This method is simple, rapid, and efficient, and can be used for the simultaneous determination of rutin, quercetin 3-β-D glucoside, narcissoside, and quercetin insamples.
; RP-HPLC; flavonoids; rutin; quercetin 3-β-D-glucoside; narcissoside; quercetin
Jul. 16, 2019
[The Key Project of Natural Fund of Liaoning Province, No. 20170540102; The Wetland Degradation and Restoration Programof Panjin Pink Beach, No. PHL-XZ-2017013002]
O629.9
A
1000-3096(2020)04-0111-05
10.11759/hykx20190716003
2019-07-16;
2019-10-06
辽宁省自然科学基金重点项目(20170540102), 盘锦红海滩湿地退化与生态修复项目(PHL-XZ-2017013002)
谭成玉,
, 博士, 教授, 硕士生导师, 电话: 0411-84763520, E-mail: tanchyu@dlou.edu.cn
(本文编辑: 杨 悦)
