腹腔镜下结肠癌根治术与开腹结肠癌根治术近远期疗效的对比分析
2020-05-13蒋汉卿何进伟罗水祥陈健陈波
蒋汉卿,何进伟,罗水祥,陈健,陈波
614000 四川 乐山,乐山市市中区人民医院 普外科
结肠癌是常见的消化道恶性肿瘤,居胃肠道肿瘤的第二位[1]。据相关报道称,近年来随着人们生活环境和生活习惯的改变,结肠癌的发病率呈逐年上升趋势,全球每年约有85万新患者出现,其中有死亡病例约为50万[2]。目前结肠癌首选的治疗方式仍为外科手术治疗,其中腹腔镜作为一种微创外科技术,由于其创伤小、恢复快、术后切口美观等优点,已在结肠癌的手术中得到了广泛应用,且手术技术日趋成熟[3]。但腹腔镜受操作要求、技术水平等因素的影响,关于其对结肠癌患者的近远期疗效及安全性一直存在较大争议。本次研究选取了本院收治的结肠癌患者作为观察对象,旨在对比分析腹腔镜下结肠癌根治术与开腹结肠癌根治术2种不同术式治疗结肠癌患者近远期疗效,现报告如下。
1 资料与方法
1.1 研究对象
回顾性分析本院接受外科手术治疗的204例结肠癌患者的临床资料,纳入标准:1)所选患者术前均经CT、彩超、MRI等影像学检查、结肠镜检查明确诊断,术后经病理检查确诊为结肠癌;2)患者及其家属愿意签署知情同意书,并获得本院医院伦理委员会批准。排除标准:1)意识/精神障碍;2)合并自身免疫性疾病、心脏疾病、血液疾病、肝脏疾病、肺脏疾病和肾脏疾病等主要脏器的严重性疾病患者;3)有麻醉过敏、凝血功能障碍等手术禁忌证者;4)合并周围组织器官侵犯及转移者;5)术前接受过化疗、放疗者;6)既往有腹腔手术治疗史。
1.2 分组方法
按照上述纳入排除标准共纳入204例患者,均将其按照手术方式的不同分为病例组与对照组。病例组136例,其中男性74例,女性62例,年龄为37岁~74岁,平均年龄为(51.1±6.7)岁。对照组68例,其中男性38例,女性30例,年龄为35岁~76岁,平均年龄为(51.2±6.7)岁。两组患者的性别、年龄、Duke’s分期及肿瘤部位等基本临床资料对比具有可比性(P>0.05)(表1)。
表1 一般资料比较
Table 1. General Information
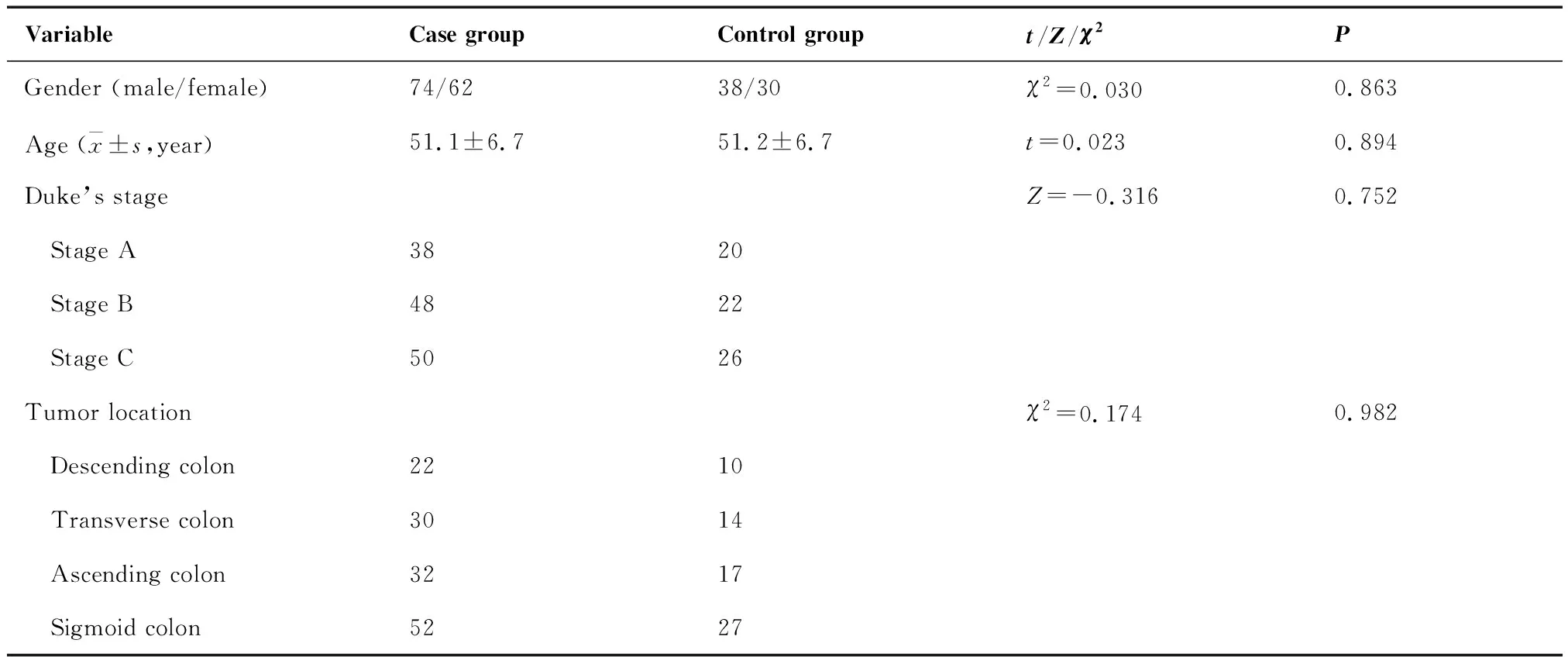
VariableCase groupControl groupt/Z/χ2PGender (male/female)74/6238/30χ2=0.0300.863Age ( x±s,year)51.1±6.751.2±6.7t=0.0230.894Duke’s stageZ=-0.3160.752 Stage A3820 Stage B4822 Stage C5026Tumor locationχ2=0.1740.982 Descending colon2210 Transverse colon3014 Ascending colon3217 Sigmoid colon5227
1.3 治疗方法
所有患者术前均常规禁食、导泻、低压灌肠,做好充分肠道准备,同时行营养支持治疗,维持水电解质平衡,纠正患者贫血、低蛋白血症。
1.3.1 病例组 所选患者给予腹腔镜下结肠癌根治术进行治疗,在区域血管根部离断主要血管,采用内外侧结合法按解剖层次游离结肠使其呈游离状态,清除区域淋巴结,完整切除病变肠段,吻合器吻合(乙状结肠癌采用双吻合技术,其余部位肿瘤将肠段经小切口拖至腹腔外进行吻合),冲洗腹腔,放置引流,关闭切口。后用温生理盐水冲洗腹腔,并置引流管,逐层缝合包扎。
1.3.2 对照组 所选患者给予开腹结肠癌根治术进行治疗,依据肿瘤不同位置取不同体位,采用气管插管全身麻醉,消毒保留导尿铺巾,取右侧经腹直肌切口逐层切开入腹,探查腹腔明确肿瘤部位、大小及与周围脏器的关联性,手术原则同病例组,肿瘤切除、淋巴结清扫范围及吻合方式同病例组,取出标本后送病理检查,并用温生理盐水冲洗腹腔,并置引流管,逐层缝合包扎。
1.4 观察指标
1.4.1 术中观察指标 对两组患者的手术期间的手术时间、术中出血量、淋巴结清扫数目、切口长度进行记录。
1.4.2 近期疗效指标 对两组患者术后首次排气时间、尿管留置时间、术后镇痛时间、术后卧床时间及术后住院时间进行记录,同时记录术后并发症发生情况,主要包括不完全肠梗阻、切口感染、吻合口瘘、肺部感染等。
1.4.3 术后随访及远期疗效指标 对两组患者术后均进行3年随访调查,主要通过电话随访、门诊复诊、上门随访与电子邮件随访等方式进行,随访时间截止至2019年6月30日或患者死亡,本次研究随访204例患者,失访0例,随访成功率为100%。收集两组患者的随访资料,观察记录两组患者术后癌细胞转移率、复发率及1年和3年生存率。
1.5 统计学处理

2 结 果
2.1 术中观察指标
本次调查结果显示,病例组患者的术中出血量、切口长度明显低于对照组患者,经t检验,差异存在统计学意义(P<0.05),手术时间明显高于对照组患者,经t检验,差异存在统计学意义(P<0.05),但淋巴结清扫数目对比无明显差异,经t检验,对比无统计学意义(P>0.05)(表2)。
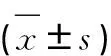
Table 2. Indicators Observed during Surgery in Two Groups

GroupOperation time(min)Intraoperative bleeding volume (mL)Number of dissected lymph nodesIncision length (cm)Case group214.82±35.54118.16±33.0612.96±1.266.04±1.13Control group168.24±23.69176.43±45.8213.34±1.2421.58±4.17t8.9938.5041.77335.416P<0.001<0.0010.079<0.001
2.2 近期疗效指标
本次调查结果显示,病例组患者的术后首次排气时间、术后镇痛时间、尿管留置时间、术后卧床时间及术后住院时间均明显低于对照组患者,经t检验,差异存在统计学意义(P<0.05)(表3)。
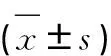
Table 3. Short-Term Indicators of Therapeutic Effects after Surgery in Two Groups

GroupFirst postoperative anal exhaust time (d)Postoperative analge-sia time (h)Indwelling time of urinary catheter (d)Postoperative bed rest time (d)Postoperative stay (d)Case group2.27±0.8619.58±2.243.25±0.843.78±1.368.68±1.59Control group3.35±1.4238.47±4.564.37±1.436.52±2.7112.41±2.68t5.36530.6615.5697.4529.871P<0.001<0.001<0.001<0.001<0.001
2.3 并发症
本次调查结果显示,病例组患者的并发症发生率(7.35%)明显低于对照组患者(19.12%),经χ2检验,差异存在统计学意义(P<0.05)(表4)。
2.4 远期疗效指标
两组患者术后进行持续随访,病例组患者的随访时间为6.4~35.5个月,中位随访时间为23.7个月,对照组患者的随访时间为6.3~35.7个月,中位随访时间为23.5个月,病例组患者与对照组患者的中位随访时间对比无明显差异,经t检验,对比无统计学意义(P>0.05);病例组患者的癌细胞转移率、局部复发率及1年和3年生存率均与对照组患者对比无明显差异,经t检验,对比无统计学意义(P>0.05)(表5)。
表4 两组患者术后并发症的比较情况[n(%)]
Table 4. Postoperative Complications in Two Groups

GroupIncomplete intestinal obstructionIncision infectionAnastomotic leakagePulmonary infectionTotalCase group2(2.94)2(2.94)0(0.00)1(1.47)5(7.35)Control group4(5.88)5(7.35)2(2.94)2(2.94)13(19.12)χ24.098P0.043
表5 两组患者术后随访情况的比较[n(%)]
Table 5. Postoperative Follow-Up in Two Groups

GroupMetastasisLocal recurrenceOne-year survival rateThree-year survival rateCase group12(17.65)3(4.41)58(85.29)43(63.24)Control group11(16.18)4(5.88)56(82.35)45(66.18)χ20.0520.1510.2170.129P0.8190.6980.6410.720
3 讨 论
结肠癌是西欧、北美等发达国家最常见的恶性肿瘤,也是我国九大常见恶性肿瘤之一[4]。结肠发病与生活方式、膳食结构、环境改变及遗传因素等多种因素存在密切关系,该病患者早期症状多不明显,待患者出现临床症状时往往已发生浸润、转移,因此多数患者就诊时已属中晚期[5]。由于近年来综合治疗的应用,手术和放化疗治疗逐渐成为了结肠癌的首选治疗手段,可以极大的提升中晚期结肠癌患者的生存率,其中根治性手术最为重要[6]。传统手术为保证完整切除病变组织及降低复发率,多采用开腹根治术,虽能在术中清晰地观察病变部位、大小及与周围组织器官的关联性,从而彻底清除病灶,但该术式创伤大,术后恢复较慢,易合并较多并发症[7]。对于结肠癌而言,腹腔镜根治术作为近几年开展的一项微创新技术,起步时间较晚,但腹腔镜可作为常规诊断检查手段的有效补充,不仅可以准确的诊断结肠癌,而且可以省去不必要的剖腹手术,手术创伤更加微创,对机体损伤更小,术后恢复更快,在结肠癌的治疗中得到了广泛应用[8-9],但其对结肠癌的近远期疗效及安全性尚未得到普遍认可,仍存在较大争议。
本次研究选取了本院接受治疗的结肠癌患者,对其分别采用开腹结肠癌根治术与腹腔镜结肠癌根治术,结果显示,在手术安全性上,病例组患者的术中出血量、切口长度明显低于对照组患者,说明腹腔镜结肠癌根治术有着较好的安全性。分析其中原因:腹腔镜根治术可以通过一个观察孔和四个操作孔利用镜头清晰分辨细微的组织结构,手术更加准确、精细,有效避免对乙状结肠动脉、左结肠动脉及肠系膜下动脉造成血管损伤出血,故切口长度短、出血量少[10-12]。但本次研究发现,病例组患者的手术时间明显高于对照组患者,分析其中原因可能与腹腔镜手术开展初期技术熟练程度有关,随着操作者技术熟练度的提高、手术配合默契及腹腔镜技术的提升,会大大缩减手术时间[13]。在术后恢复方面,病例组患者的术后首次排气时间、尿管留置时间、术后镇痛时间、术后卧床时间及术后住院时间均明显低于对照组患者,且病例组患者的并发症发生率(7.35%)明显低于对照组患者(19.12%),提示由于腹腔镜手术创伤小、出血量少、切口长度短的优点,能将对周围组织器官的损伤降至最低程度,从而减少术后镇痛时间,减轻对胃肠道的刺激,降低术后并发症发生率,便于患者术后快速恢复胃肠道功能,早期进行下床活动,缩短住院时间[14]。
目前关于腹腔镜癌根治术能否广泛应用于结肠癌最大的争议是其能否彻底切除肠段肿瘤和清除淋巴结,能否降低术后复发率,能否延长术后长期生存率。国内有一随机对照研究表示,腹腔镜手术患者的3年生存率或无复发生存率与开腹手术患者相当,且局部复发率也与开腹手术患者对比无统计学意义[15]。本次研究结果显示,病例组患者与对照组患者的淋巴结清扫数目对比无明显差异,且病例组患者的癌细胞转移率、局部复发率及1年和3年生存率均与对照组患者对比无明显差异。说明腹腔镜癌根治术治疗结肠癌可以达到与开腹根治术相似的切除范围及效果,且能有效降低术后肿瘤复发率及转移率,从而改善患者预后,提高患者3年生存率。
综上所述,与开腹结肠癌根治术相比,腹腔镜下结肠癌根治术的手术安全性、术后恢复情况、并发症发生率均明显优于开腹结肠癌根治术,且远期疗效也能获得同开腹结肠癌根治术一致的根治效果。但其术中手术时间较长,对操作者操作要求较高,需严格把握手术指征。本次研究为一项单中心、小样本、回顾性分析的研究,对于很多因素均未进行探讨,因此,更可靠的数据和结论有待后续更大样本量的前瞻性对照研究结果来证实。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
