海洋栖热菌β-胡萝卜素15,15’双加氧酶原核表达
2020-05-12欧亚非赵彩梦郑亚东毛多斌
欧亚非,赵彩梦,郑亚东,毛多斌,魏 涛
(1.上海烟草集团技术中心 北京工作站,北京 101121;2.郑州轻工业大学 食品与生物工程学院,河南 郑州 450002)
全反式视黄醛又称维生素A醛,在食品保健、化妆品、医药化工行业具有广泛用途[1-2]。目前报道的全反式视黄醛一般通过视黄醇氧化反应获得,由于视黄醇的分子结构中具有多个共轭双键,对热、光或氧气等极不稳定,在氧化反应过程中容易形成多种氧化产物,转化率较低且氧化剂的使用会产生大量污染物[3-4]。相比化学合成法,微生物酶转化法制备产物具有专一性强、产物含量高、经济简单的特点,同时可以避免化学合成中环境污染问题[5-6]。
β-胡萝卜素是8个异戊二烯单元相连接且分子两端各有一个不饱和己烯环的四萜化合物,在微生物及其相关裂解酶水解过程中能产生全反式视黄醛以及其他挥发性致香物质[7-10]。β-胡萝卜素降解方式分为对称裂解和不对称裂解两种方式:对称裂解由β-胡萝卜素15,15’双加氧酶作用第15个碳的位置,生成2分子视黄醛;不对称裂解由β-胡萝卜素7,8双加氧酶、β-胡萝卜素9,10双加氧酶和β-胡萝卜素11,12双加氧酶等催化作用不同位点,生成番红花苷、藏红花醛、β-紫罗酮、脱落酸等[11-14]。目前对于β-胡萝卜素不对称裂解酶研究较多,而对于对称裂解酶研究较少,来源于海洋细菌β-胡萝卜素15,15’双加氧酶Blh是是唯一报道微生物来源的β-胡萝卜素对称裂解酶[15]。本研究将来自海洋栖热菌(Thermussp.DN-1)的β-胡萝卜素15,15’双加氧酶(β-carotene-15,15’-oxygenase,BCMOTA)基因在大肠杆菌中克隆表达,利用生物酶法催化水解β-胡萝卜素生成全反式视黄醛,以期获得一种适用于工业化生产全反式视黄醛的新型酶催化剂。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
海洋栖热菌(Thermussp.)DN-1:本实验室筛选获得与保存。
1.1.2 试剂
全反式视黄醛标准品(纯度>98%):百灵威科技有限公司;β-胡萝卜素(纯度95%):陕西帕尼尔生物科技有限公司;大肠杆菌(Escherichia coli)(DH5α)感受态细胞、限制性内切酶NdeI和BamHI、PyrobestDNA聚合酶、DNA连接酶、细菌基因组DNA提取试剂盒ver.3.0:大连TAKARA公司;大肠杆菌(Escherichia coli)BL21(DE3)、克隆与表达质粒载体pET22b:上海斯信生物科技有限公司。
1.1.3 培养基
LB液体培养基:蛋白胨1%,酵母粉0.5%,NaCl 1%,121 ℃灭菌20 min。
含氨苄青霉素和氯霉素的LB液体培养基:蛋白胨1%,酵母粉0.5%,NaCl 1%,氨苄霉素和氯霉素浓度均为1%,121 ℃灭菌20 min。
1.2 仪器与设备
Mastercycler X50h型梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;LDZX 型立式压力蒸汽灭菌器:上海申安医疗器械厂;1-15K低温离心机:美国Sigma-Aldrich公司;Y92-III超声波细胞粉碎机:宁波新芝生物科技股份有限公司;GeneGenius凝胶成相系统:英国Syngene公司;QYC 211恒温培养箱:上海福玛实验设备有限公司;2010A/2010C型高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司。
1.3 实验方法
1.3.1Thermussp.DN-1基因组序列提取
利用细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取Thermussp.DN-1基因组DNA。
1.3.2 引物设计与合成
按照目前已经报道β-胡萝卜素15,15’双加氧酶保守氨基酸序列,设计引物如下:(F)5'-GTGCCGACATATGAACACCGCATCGGCCTATCGGAAG-3'(NdeI)和(R)5'-AATTCAGGGATCCATTGGCACACTGGACTGGCACATCCCG-3'(BamHI),由上海生工公司合成。
1.3.3Thermussp.DN-1β-胡萝卜素15,15’双加氧酶BCMOTA的基因克隆
以Thermussp.DN-1基因DNA为模板,PCR技术扩增β-胡萝卜素15,15’双加氧酶BCMOTA基因片段,PCR反应体系(100 μL):模板1 μL(50 ng),脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(25 mmol/L)2 μL,引物(100 μmol/L)各1 μL,MgCl2(25 mmol/L)2 μL,10×缓冲液10 μL,ProbestTMDNA聚合酶(5 U/μL)1 μL,超纯水82 μL。PCR扩增条件:预变性95 ℃、4 min;变性95 ℃、30 s;退火56 ℃、30 s;延伸72 ℃、2 min,35个循环。将目的基因与载体pET22b连接,获得重组质粒,并进行双酶切及测序验证。
1.3.4Thermussp.DN-1β-胡萝卜素15,15’双加氧酶BCMOTA的氨基酸序列分析
利用Clustal W 软件对Thermussp.DN-1β-胡萝卜素15,15’双加氧酶BCMOTA与已报道相关蛋白序列进行氨基酸比对分析。
1.3.5 重组质粒在大肠杆菌中的表达与纯化
将测序正确的重组质粒转入大肠杆菌BL21(DE3)中。挑取LB平板上的单菌落于20 mL含氨苄青霉素和氯霉素的LB液体培养基中,培养12~16 h;按2%接种量转接入1 L含氨苄青霉素和氯霉素LB液体培养基中,培养2.5 h,使OD600nm值在0.4~0.6;加入终浓度0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)于30 ℃继续培养8 h;离心收集的菌体悬浮在30 mL破壁缓冲液(50 mmol/L Tris-HCl,pH 7.5,100 mmol/L NaCl)中,超声波破碎菌体;12 000×g离心15 min,得到粗酶液。利用镍柱亲和层析和Sephacryl TM S-100 HR column 分子筛柱纯化蛋白。分子筛条件:50 mmol/L Tris-HCl,200 mmol/L NaCl缓冲液(pH 7.5)平衡,流速为1 mL/min。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测收集下来的蛋白。
1.3.6β-胡萝卜素15,15’双加氧酶酶活力的测定
检测β-胡萝卜素15,15’双加氧酶BCMOTA活性,采用以下反应体系[16-18]:2 mg/mLβ-胡萝卜素、50 mmol/L NaCl、5 mmol/L FeSO4·7H2O、20 mmol/L三(2-甲酰乙基)膦盐酸盐(tris(2-carboxylethyl)phosphine hydrochloride,TCEP)、2%辛基-β-D-硫代吡喃葡萄糖苷(octyl thioglucoside,OTG)、1%Tween 80、5 mmol/L二硫苏糖醇(dithiothreitol,DTT)、50 mmol/L Tricine-KOH缓冲液(pH 8.0)和0.5 U/mLβ-胡萝卜素15,15’双加氧酶BCMOTA酶液,50 ℃酶解120 min,加入5%的甲醛终止反应。以不含有酶液的上述反应体系作为对照组。
β-胡萝卜素15,15’双加氧酶BCMOTA酶活力单位定义为:在一定条件下,每分钟生成1 μmol的全反式视黄醛所需要的酶量为一个活力单位(U)。
高效液相色谱法检测反应产物[19-21],所用色谱柱为Alltech Prevail C18色谱柱(25 cm×4.6 cm),采用日本岛津SPD-M10A二极管阵列检测器,检测β-胡萝卜素,流动相为正己烷∶甲基叔丁基醚(95∶5,V/V),洗脱速度为1.0 mL/min,在波长460 nm检测;检测全反式视黄醛,流动相为乙腈∶水(90∶10,V/V),洗脱速度为0.4 mL/min,检测波长370 nm。以不同质量浓度(x)全反式视黄醛标准品(0.005 mg/mL、0.010 mg/mL、0.020 mg/mL、0.040 mg/mL、0.060 mg/mL、0.080 mg/mL、0.100 mg/mL)为横坐标,峰面积(y)为纵坐标绘制标准曲线,根据标准曲线回归方程计算酶活力。
1.3.7 重组β-胡萝卜素15,15’双加氧酶BCMOTA酶学性质研究
(1)最适反应温度
将适量的酶液分别于15~70 ℃温度条件下与底物混合反应30 min,比较酶活性大小,确定最适温度。
(2)最适反应pH值
在不同pH(6.0~10.5)的缓冲液中检测酶活,并确定最适pH值。所用缓冲液分别为50 mmol/L柠醋酸钠缓冲液(pH 5.5~6.0)、磷酸钠缓冲液(pH 6.5~8.0)、Tris-HCl缓冲液(pH 8.5~9.0)和3-环己胺基苯磺酸(N-cyclohexyl-3-aminopropanesulfonic acid,CAPS)缓冲液(pH 9.5~10.5)。
(3)酶浓度对全反式视黄醛产量的影响
在1 000 mg/L的底物浓度的反应体系中分别添加β-胡萝卜素15,15’双加氧酶BCMOTA(0~6 U/mL),检测全反式视黄醛产量。
(4)底物浓度对全反式视黄醛产量的影响
在酶浓度为4 U/mL的反应体系中添加不同浓度底物β-胡萝卜素15,15’双加氧酶BCMOTA(0~1 000 mg/L),检测全反式视黄醛产量。
(5)在最佳反应条件下全反式视黄醛产量
在以上实验结果的基础上,建立β-胡萝卜素15,15’双加氧酶BCMOTA转化β-胡萝卜素制备全反式视黄醛的最佳反应条件,酶浓度4 U/mL,β-胡萝卜素质量浓度1 000 mg/L,反应温度50 ℃,反应pH 8.0,其他反应条件为标准反应体系。
2 结果与分析
2.1 Thermus sp.DN-1 β-胡萝卜素15,15’双加氧酶BCMOTA的氨基酸序列分析

图1 β-胡萝卜素15,15’双加氧酶BCMOTA和Blh氨基酸序列比对Fig.1 Amino acid sequence alignment between β-carotene 15,15'-dioxygenase BCMOTA and Blh
经过对重组质粒进行测序,得到编码β-胡萝卜素15,15’双加氧酶BCMOTA的氨基酸序列如下:共319氨基酸。到目前为止,不可培养海洋细菌来源Blh(GenBank accession num ber:AAY68319)是唯一报道微生物来源的β-胡萝卜素15,15’双加氧酶[11]。利用软件Clustal W 2.1比对分析β-胡萝卜素15,15’双加氧酶BCMOTA和Blh氨基酸序列,结果见图1。由图1可知,BCMOTA和Blh氨基酸序列具有30%相似性,其中具有LPHGDLDA,HSXXH和TVPHMI三个保守结构域;H21、H79、H188、H192和H252为预测的五个金属离子结合位点。
2.2 β-胡萝卜素15,15’双加氧酶BCMOTA基因的克隆及表达
重组质粒在大肠杆菌BL21(DE3)表达后,经超声波破壁、50 ℃热处理、镍柱亲和层析和分子筛Sephacryl TM S-100,得到纯化重组β-胡萝卜素15,15’双加氧酶,分子质量为35 kDa,结果如图2所示。

图2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检测β-胡萝卜素15,15’双加氧酶BCMOTA纯化结果Fig.2 Purification results of β-carotene 15,15'-dioxygenase BCMOTA detected by sodium dodecyl sulfate-polyacrylamide gel electrophoresis
2.3 β-胡萝卜素15,15’双加氧酶转化β-胡萝卜素制备全反式视黄醛
HPLC检测酶反应活性,色谱图如图3所示。结果表明,重组β-胡萝卜素15,15’双加氧酶BCMOTA具有裂解β-胡萝卜素15,15’双键的活性,在β-胡萝卜素15,15’双加氧酶的酶活性标准反应体系中,优化催化合成全反式视黄醛产量。
β-胡萝卜素单加氧酶BCMOTA水解β-胡萝卜素转化生成全反式视黄醛,反应式如下:
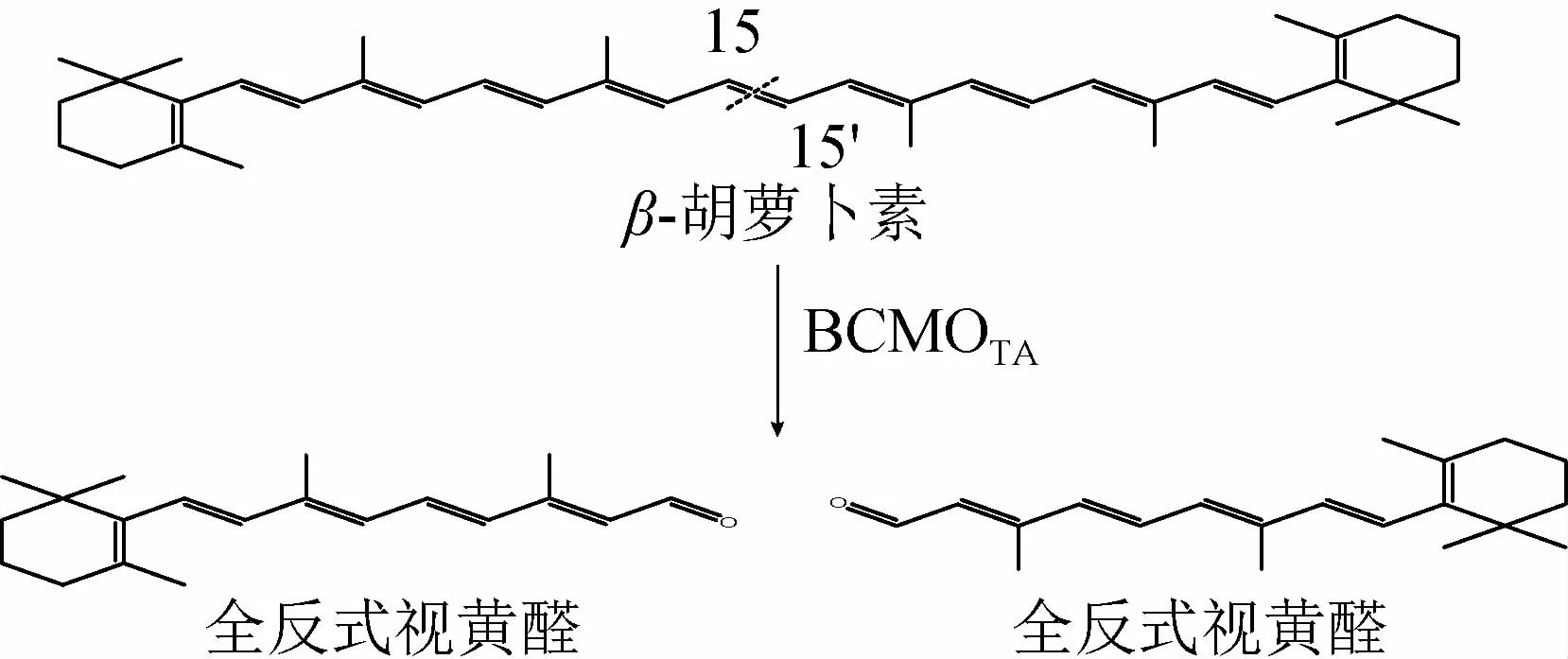
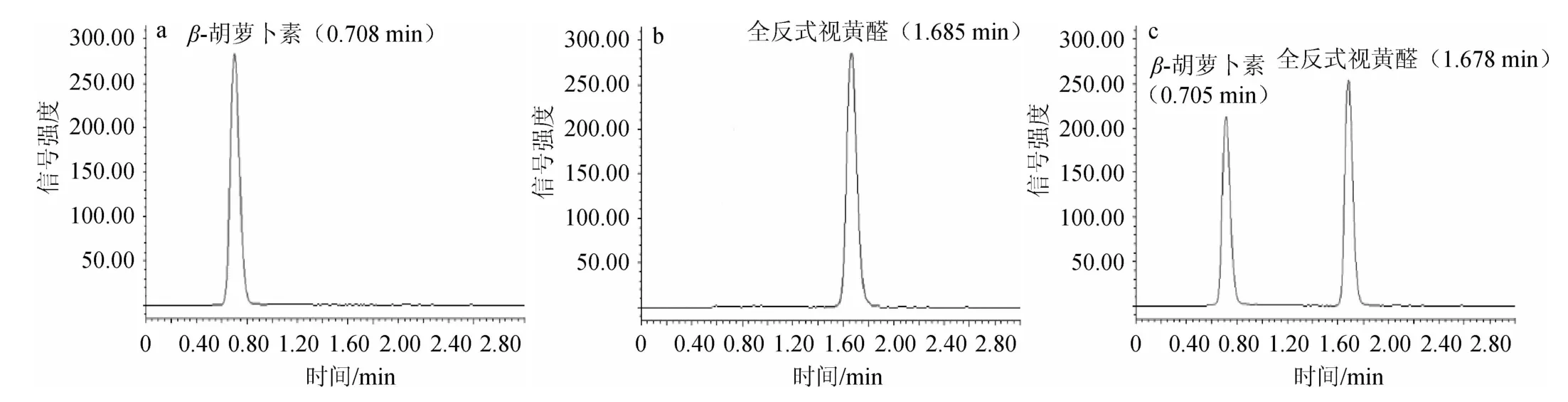
图3 β-胡萝卜素标准物(a)、全反式视黄醛标准物(b)及BCMOTA酶水解产物(c)HPLC色谱图Fig.3 HPLC chromatogram of β-carotene standard (a),all-transretinal standard (b) and BCMOTA enzymic hydrolysates (c)
2.4 β-胡萝卜素15,15t双加氧酶BCMOTA酶学性质的研究
2.4.1β-胡萝卜素15,15’双加氧酶BCMOTA最适反应温度
如图4所示,β-胡萝卜素15,15’双加氧酶BCMOTA的最适反应温度为50 ℃,且该酶在35~55 ℃温度范围内都有80%以上的活性。

图4 温度对酶活的影响Fig.4 Effect of temperature on enzyme activity
2.4.2β-胡萝卜素15,15’双加氧酶BCMOTA最适反应pH
pH值会改变位于酶活性中心、底物和辅酶的解离状态,进而改变酶与底物的结合状态以及催化水平。研究了不同pH条件对酶活力的影响,如图5所示,该酶最适反应pH为8.0,在pH 7.0~9.5范围内,该酶可以保持60%以上的活性。

图5 pH值对酶活的影响Fig.5 Effect of pH value on enzyme activity
2.4.3 酶浓度对全反式视黄醛产量的影响
如图6所示,研究了酶浓度(0~6 U/mL)对全反式视黄醛产生的影响。在含有1 000 mg/L底物浓度的反应系统中,全反式视黄醛的产生随着酶浓度先增加后趋于稳定的趋势,在约4 U/mL达到产物达到最大量,因此认为产生全反式视黄醛的最适酶浓度为4 U/mL。

图6 酶浓度对全反式视黄醛产量的影响Fig.6 Effect of enzyme concentration on all-trans retinal production
2.4.4 底物浓度对全反式视黄醛产量的影响
研究底物质量浓度(0~1 000 mg/L)对全反式视黄醛产生的影响,结果见图7。由图7可知,在4 U/mL酶浓度的反应系统中,在底物质量浓度600 mg/L条件下检测到全反式视黄醛的最大产量。

图7 底物质量浓度对全反式视黄醛产量的影响Fig.7 Effect of substrate mass concentration on all-trans retinal production
2.4.5 在最佳反应条件下全反式视黄醛产量
如图8所示,在最佳反应条件下反应25h,产生569.3mg/L全反式视黄醛,同时消耗600 mg/Lβ-胡萝卜素,根据催化反应式,计算生成全反式视黄醛的转化率达到89.5%。结果表明,该酶可以高效催化合成全反式视黄醛,具有较好的工业应用价值。

图8 在最佳反应条件下全反式视黄醛产量Fig.8 All-trans retinal production under optimal reaction conditions
3 结论
本研究得到了一种海洋栖热菌Thermussp.DN-1β-胡萝卜素15,15’双加氧酶BCMOTA的基因序列和氨基酸序列,并在E.coliBL21(DE3)中成功克隆表达;通过镍柱亲和层析和分子筛Sephacryl TM S-100,得到纯化重组β-胡萝卜素15,15’双加氧酶。SDS-PAGE分析表明该酶分子质量约35 kDa。酶学性质研究表明该酶的最适温度和pH分别为50 ℃和8.0;在最佳反应条件酶浓度4 U/mL,β-胡萝卜素质量浓度1 000 mg/L,反应温度50 ℃,反应pH 8.0,生成569.3 mg/L全反式视黄醛,转化率达到89.5%,表明该酶可以高效催化合成全反式视黄醛,因此在食品化工领域具有较好的应用价值。
