贵州小麦品种(系)籽粒低PPO活性种质资源筛选
2020-05-11晏权任明见李振华徐如宏
晏权 任明见 李振华 徐如宏
摘要:【目的】筛选出小麦籽粒低多酚氧化酶(PPO)活性的种质资源,为贵州小麦籽粒品质的遗传改良及育种提供参考依据。【方法】以生产中表现优异的135份贵州小麦品种(系)为材料,采用苯酚染色法进行染色,在此基础上以STS分子标记(PPO16、PPO18和PPO29)检测小麦PPO活性相关基因,并通过Fragment AnalyzerTM毛细管电泳鉴定相关基因,进而对小麦籽粒低PPO活性基因的组成进行鉴定和筛选。【结果】135份小麦材料籽粒经苯酚染色后,有4份材料未染色(A级),9份呈浅绿色(B级),65份材料呈棕色(C级),57份材料呈黑色(D级)。STS分子标记检测结果表明,在A级和B级材料中检测到10份材料含Ppo-A1b基因、4份材料含Ppo-D1a基因,其中4份材料同时含有Ppo-A1b/Ppo-D1a基因,分别是贵麦2号、惠水1-23、石无芒和08-9选单-2-7;在C级材料中检测到3份材料含Ppo-A1b基因、17份材料含Ppo-D1a基因,其中1份材料(贵农08-9)同时含有Ppo-A1b/Ppo-D1a基因;在D级材料中均未检测到Ppo-A1b和Ppo-D1a基因。【结论】采用苯酚染色法结合STS分子标记检测可对小麦籽粒是否含低PPO活性基因进行准确鉴定。贵麦 2号、惠水1-23、石无芒、08-9选单-2-7和贵农08-9等5份含有双低PPO活性基因(Ppo-A1b/Ppo-D1a)的种质资源,可作为亲本材料直接用于小麦籽粒低PPO活性遗传改良及新品种选育。
關键词: 小麦;多酚氧化酶(PPO)活性;苯酚染色法;STS分子标记
0 引言
【研究意义】小麦籽粒中的多酚氧化酶(Polyphenol oxidase,PPO)活性与面食加工产品色泽变化密切相关,直接影响着面粉和面食制品的品质及商品价值(司红起,2008)。颜色是评价面食制品的重要指标,也是小麦品质遗传改良的重要目标(孙道杰等,2005)。面食制品在醒面和保存期间发生褐变,主要是由于籽粒中的内源酚酸被PPO氧化,且自身多肽氨基基团聚合而形成褐色多聚体酚类物质,导致其品质变差(何克勤,2006;郑文寅等,2013)。培育和选择低PPO活性的小麦品种(系)是改良小麦相关品质性状及防止其面食制品颜色发生褐变的有效方法(杨雪等,2014;Mangini et al.,2014;Rodriguez-Suarez and Atienza,2014),而从众多小麦材料中筛选出低PPO活性的种质资源是进行小麦面食制品外观品质改良的关键。【前人研究进展】小麦加工过程中面粉颜色会发生褐变,其中50%~70%的褐变由籽粒中的PPO所造成(常成等,2007)。Jukanti等(2004)通过分析小麦籽粒cDNA文库中的EST(Expression sequence tags)序列CA716843,得到一段与PPO基因紧密联系的序列。孙道杰等(2005)在此基础上筛选出一对存在191 bp片段差异的引物,并最终开发出适用于小麦籽粒PPO活性辅助选择的SSR分子标记(PPO18)。此外,有研究表明,控制普通小麦籽粒PPO活性表型变异的两个主效基因分别位于2AL和2DL染色体上(张立平等,2005;Raman et al.,2005;Fuerst et al.,2006)。He等(2007)利用电子克隆技术对国内普通小麦进行研究时获得一对等位基因,将其命名为Ppo-A1和Ppo-D1,并根据克隆的基因设计互补显性标记PPO16和PPO29,同时发现这对基因分别控制着小麦籽粒PPO活性,其中,Ppo-A1b和Ppo-D1a基因类型为低活性,Ppo-A1a和Ppo-D1b基因类型为高活性。肖永贵等(2008)运用PPO18、PPO16和PPO29等3个分子标记对我国4个麦区的冬小麦品种(系)进行PPO基因检测,结果证实这3个分子标记的检测方法操作简便,且效果稳定,能很好地反应PPO活性。孙树贵等(2013)研究也发现使用分子检测技术能准确鉴定小麦PPO活性。目前,PPO活性的测定方法主要有染色法、分光光度法、色谱法和精密计时测定法等(司红起,2008;祝梓博,2017)。孙家柱等(2010)利用苯酚染色法对小麦进行PPO活性检测和分级,证实该方法费用成本低、操作简便、鉴别力较强且结果重复性好,可在实际生产中特别是基层推广应用;此外,通过与分子标记结果对比,发现苯酚染色结果能更好地反映PPO活性,尤其是低PPO活性材料(孙家柱等,2012)。因此,采用染色法与分子检测技术相结合的检测方法更有利于低PPO活性小麦品种(系)育种工作的开展。【本研究切入点】选育低PPO活性小麦种质资源是改良小麦籽粒性状和品质育种的重要途径,但目前有关贵州小麦籽粒PPO活性的研究鲜见报道。【拟解决的关键性问题】采用苯酚染色法结合STS分子标记检测对生产中表现优异的135份小麦品种(系)籽粒PPO活性基因组成进行鉴定,旨在筛选出含有低PPO活性的种质资源,为贵州小麦籽粒品质的遗传改良及育种提供参考依据。
1 材料与方法
1. 1 试验材料
供试的135份小麦材料(表1)部分由国家小麦改良中心贵州分中心选育提供,其他材料则从贵州省贵阳、兴义、安顺和惠水等地收集。DNF-910 dsDNA Kit/s试剂盒购自成都百乐科技有限公司;2×Taq PCR MasterMix反应试剂购自生工生物工程(上海)股份有限公司;D2000 DNA Marker购自贵州弥勒天根生物科技有限公司;50×TAE溶液购自北京索莱宝科技有限公司。主要仪器设备:Genova Nano分光光度计(Jenway,英国)、T100TM_Thermal Cycler PCR仪(BIO-RAD,美国)、Fragment AnalyzerTM全自动毛细管电泳系统(AATI,美国)、高速离心机(Thermo,美国)、水平电泳槽(DYCP-32B,北京六一仪器厂)、电泳仪(DYY-6C,北京六一生物技术有限公司)、电热恒温水浴锅(DK-98-Ⅱ,天津泰斯特仪器有限公司)、高速冷冻离心机(Thermo,美国)和摇床(GS-20,杭州米欧仪器有限公司)。
1. 2 小麦籽粒苯酚染色检测
参照孙家柱等(2010)的方法进行苯酚染色检测。选取15粒小麦籽粒置于培养皿中,加水浸泡约18 h,吸干水后加入0.2%苯酚溶液,于室温下静置4 h后目测籽粒的染色情况,对其PPO活性水平进行分级记录。所有苯酚染色于同一时间内(含2次重复)完成,根据籽粒染色程度按不染色、浅绿色、棕色和黑色,分别判定为A、B、C和D级。
1. 3 基因组DNA提取及STS分子标记检测
采用CTAB法提取供试小麦叶片DNA(徐如宏等,2005),以分光光度计检测其浓度和纯度,保证OD260/OD280约为1.8,然后稀释至100 ng/μL作为模板备用。利用位于2A和2D染色体上的STS分子标记PPO16、PPO18和PPO29检测小麦PPO活性相关基因,引物序列及相关信息详见表2。PCR反应体系20.0 μL:含2×Taq PCR MaserMix 7.0 μL,上、下游引物各1.0 μL,DNA模板2.0 μL,ddH2O补足至20.0 μL。扩增程序:94 ℃预变性5 min,94 ℃ 45 s,60/64 ℃ 45/50 s,72 ℃ 1 min,进行37/40个循环;72 ℃延伸10 min。扩增产物利用1.5%琼脂糖凝胶电泳进行检测,电泳缓冲体系0.5×TAE,120 V下电泳50 min,于紫外灯下观察、照相并记录。
1. 4 Fragment AnalyzerTM毛細管电泳检测
根据目标条带的范围选择DNF-910-FR(35-1500 bp)试剂盒进行Fragment AnalyzerTM毛细管电泳检测,将PCR扩增产物加入到样品槽中,按Fragment AnalyzerTM全自动毛细管电泳检测仪操作规程进行运行,电泳结束后以PROSize 3.0进行分析。
2 结果与分析
2. 1 苯酚染色结果分析
利用苯酚染色法浸染135份小麦材料籽粒,结果表明,4份材料未染色(图1-A),为A级;9份呈浅绿色(图1-B),为B级,说明这13份染色较浅的材料携带低PPO活性基因的可能性较大;65份材料呈棕色(图1-C),为C级;57份材料呈黑色(图1-D),为D级,说明这122份材料携带低PPO活性基因的可能性较小。
2. 2 PPO基因分子标记检测结果
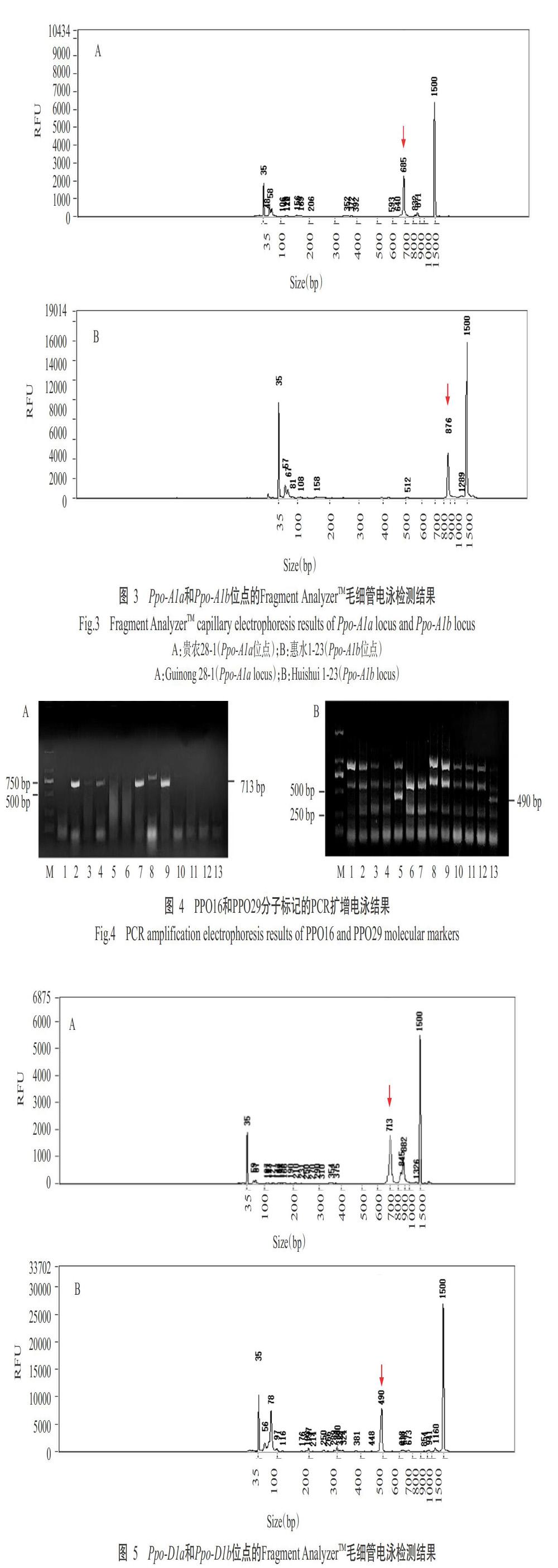
2. 2. 1 Ppo-A1位点基因型分布 利用PPO18分子标记检测Ppo-A1位点基因,扩增产物大小分别为685 bp(高PPO活性)和876 bp(低PPO活性),对应的等位变异类型为Ppo-A1a和Ppo-A1b(陈杰等,2013)。本研究的扩增产物经1.5%琼脂糖凝胶电泳检测在750 bp附近出现两条条带(图2),以Fragment AnalyzerTM毛细管电泳检测可知这两条条带对应为685 bp(图3-A)和876 bp(图3-B),说明利用PPO18分子标记可检测Ppo-A1基因等位变异类型。在135份小麦材料中,有37份材料扩增出685 bp的条带,为Ppo-A1a等位变异类型;13份材料扩增出876 bp的条带,为Ppo-A1b等位变异类型;其他材料未扩增出任何条带,即未含Ppo-A1a和Ppo-A1b等位变异类型。综上所述,135份材料中含有Ppo-A1b基因类型(低PPO活性)的材料较少,仅13份(占9.63%),分别是分枝麦5号、贵麦2号、贵农10-6、惠水1-23、丰优8号、石无芒、08-9选单-2-7、贵农08-6-3、TP08-6-8、贵农08-6-2-1、贵农08-9、张10选-4和丰优5号。
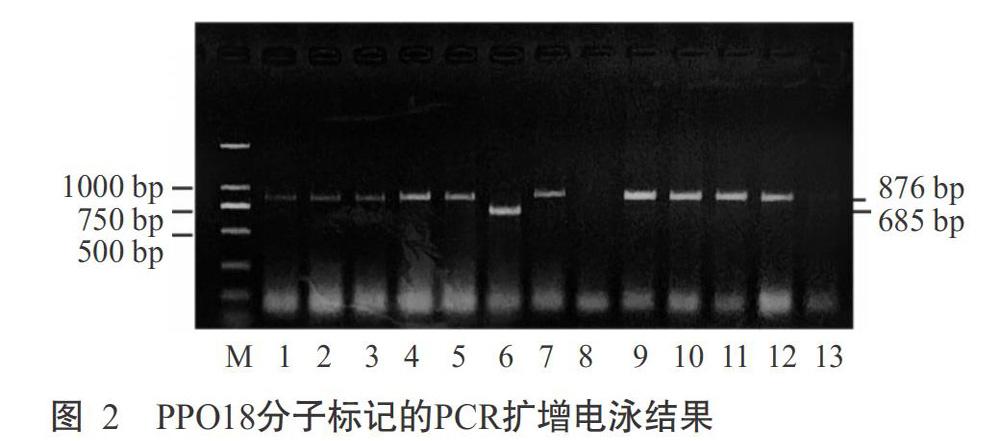
2. 2. 2 Ppo-D1位点基因型分布 在Ppo-D1位点上,STS分子标记引物PPO16可扩增出713 bp的Ppo-D1a基因片段,而引物PPO29无任何扩增产物;STS分子标记引物PPO29可扩增出490 bp的Ppo-D1b基因片段,而引物PPO16无任何扩增产物(陈杰等,2013)。可见,用于检测Ppo-D1位点的STS分子标记PPO16和PPO29可相互补充和验证。本研究的扩增产物经1.5%琼脂糖凝胶电泳检测在700和500 bp附近分别出现明显的条带(图4-A和图4-B),以Fragment AnalyzerTM毛细管电泳检测可知这两条带对应为713 bp(图5-A)和490 bp(图5-B)。在135份小麦材料中,有66份材料扩增出490 bp的条带,为Ppo-D1b等位变异类型;21份材料扩增出713 bp的条带,为Ppo-D1a等位变异类型;其他材料未检测到含Ppo-D1a和Ppo-D1b等位变异类型。综上所述,135份材料中含有Ppo-D1a基因类型(低PPO活性)的材料21份(占15.56%),分别是贵麦2号、惠水1-23、石无芒、08-9选单-2-7、163选-1、兴育206、TP中分08-6选-11、贵农33-12、贵农08-9、贵农08-7-3、XU-5-2、安2014-4、10-4-3-1、吉麦1号、黔990315、张07-10-6、张08-1-2-1、Y-4-1、贵麦1号、163-25和张10选42。
2. 2. 3 Ppo-A1和Ppo-D1位点基因型分布 135份小麦材料的Ppo-A1和Ppo-D1基因位点检测结果如表3所示。2个位点基因类型共有4种,分别为Ppo-A1a/Ppo-D1a(中间型)、Ppo-A1b/Ppo-D1b(中间型)、Ppo-A1a/Ppo-D1b(高PPO活性)和Ppo-A1b/Ppo-D1a(低PPO活性)。4种等位变异类型的小麦材料分别有3、3、24和5份,其余材料只检测到单个基因或未检测到任何PPO基因。可见,135份小麦籽粒中大多数材料不含PPO基因或含单个基因类型,具有双低PPO活性类型的材料仅有5份,分别是贵麦2号、惠水1-23、石无芒、08-9选单-2-7和贵农08-9。
对比苯酚染色结果和STS分子标记检测结果,发现在苯酚染色较浅(A级和B级)的13份材料中有10份材料含Ppo-A1b基因,4份材料含Ppo-D1a基因,其中4份材料同时含有Ppo-A1b/Ppo-D1a基因;苯酚染色较深的C级材料中检测到3份材料含Ppo-A1b基因、17份材料含Ppo-D1a基因,其中1份材料同时含有Ppo-A1b/Ppo-D1a基因;染色最深的D级材料中均未检测到Ppo-A1b或Ppo-D1a基因。综合两种鉴定结果(表3)可知,共有13份材料含有Ppo-A1b基因、21份材料含Ppo-D1a基因,其中5份材料同时含Ppo-A1b/Ppo-D1a基因,分别来自A、B、C级材料。
3 讨论
苯酚染色是目前最常用的底物染色法。孙家柱等(2012)研究表明,级别为0、1和2级的材料中PPO基因的双低组合占92.9%,特别是对低PPO活性材料的选择,苯酚染色结果与基因型分子标记检测结果几乎完全吻合。本研究结果表明,STS分子标记检测到13份材料含有Ppo-A1b基因,其中10份材料来自苯酚染色较浅的A级和B级材料,而苯酚染色最深的D级材料中均未检测到Ppo-A1b基因,与张立平等(2005)、孙家柱等(2012)的研究结论基本一致,说明含有Ppo-A1b基因的材料相对其他基因而言,其苯酚染色程度均不高。但需要注意的是,苯酚染色法鉴定过程中由于染色程度接近,在划分B级和C级时可能会造成主观判断误差。在本研究中有3份含Ppo-A1b基因的材料来自染色较深的C级,其中还有1份材料(贵农08-9)同时含有Ppo-A1b/Ppo-D1a基因,因而对于染色较深的C级材料有必要利用分子标记做进一步鉴定。此外,Mangini等(2014)在四倍体小麦中开发了新标记MG18,且认为与PPO18分子标记相比,MG18分子标记能有效检测四倍体小麦Ppo-A1位点上的4个不同等位基因[Ppo-A1b(低活性)、Ppo-A1e(高活性)、Ppo-A1f(高活性)和Ppo-A1g(低活性)]的分布情况,在针对不同小麦材料的PPO活性基因筛选时可结合这一分子标记进行分子鉴定,以提高选择的准确性。因此,在实际工作中,可利用苯酚染色法对小麦籽粒PPO活性进行初筛,淘汰染色最深的D级材料后,再利用更有效的多种分子标记确认A、B、C级材料中PPO活性基因的组成,进而降低成本和提高育种工作效率。
本研究共筛选到含有低PPO活性基因的材料29份,占21.48%,其中含有双低PPO活性基因的材料5份,占3.70%。说明这批筛选的小麦材料中含有双低PPO活性基因的种质资源较少,与芦静等(2012)在新疆地区、陈杰等(2013)在黄淮地区的研究结果基本一致。对于含有双低PPO活性基因的材料,可直接作为品质改良的亲本材料应用于小麦品质育种研究,而其他含有单个低PPO活性基因的材料可通过复交方式进一步选育出含有双低PPO活性基因的种质材料。此外,今后有必要加大对含有双低PPO活性基因种质资源的引进,为选育含双低PPO活性基因的小麦品种提供支撑。
4 结论
采用苯酚染色法结合STS分子标记检测可对小麦籽粒是否含低PPO活性基因进行准确鉴定。贵麦2号、惠水1-23、石无芒、08-9选单-2-7和贵农08-9等5份含有双低PPO活性基因(Ppo-A1b/Ppo-D1a)的种质资源,可作为亲本材料直接用于小麦籽粒低PPO活性遗传改良及新品种选育。
参考文献:
常成,张海萍,李保云,刘广田. 2007. 小麦籽粒PPO同工酶及其活性分析[J]. 麦类作物学报,27(5):898-903. [Chang C,Zhang H P,Li B Y,Liu G T. 2007. Analysis on PPO isozymes and their activities in kernel of common wheat[J]. Journal of Triticeae Crops,27(5):898-903.]
陳杰,陈锋,詹克慧,崔党群. 2013. 黄淮麦区小麦子粒多酚氧化酶活性基因等位变异的分子检测[J]. 植物遗传资源学报,14(5):900-907. [Chen J,Chen F,Zhan K H,Cui D Q. 2013. Molecular identification of the polyphenol oxidase genes in bread wheat cultivars from Huanghuai wheat region[J]. Journal of Plant Genetic Resources,14(5):900-907.]
何克勤. 2006. 小麦品种多酚氧化酶活性的变异及低PPO活性种质资源的筛选[D]. 合肥:安徽农业大学. [He K Q. 2006. The variation of PPO activity in wheat varieties and selection of low PPO activity of wheat germplasms[D]. Hefei:Anhui Agricultural University.]
芦静,刘娜,梁晓东,周安定,曹俊梅,张新忠,李建疆,曾潮武,黄天荣,高永红,吴新元. 2012. 部分新疆小麦材料多酚氧化酶活性基因分布规律研究[J]. 新疆农业科学,49(1):1-8. [Lu J,Liu N,Liang X D,Zhou A D,Cao J M,Zhang X Z,Li J J,Zeng C W,Huang T R,Gao Y H,Wu X Y. 2012. Molecular identification and distribution of the polyphenol oxidase genes in Xinjiang wheat cultivars[J]. Xinjiang Agricultural Sciences,49(1):1-8.]
司红起. 2008. 小麦籽粒多酚氧化酶生化特性及其控制基因的研究[D]. 合肥:安徽农业大学. [Si H Q. 2008. Bioche-mical characterization of polyphenol oxidase and its controlling genes in common wheat[D]. Hefei:Anhui Agricultural University.]
孙道杰,夏先春,张立平,何中虎,葛秀秀,徐兆华,王辉. 2005. 小麦多酚氧化酶(PPO)活性的SSR标记筛选鉴定与验证[J]. 中国农业科学,38(7):1295-1299. [Sun D J,Xia X C,Zhang L P,He Z H,Ge X X,Xu Z H,Wang H. 2005. Validation of SSR marker assisted selection for polyphenol oxidase activities in common wheat[J]. Scien-tia Agricultural Sinica,38(7):1295-1299.]
孙家柱,刘冬成,阳文龙,罗光彬,张立异,张爱民. 2010. 小麦多酚氧化酶(PPO)活性检测的简易方法及其在育种中的效用分析[C]//中国作物学会. 2010中国作物学会学术年会论文摘要集. [Sun J Z,Liu D C,Yang W L,Luo G B,Zhang L Y,Zhang A M. 2010. A simple method for detecting(PPO) activity of polyphenol oxidase in wheat and its utility in breeding[C]//China Crop Society. Proceedings of the 2010 Annual Meeting of the Chinese Crop Society.]
孙家柱,赵军涛,刘冬成,阳文龙,罗光彬,张立异,张相岐,张爱民. 2012. 小麦籽粒多酚氧化酶(PPO)检测方法的优化及其在育种中的应用[J]. 麦类作物学报,32(3):448-453. [Sun J Z,Zhao J T,Liu D C,Yang W L,Luo G B,Zhang L Y,Zhang X Q,Zhang A M. 2012. Modification to the test method of polyphenol oxidase(PPO) activity in wheat seeds and its usage in breeding programs[J]. Journal of Triticeae Crops,32(3):448-453.]
孙树贵,李艳丽,鲁敏,张军,王秀娟,武军,赵继新,杨群慧,刘淑会,陈新宏. 2013. 67份美国小麦品种矮秆基因的分子标记检测[J]. 麦类作物学报,33(6):1087-1092. [Sun S G,Li Y L,Lu M,Zhang J,Wang X J,Wu J,Zhao J X,Yang Q H,Liu S H,Chen X H. 2013. Distribution of dwarfing genes in 67 American wheat cultivars detected by molecular markers[J]. Journal of Triticeae Crops,33(6):1087-1092.]
肖永贵,何心尧,刘建军,孙道杰,夏先春,何中虎. 2008. 中国冬小麦品种多酚氧化酶活性基因等位变异检测及其分布规律研究[J]. 中国农业科學,41(4):954-960. [Xiao Y G,He X Y,Liu J J,Sun D J,Xia X C,He Z H. 2008. Molecular identification and distribution of the polyphenol oxidase genes in Chinese winter wheat cultivars[J]. Scientia Agricultural Sinica,41(4):954-960.]
徐如宏,任明见,思彬彬,张超,张庆勤. 2005. 贵农001中抗白粉病基因的RAPD标记研究[J]. 山地农业生物学报,24(4):283-286. [Xu R H,Ren M J,Si B B,Zhang C,Zhang Q Q. 2005. RAPD marking study on powdery resistance gene in Guinong 001[J]. Journal of Mountain Agriculture and Biology,24(4):283-286.]
杨雪,董立峰,付金锋,郑国勇,王凤宝. 2014. 低酚酶活性选择对小麦面粉褐变的影响[J]. 核农学报,28(5):851-860. [Yang X,Dong L F,Fu J F,Zheng G Y,Wang F B. 2014. Effects selections for low poly phenol oxidase acti-vity on wheat flour browning[J]. Journal of Nuclear Agricultural Sciences,28(5):851-860.]
张立平,葛秀秀,何中虎,王德森,闫俊,夏先春,Mark W Sutherland. 2005. 普通小麦多酚氧化酶活性的QTL分析[J]. 作物学报,31(1):7-10. [Zhang L P,Ge X X,He Z H,Wang D S,Yan J,Xia X C,Sutherland M W. 2005. Mapping QTLs for polyphenol oxidase activity in a DH population from common wheat[J]. Acta Agronomica Sinica,31(1):7-10.]
郑文寅,汪帆,司红起,张文明,姚大年. 2013. 普通小麦籽粒LOX、PPO活性和类胡萝卜素含量变异及对全麦粉色泽的影响[J]. 中国农业科学,46(6):1087-1094. [Zheng W Y,Wang F,Si H Q,Zhang W M,Yao D N. 2013. Varia-tions of LOX and PPO activities and carotenoid content as well as their influence on whole flour color in common wheat[J]. Scientia Agricultural Sinica,46(6):1087-1094.]
祝梓博. 2017. 小麦多酚氧化酶基因克隆分析及其分子标记开发[D]. 郑州:河南农业大学. [Zhu Z B. 2017. Cloning and analysis of polyphenol oxidase gene and molecular markers development in wheat[D]. Zhengzhou: Henan Agricultural University.]
Fuerst E P,Anderson J V,Morris C F. 2006. Delineating the role of polyphenol oxidase in the darkening of alkaline wheat noodles[J]. Journal of Agricultural and Food Che-mistry,54(6):2378-2384.
He X Y,He Z H,Zhang L P,Sun D J,Morris C F,Fuerst E P. 2007. Allelic variation of polyphenol oxidase (PPO) genes located on chromosomes 2A and 2D and development of functional markers for the PPO genes in common wheat[J]. TAG. Theoretical and applied genetics. Theoretische und angewandte Genetik,115(1):47-58.
Jukanti A K,Bruckner P L,Fischer A M. 2004. Evaluation of wheat polyphenol oxidase genes[J]. Cereal Chemistry,81(4):481-485.
Mangini G,Taranto F,Delvecchio L N,Pasqualone A,Blanco A. 2014. Development and validation of a new Ppo-A1 marker useful for marker-assisted selection in tetraploid wheats[J]. Molecular Breeding,34(2):385-392.
Raman R,Raman H,Johnstone K,Lisle C,Smith A,Matin P,Allen H. 2005. Genetic and in silico comparative mapping of the polyphenol oxidase gene in bread wheat (Triticum aestivum L.)[J]. Functional & Integrative Genomics,5(4):185-200.
Rodriguez-Suarez C,Atienza S G. 2014. Polyphenol oxidase genes in Hordeum chilense and implications in tritordeum breeding[J]. Molecular Breeding,34(4):1867-1877.
Sun D J,He Z H,Xia X C,Zhang L P,Morris C F,Appels R,Ma W J,Wang H. 2005. A Novel STS marker for polyphenol oxidase activity in bread wheat[J]. Molecular Breeding,16(3):209-218.
(責任编辑 兰宗宝)
