薏苡油脂合成关键基因克隆及其生物信息学分析
2020-05-11付瑜华蒙秋伊李秀诗杨小雨敖茂宏周祥申刚刘凡值
付瑜华 蒙秋伊 李秀诗 杨小雨 敖茂宏 周祥 申刚 刘凡值

摘要:【目的】掌握薏苡二酰甘油酰基转移酶基因(ClDGAT)、内质网油酸脱饱和酶基因(ClFAD2)和硬脂酸脱饱和酶基因(ClSAD)的生物信息学特性,明确薏苡油脂代谢调控机制,为今后开展以提高薏苡含油量和改良脂肪酸组成为目标的育种研究提供理论依据。【方法】利用RT-PCR和RACE克隆薏苡油脂合成关键基因(ClDGAT、ClFAD2和ClSAD),通过染色体步移技术获得ClFAD2和ClSAD基因启动子序列,并以ExPASy ProtParam tool、SMART、TMHMM Server v.2.0和SOPMA等在线软件进行生物信息学分析。【结果】从薏苡叶片中成功克隆获得ClDGAT、ClFAD2和ClSAD基因,NCBI登录号分别为MK589802、MK589803和MK589804。其中,ClDGAT基因cDNA序列全长1842 bp,其开放阅读框 (ORF)为1539 bp,编码512个氨基酸;ClFAD2基因cDNA序列全长1768 bp,其ORF为1164 bp,编码387个氨基酸,无内含子;ClSAD基因cDNA序列全长1727 bp,其ORF为1182 bp,编码393个氨基酸,有2个内含子。ClDGAT和ClFAD2为不稳定蛋白,ClSAD为稳定蛋白;ClDGAT为疏水性蛋白,ClFAD2和ClSAD为亲水性蛋白。ClDGAT蛋白含有MBOAT功能域,有9个跨膜区;ClFAD2蛋白含有2个功能域(DUF3473和FA_desaturase),有3个跨膜区;ClSAD蛋白含有FA_desaturase_2功能域,无跨膜区。基于蛋白氨基酸序列相似性构建的系统发育进化树显示,ClDGAT、ClFAD2和ClSAD均与高粱对应的蛋白聚类在同一分支上,即薏苡在进化关系上与高粱的亲缘关系最近。ClFAD2和ClSAD基因启动子序列上均含有光响应元件(Light responsive element)、生长素响应元件(Auxin-responsive element)、茉莉酸甲酯响应元件(MeJA-responsive element)和ABA响应元件(ABA responsive element)。【结论】ClFAD2和ClSAD基因启动子序列上含有抗逆性相关顺式作用元件和植物激素响应元件,说明ClFAD2和ClSAD基因不仅参与薏苡的籽粒发育及油脂合成,还可能与植株的抗逆响应相关。
关键词: 薏苡;ClDGAT基因;ClFAD2基因;ClSAD基因;油脂合成;顺式作用元件
0 引言
【研究意义】薏苡(Coix lacryma-jobi)具有较高的营养、保健及药用价值,是我国传统的药食兼用作物(Hsia et al.,2006;杨红亚等,2007;李秀诗等,2019)。薏苡仁油和薏苡糠油具有抗肿瘤和免疫调节等药理作用(覃玉桃等,2001;Lee et al.,2008;Chen et al.,2012),尤其以薏苡仁油作为主要成分研制出的康莱特注射液已广泛用于肺癌、肝癌和鼻癌等疾病治疗(李毓和胡笑克,2005;Fu et al.,2014;Liu et al.,2014;Qi et al.,2015)。《中华人民共和国药典》(2015年版)将薏苡仁甘油三油酸酯含量作为薏苡仁药材质量的评价指标,即薏苡仁油脂含量是薏苡仁药用和保健功效评价的重要指标。因此,开展薏苡油脂合成关键酶基因克隆及其生物信息学分析,不仅有利于揭示薏苡油脂合成代谢调控机理,还能为其分子遗传育种研究提供理论依据。【前人研究进展】植物籽粒油脂合成是一个复杂的过程,包括脂肪酸合成、脂肪酸合成后修饰及甘油三酯组装。在拟南芥中,目前已发现600多个参与油脂代谢的相关基因,涉及120个酶促反应(Beisson et al.,2003;Li-Beisson et al.,2010)。多种植物突变体及基因工程研究均表明,硬脂酸脱饱和酶(Stearoyl-ACP desaturase,SAD)(Luo et al.,2006,2009)、内质网油酸脱饱和酶(Fatty acid desaturation 2,FAD2)(Patel et al.,2004)、二酰甘油酰基转移酶(Diacylglycerol acyltransferase,DGAT)(Jako et al.,2001)分别是油酸、亚油酸和甘油三酯合成的关键酶,直接影响植物组织中不饱和脂肪酸油酸及亚油酸和甘油三酯的含量。Taylor等(2009)研究表明,在油菜中过表达DGAT1基因,其种子油脂含量增加14%;Li-Beisson等(2010)研究表明,在白菜型油菜中反義表达甘蓝型油菜SAD基因,其转基因白菜型油菜种子中的硬脂酸含量增加40%;Du等(2016)研究证实,在拟南芥和玉米种子中特异过表达ZmSAD1基因后,其种子中的硬脂酸含量较正常植株明显降低;Shi等(2017)、Yang等(2018)利用RNAi技术分别抑制油菜和大豆的FAD2基因表达,结果发现转基因油菜和大豆种子中的油酸含量明显提高;Zheng等(2017)将AhDGAT1基因转入烟草后,其转基因烟草种子油脂含量提高14.7%~20.9%;Chellamuthu等(2019)在缺失TAG合成基因的酵母突变体中表达芝麻DGAT1基因,结果显示转基因酵母表现出较高的油含量;Zheng等(2019)在拟南芥种子中特异表达椰子DGAT2基因,发现转基因种子亚油酸含量显著增加。【本研究切入点】薏苡籽粒油脂含量在不同材料中存在明显差异(Liu et al.,2015;杨阳等,2017),但导致其差异的遗传基础至今尚未明确,有关薏苡籽粒油脂合成及代谢的调控机制研究也鲜见报道。【拟解决的关键问题】利用RT-PCR和RACE克隆薏苡油脂合成关键基因(ClSAD、ClFAD2和ClDGAT),通过染色体步移技术获得ClSAD和ClFAD2基因的启动子,并对获得的所有序列进行生物信息学分析,旨在明确薏苡油脂代谢调控机制,为今后开展以提高薏苡含油量和改良脂肪酸组成为目标的育种研究提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料为贵州薏苡主栽品种兴仁小白壳。兴仁小白壳种植于贵州省农业科学院亚热带作物研究所资源圃内,于薏苡生长至3~4叶期时采集叶片, -20 ℃保存备用。TRIzol试剂和5' RACE System for Rapid Amplification of cDNA Ends(Version 2.0)购自Invitrogen公司,RevertAid First Strand cDNA Synthesis购自Fermentas公司,Ex Taq DNA聚合酶和Genome Walking Kit购自宝生物工程(大连)有限公司,SMARTerTM RACE 3' Kit试剂盒购自Clontech公司,琼脂糖凝胶回收试剂盒购自OMEGA公司。主要仪器设备:T100梯度PCR仪(Bio-Rad,美国),DYY-6C型双稳定时电泳仪(北京六一生物科技有限公司),DYCP-32B型琼脂糖水平电泳仪(北京六一生物科技有限公司),Gel DocTM XR+凝胶成像系统(Bio-Rad,美国)。
1. 2 DNA提取及cDNA合成
采用CTAB法提取薏苡叶片DNA;使用TRIzol试剂提取薏苡叶片RNA,然后使用RevertAid First Strand cDNA Synthesis试剂盒反转录合成cDNA。获得的薏苡DNA和cDNA均采用1.0%琼脂糖凝胶电泳检测其浓度,-20 ℃保存备用。
1. 3 油脂合成关键基因cDNA序列克隆
根据NCBI上已公布的拟南芥、水稻、高粱、玉米、二穗短柄草和大豆等的SAD、FAD2和DGAT基因序列,采用ClustalX分别对3个基因的中间片段进行简并引物设计(表1),引物委托生工生物工程(上海)股份有限公司合成。以cDNA为模板,中间片段的PCR反应体系50.0 μL:2×Ex Taq Buffer 25.0 μL,dNTP Mix(10 mmol/L)1.0 μL,Ex Taq DNA聚合酶1.0 μL,cDNA模板5.0 μL,上、下游引物(10×)各1.5 μL,ddH2O 15.0 μL。擴增程序:94 ℃预变性2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,用胶回收试剂盒回收目的片段并送至生工生物工程(上海)股份有限公司进行测序鉴定。
根据3个基因的中间片段序列,采用Primer Premier 5.0设计各基因的5'-RACE引物(3条)和3'-RACE引物(2条),引物序列见表1。5'-RACE扩增和3'-RACE扩增分别根据5' RACE System for Rapid Amplification of cDNA Ends(Version 2.0)和SMAR-TerTM RACE 3' Kit说明进行操作,扩增片段经1.0%琼脂糖凝胶电泳检测后,用胶回收试剂盒回收目的片段并送至生工生物工程(上海)股份有限公司进行测序鉴定。
1. 4 ClFAD2和ClSAD基因组序列及其启动子扩增
根据已扩增获得的cDNA序列,利用Primer Premier 5.0设计扩增ClFAD2和ClSAD基因组序列的特异引物(表1)。以DNA为模板,PCR反应体系同1.3,扩增程序:94 ℃预变性2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s(ClFAD2基因)或3 min(ClSAD基因),进行35个循环;72 ℃延伸10 min。PCR扩增片段经1.0%琼脂糖凝胶电泳检测后进行测序鉴定。此外,根据ClFAD2和ClSAD基因组序列,采用Primer Premier 5.0分别设计2对特异引物(表1)沿启动子方向扩增2次,对应扩增的引物分别命名为SP1-1/SP2-1和SP1-2/SP2-2。启动子扩增按照Genome Walking Kit说明进行操作,扩增片段经1.0%琼脂糖凝胶电泳检测后进行测序鉴定。
1. 5 生物信息学分析
采用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)对获得的3个基因cDNA序列进行开放阅读框(ORF)分析,并推导其蛋白氨基酸序列;利用Gene Structure Display Server 2.0绘制基因结构图(Hu et al.,2015);以ExPASy ProtParam tool(https://web.expasy.org/protparam/)分析编码蛋白氨基酸组成及其理化性质;运用SMART(http://smart.embl-heidelberg.de/)预测蛋白功能域;以TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白跨膜区;分别采用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)预测蛋白二、三级结构;以MEGA 7.0构建基于DGAT、FAD2和SAD氨基酸序列相似性的系统发育进化树;并利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子序列顺式作用元件分析。
2 结果与分析
2. 1 ClDGAT、ClFAD2和ClSAD基因克隆及测序分析结果
根据NCBI上已公布的DGAT、FAD2和SAD基因保守结构域序列设计简并引物,从薏苡叶片中克隆获得ClDGAT基因(图1-A)、ClFAD2基因(图1-B)和ClSAD基因(图1-C)的中间序列分别为1120、832和661 bp。5'-RACE克隆获得3个基因的5'端非编码区(5'-UTR)序列分别为564、378和448 bp(图1-D、图1-E和图1-F);3'-RACE克隆获得3个基因的3'端非编码区(3'-UTR)序列分别为414、795和746 bp(图1-G、图1-H和图1-I)。将获得的序列进行拼接后,得到ClDGAT基因cDNA序列全长1842 bp,其ORF为1539 bp,NCBI登录号MK589802;ClFAD2基因cDNA序列全长1768 bp,其ORF为1164 bp,NCBI登录号MK589803;ClSAD基因cDNA序列全长1727 bp,其ORF为1182 bp, NCBI登录号MK589804。此外,以薏苡叶片DNA为模板,从基因组扩增获得的ClFAD2和ClSAD基因序列分别为1189和4288 bp,与对应的cDNA序列比对发现ClFAD2基因无内含子,而ClSAD基因有2个内含子(图2),其最大内含子为1747 bp。
2. 2 ClDGAT、ClFAD2和ClSAD蛋白理化性质预测分析结果
ClDGAT、ClFAD2和ClSAD蛋白理化性质预测分析结果(表2)表明,ClDGAT蛋白包含512个氨基酸,分子量为57656.74 Da,理论等电点(Ip)为9.14;ClFAD2蛋白包含387个氨基酸,分子量为44226.96 Da,Ip为8.38;ClSAD蛋白包含393个氨基酸,分子量为44736.03 Da,Ip为6.48。在氨基酸残基组成方面,ClDGAT和ClSAD蛋白中以亮氨酸含量最高,其次为丙氨酸,而ClFAD2蛋白以丙氨酸含量最高,其次为亮氨酸。此外,ClDGAT和ClFAD2为不稳定蛋白,ClSAD为稳定蛋白;ClDGAT为疏水性蛋白,ClFAD2和ClSAD为亲水性蛋白。
2. 3 ClDGAT、ClFAD2和ClSAD蛋白功能域及其结构预测结果
使用SMART预测ClDGAT、ClFAD2和ClSAD蛋白功能域,结果表明,ClDGAT蛋白含有MBOAT功能域,位于第223~501位氨基酸残基间,MBOAT家族为膜结合蛋白,具有酰基转移酶功能,通常含有一个保守的组氨酸。ClFAD2蛋白含有2个功能域(DUF3473和FA_desaturase),分别位于第4~73位和第90~355位氨基酸残基间,且这2个功能域均为脂肪酸去饱和酶功能域,其中FA_desaturase功能域具有催化在脂肪酸Delta位置加入双键的活性。ClSAD蛋白含有FA_desaturase_2功能域,位于第65~387位氨基酸残基间,也具有催化在脂肪酸Delta位置加入双键的活性。蛋白跨膜结构预测分析结果表明,ClDGAT蛋白有9个跨膜区,ClFAD2蛋白有3个跨膜区,而ClSAD蛋白无跨膜区。
ClDGAT、ClFAD2和ClSAD蛋白二级结构预测结果表明,3个蛋白的二级结构均含有4种结构类型,且以α-螺旋和無规则卷曲为主(表3)。利用SWISS-MODEL预测3个蛋白的三级结构,结果如图3所示。ClDGAT蛋白的第369~443位氨基酸残基能与D-alanyl转运蛋白DltB模板比对上,其QMEAN4为-1.95(图4-A),GMQE为0.07;ClFAD2蛋白的第89~161位氨基酸残基能与模板酰基-CoA去饱和酶比对上,其QMEAN4为-3.83(图4-B),GMQE为0.08;ClSAD蛋白的第46~393位氨基酸残基能与模板酰基-ACP去饱和酶比对上,其QMEAN4为-1.24(图4-C),GMQE为0.82。3个蛋白三级结构的QMEAN4均大于-4.00,说明采用SWISS-MODEL进行同源建模的质量较好,尤其是ClSAD蛋白三级结构的GMQE接近于1.00,即该结果较可靠。
2. 4 ClDGAT、ClFAD2和ClSAD蛋白氨基酸序列进化分析结果
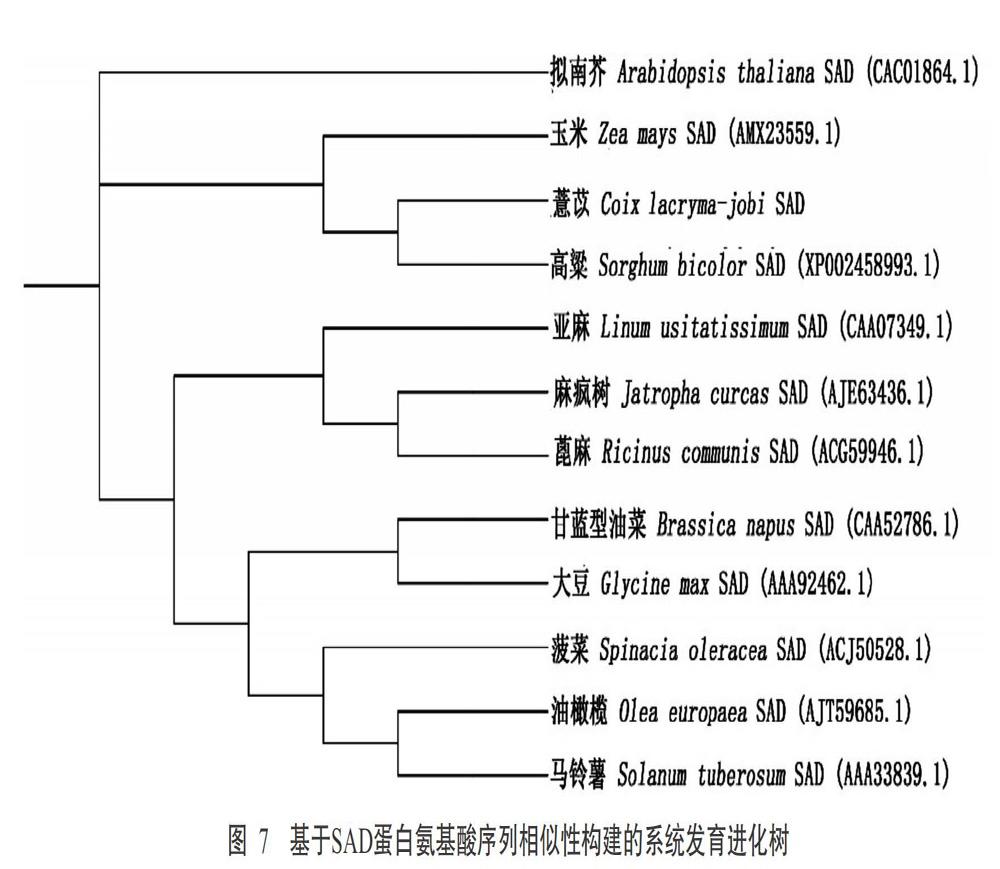
采用邻接法(Neighbor-joining,NJ)将ClDGAT、ClFAD2和ClSAD蛋白氨基酸序列分别与已知的13个植物DGAT蛋白氨基酸序列、14个植物FAD2蛋白氨基酸序列和11个植物SAD蛋白氨基酸序列构建系统发育进化树。由图5~图7可看出,ClDGAT、ClFAD2和ClSAD均与来源于高粱的对应蛋白聚类在同一分支上,说明薏苡在进化关系上与高粱的亲缘关系最近。DGAT蛋白在植物中存在5种类型(Maraschin et al.,2019),Turchetto-Zolet等(2016)对其中4种类型(DGAT1、DGAT2、DGAT3和WS/DGAT)进行氨基酸序列比对分析并基于氨基酸序列相似性构建系统发育进化树,发现4种类型能较好地聚为四类。根据聚类分析结果可知,本研究克隆获得的ClDGAT基因应为ClDGAT2基因。
2. 5 ClFAD2和ClSAD基因启动子序列分析结果
ClFAD2和ClSAD基因启动子序列扩增电泳结果见图8,每个基因均沿启动子方向进行2次染色体步移,结果获得ClFAD2基因ATG上游序列共1900 bp(图8-A和图8-B),ClSAD基因ATG上游序列共2337 bp(图8-C和图8-D)。采用PlantCARE对2个基因启动子序列上的顺式作用元件进行分析,结果如表4所示。ClFAD2和ClSAD基因启动子序列上均含有光响应元件(Light responsive element)、生长素响应元件(Auxin-responsive element)、茉莉酸甲酯响应元件(MeJA-responsive element)和ABA响应元件(ABA responsive element),而ClSAD基因启动子序列上还包括缺氧诱导的增强子元件(Enhancer-like element involved in anoxic specific inducibility)、低温响应元件(Low-temperature responsive element)和干旱诱导的MYB结合位点(MYB binding site involved in drought-inducibility)。
3 讨论
本研究克隆获得ClDGAT、ClFAD2和ClSAD基因cDNA全长序列及ClFAD2、ClSAD基因组和启动子序列,并对ClDGAT、ClFAD2和ClSAD基因进行生物信息学分析。本课题组曾多次尝试克隆ClDGAT基因组序列,但均未成功,推测其含有较长的内含子或复杂结构。高等植物SAD基因存在结构多样性(赵丰兰等,2018),蓖麻、亚麻和三叶草的SAD基因有内含子,可可、丹参、拟南芥和油茶等植物的SAD基因无UTR序列,而银杏、大豆、麻疯树和花生等植物的SAD基因均含有5'-UTR和3'-UTR,因此推测不同植物的SAD基因表达调控模式存在明显差异。本研究克隆获得的薏苡SAD基因不仅包含5'-UTR和3'-UTR,还存在2个内含子。Wang和Dooner(2012)根据bz富基因区域7个基因在薏苡、高粱和玉米中的比对分析,推测出薏苡与玉米分化于1210万年前,而与高粱分化于930万年前。本研究中基于蛋白氨基酸序列相似性构建的系统发育进化树显示,ClDGAT、ClFAD2和ClSAD分别与SbDGAT、SbFAD2和SbSAD聚类在同一分支上,与Leseberg和Duvall(2009)、Cai等(2014)的研究结论一致,说明薏苡在进化关系上与高粱的亲缘关系最近。
ClFAD2和ClSAD基因启动子序列上均含有与抗逆性相关及植物激素响应的顺式作用元件,如光响应元件、ABA响应元件、茉莉酸甲酯响应元件和生长素响应元件。已有研究表明,茉莉酸甲酯和生长素均与提高植物在干旱和低温胁迫下的抗性表现相关(陈丹等,2016;忽雪琦等,2018;马晓寒等,2018),说明ClFAD2和ClSAD基因的功能可能与植物抗逆响应相关。与ClFAD2基因启动子相比,ClSAD基因启动子含有更多的植物激素响应元件及抗逆性相关响应元件,推测在薏苡遭遇环境胁迫或体内植物激素改变的情况下,ClSAD基因的表达变化更敏感和迅速。尤其在低温胁迫下,ClSAD作为脂肪酸去饱和系列反应中的第一个关键酶,在调控膜饱和脂肪酸与不饱和脂肪酸比例及维持植物细胞膜呈正常流动镶嵌状态方面发挥重要作用(赵丰兰等,2018)。此外,ClSAD基因啟动子序列上含有胚乳表达和分生组织表达相关的顺式作用元件,说明ClSAD基因可能为组织特异表达或诱导表达,与赵丰兰等(2018)的研究报道一致,即大部分已报道的SAD基因在植物绿色器官和发育期种子中高表达,如亚麻SAD基因的表达量在种子子房中最高(Fofana et al.,2006),油樟SAD基因的表达量在发育叶片中最高(Luo et al.,2009),高油玉米中的SAD基因表达量高于普通玉米(Liu et al.,2009)。
植物种子油脂含量是一个数量性状,由少数几个主效基因(与油分组成性状相关)和多个微效基因调控(Li et al.,2013),虽然其调控途径复杂,但可通过遗传育种和人工选择进行高油材料创制(Moose et al.,2004);而种子油分组成仅受少数关键基因调控(Li et al.,2013)。本研究克隆获得3个薏苡油脂合成关键基因及其中2个基因的启动子序列,为后续开展薏苡油脂含量和成分的遗传结构及调控机理研究提供了基因资源。
4 结论
ClFAD2和ClSAD基因启动子序列上含有抗逆性相关顺式作用元件和植物激素响应元件,说明ClFAD2和ClSAD基因不仅参与薏苡的籽粒发育及油脂合成,还可能与植株的抗逆响应相关。
参考文献:
陈丹,王卫安,岳全奇,赵琴. 2016. 植物生长素响应冷胁迫反应的研究进展[J]. 植物生理学报,52(7):989-997. [Chen D,Wang W A,Yue Q Q,Zhao Q. 2016. Research progress of plant auxin as a regulator of cold stress response[J]. Plant Physiology Journal,52(7):989-997.]
忽雪琦,李东阳,严加坤,张岁岐. 2018. 干旱胁迫下外源茉莉酸甲酯对玉米幼苗根系吸水的影响[J]. 植物生理学报,54(6):991-998. [Hu X Q,Li D Y,Yan J K,Zhang S Q. 2018. Effects of exogenous methyl jasmonate on water absorption capacity of maize(Zea mays L.) seedling root under drought stress[J]. Plant Physiology Journal,54(6):991-998.]
李秀诗,周祥,李志芳,黎青,杨成龙,周明强,付瑜华. 2019. 基于AFLP标记的贵州及其邻省薏苡种质资源遗传多样性分析[J]. 南方农业学报,50(9):1931-1936. [Li X S,Zhou X,Li Z F,Li Q,Yang C L,Zhou M Q,Fu Y H. 2019. Genetic diversity of Coix lacryma-jobi L. germplasm resources from Guizhou and its adjacent provinces based on AFLP markers[J]. Journal of Southern Agriculture,50(9):1931-1936.]
李毓,胡笑克. 2005. 薏苡仁酯对人鼻咽癌细胞裸鼠移植瘤的放射增敏作用[J]. 华夏医学,18(2):147-148. [Li Y,Hu X K. 2005. Increased radiosensitivity of transplanted human nasopharyngeal carcinoma in nude mice by coixenolide[J]. Acta Medicinae Sinica,18(2):147-148.]
马晓寒,张杰,张环纬,陈彪,温心怡,许子成. 2018. 通过外源MeJA抑制H2O2积累提高烟草的耐冷性[J]. 作物学报,45(3):411-418. [Ma X H,Zhang J,Zhang H W,Chen B,Wen X Y,Xu Z C. 2018. Exogenous MeJA improves cold tolerance of tobacco by inhibiting H2O2 accumulation[J]. Acta Agronomica Sinica,45(3):411-418.]
覃玉桃,韦长元,李挺. 2001. 薏苡仁提取物注射液对晚期原发性肝癌患者免疫功能影响的研究[J]. 中华肿瘤防治杂志,8(1):23-24. [Qin Y T,Wei C Y,Li T. 2001. The effect of KLT(KangLaiTe) on immune function in patients with advanced primary hepatocarcinoma[J]. China Journal of Cancer Prevention and Treatment,8(1):23-24.]
杨红亚,王兴红,彭谦. 2007. 薏苡仁抗肿瘤活性研究进展[J]. 中草药,38(8):7-9. [Yang H Y,Wang X H,Peng Q. 2007. Research progress in anti-tumor activity of Coix seed[J]. Chinese Traditional and Herbal Drugs,38(8):7-9.]
杨阳,杜疏炀,孙艺琦,韩婷,贾敏,秦陆平. 2017. 不同产地薏苡中有效成分甘油三油酸酯和薏苡素的测定[J]. 中草药,48(3):578-581. [Yang Y,Du S Y,Sun Y Q,Han T,Jia M,Qin L P. 2017. Determination of effective contents triolein and coixol in Coix lacrymajobi var. mayuen from different origins[J]. Chinese Traditional and Herbal Drugs,48(3):578-581.]
趙丰兰,张晗,段永波,薛建平. 2018. 高等植物硬脂酰-ACP脱饱和酶基因表达模式及在响应温度胁迫中的作用[J]. 分子植物育种,16(22):7350-7361. [Zhao F L,Zhang H,Duan Y B,Xue J P. 2018. Expression pattern of stearoyl-ACP desaturase gene and its response to high temperature in higher plants[J]. Molecular Plant Breeding,16(22):7350-7361.]
Beisson F,Koo A J,Ruuska S,Schwender J,Pollard M,The-len J J,Paddock T,Salas J J,Milcamps A,Mhaske V B,Cho Y,Ohlrogge J B. 2003. Arabidopsis genes involved in acyl lipid metabolism. A 2003 census of the candidates,a study of the distribution of expressed sequence tags in organs,and a web-based database[J]. Plant Physio-logy,132(2):681-697.
Cai Z,Liu H,He Q,Pu M,Chen J,Lai J,Li X,Jin W. 2014. Differential genome evolution and speciation of Coix lacryma-jobi L. and Coix aquatica Roxb. hybrid Guangxi revealed by repetitive sequence analysis and fine karyoty-ping[J]. BMC Genomics,15:1025. doi:10.1186/1471-2164-15-1025.
Chellamuthu M,Kumaresan K,Subramanian S,Muthumani-ckam H. 2019. Functional analysis of sesame diacylgly-cerol acyltransferase and phospholipid:Diacylglycerol acyltransferase genes using in silico and in vitro approaches[J]. Plant Molecular Biology Reporter,37:146-156.
Chen H J,Lo Y C,Chiang W. 2012. Inhibitory effects of adlay bran(Coix lachryma-jobi L. var. ma-yuen Stapf) on chemical mediator release and cytokine production in rat basophilic leukemia cells[J]. Journal of Ethnopharmaco-logy,141(1):119-127.
Du H,Huang M,Hu J,Li J. 2016. Modification of the fatty acid composition in Arabidopsis and maize seeds using a stearoyl-acyl carrier protein desaturase-1(ZmSAD1) gene[J]. BMC Plant Biology,16(1):137. doi:10.1186/s12870-016-0827-z.
Fofana B,Cloutier S,Duguid S,Ching J,Rampitsch C. 2006. Gene expression of stearoyl-ACP desaturase and delta12 fatty acid desaturase 2 is modulated during seed development of flax(Linum usitatissimum)[J]. Lipids,41(7):705-712.
Fu F,Wan Y,Mulati,Wu T. 2014. Kanglaite injection combined with hepatic arterial intervention for unresectable hepatocellular carcinoma:A meta-analysis[J]. Journal of Cancer Research and Therapeutics,10(S1):38-41.
Hu B,Jin J,Guo A Y,Zhang H,Luo J,Gao G. 2015. GSDS 2.0:An upgraded gene feature visualization server[J]. Bioinformatics,31(8):1296-1297.
Hsia S M,Chiang W,Kuo Y H,Wang P S. 2006. Downregulation of progesterone biosynthesis in rat granulosa cells by adlay(Coix lachryma-jobi L. var ma-yuen Stapf.) bran extracts[J]. International Journal of Impotence Research,18(3):264-274.
Jako C,Kumar A,Wei Y,Zou J,Barton D L,Giblin E M,Covello P S,Taylor D C. 2001. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylgly-cerol acyltransferase enhances seed oil content and seed weight[J]. Plant Physiology,126(2):861-874.
Lee M Y,Lin H Y,Cheng F,Chiang W,Kuo Y H. 2008. Isolation and characterization of new lactam compounds that inhibit lung and colon cancer cells from adlay(Coix lachrymal-jobi L. var. ma-yuen Stapf) bran[J]. Food and Chemical Toxicology,46(6):1933-1939.
Leseberg C H,Duvall M R. 2009. The complete chloroplast genome of Coix lacryma-jobi and a comparative molecular evolutionary analysis of plastomes in cereals[J]. Journal of Molecular Evolution,69(4):311-318.
Li-Beisson Y,Shorrosh B,Beisson F,Andersson M X,Arondel V,Bates P D,Baud S,Bird D,Debono A,Durrett T P,Franke R B,Graham I A,Katayama K,Kelly A A,Larson T,Markham J E,Miquel M,Molina I,Nishida I,Rowland O,Samuels L,Schmid K M,Wada H,Welti R,Xu C,Zallot R,Ohlrogge J. 2010. Acyllipid metabolism[J]. The Arabidopsis Book,8:e0133.doi:10.1199/tab. 0133.
Li H,Peng Z,Yang X,Wang W,Fu J,Wang J,Han Y,Chai Y,Guo T,Yang N,Liu J,Warburton M L,Cheng Y,Hao X,Zhang P,Zhao J,Liu Y,Wang G,Li J,Yan J. 2013. Genome-wide association study dissects the genetic architecture of oil biosynthesis in maize kernels[J]. Nature Genetics,45(1):43-50.
Liu X,Yang Q,Xi Y,Yu K,Wang W,Zhao X,Kou X. 2014. Kanglaite injection combined with chemotherapy versus chemotherapy alone in the treatment of advanced non-small cell lung carcinoma[J]. Journal of Cancer Research and Therapeutics,10(S1):46-51.
Liu X,Zhang X,Rong Y Z,Wu J H,Yang Y J,Wang Z W. 2015. Rapid determination of fat,protein and amino acid content in Coix seed using near-infrared spectroscopy technique[J]. Food Analytical Methods,8(2):334-342.
Liu Z J,Yang X H,Fu Y. 2009. SAD,a stearoyl-acyl carrier protein desaturase highly expressed in high-oil maize inbred lines[J]. Russian Journal of Plant Physiology,56(5):709-715.
Luo T,Deng W Y,Zeng J,Zhang F L. 2009. Cloning and characterization of a stearoyl-acyl carrier protein desaturase gene from Cinnamomum longepaniculatum[J]. Plant Molecular Biology Reporter,27:13. doi:10.1007/s11105-008-0046-3.
Luo T,Peng S M,Deng W Y,Ma D W,Xu Y,Xiao M,Chen F. 2006. Characterization of a new stearoyl-acyl carrier protein desaturase gene from Jatropha curcas[J]. Biotechnology Letters,28(9):657-662.
Maraschin F D S,Kulcheski F R,Segatto A L A,Trenz T S,Barrientos-Diaz O,Margis-Pinheiro M,Margis R,Turchetto-Zolet A C. 2019. Enzymes of glycerol-3-phosphate pathway in triacylglycerol synthesis in plants:Function,biotechnological application and evolution[J]. Progress in Lipid Research,73:46-64.
Moose S P,Dudley J W,Rocheford T R. 2004. Maize selection passes the century mark:A unique resource for 21st century genomics[J]. Trends in Plant Science,9(7):358-364.
Patel M,Jung S,Moore K,Powell G,Ainsworth C,Abbott A. 2004. High-oleate peanut mutants result from a MITE insertion into the FAD2 gene[J]. Theoretical and Applied Genetics,108(8):1492-1502.
Qi F,Zhao L,Zhou A,Zhang B,Li A,Wang Z,Han J. 2015. The advantages of using traditional Chinese medicine as an adjunctive therapy in the whole course of cancer treatment instead of only terminal stage of cancer[J]. BioScien-ce Trends,9(1):16-34.
Shi J,Lang C,Wang F,Wu X,Liu R,Zheng T,Zhang D,Chen J,Wu G. 2017. Depressed expression of FAE1 and FAD2 genes modifies fatty acid profiles and storage compounds accumulation in Brassica napus seeds[J]. Plant Science,263:177-182.
Taylor D C,Zhang Y,Kumar A,Francis T,Giblin E M,Barton D,Ferrie J R,Laroche A,Shah S,Zhu W,Snyder C L,Hall L M,Rakow G F W,Harwood J L,Weselake R J. 2009. Molecular modification of triacylglycerol accumulation by over-expression of DGAT1 to produce canola with increased seed oil content under field conditions[J]. Botany,87(6):533-543.
Turchetto-Zolet A C,Christoff A P,Kulcheski F R,Loss-Morais G,Margis R,Margis-Pinheiro M. 2016. Diversity and evolution of plant diacylglycerol acyltransferase (DGATs) unveiled by phylogenetic,gene structure and expression analyses[J]. Genetics and Molecular Biology,39(4):524-538.
Wang Q,Dooner H K. 2012. Dynamic evolution of bz ortho-logous regions in the Andropogoneae and other grasses[J]. The Plant Journal,72(2):212-221.
Yang J,Xing G,Niu L,He H,Guo D,Du Q,Qian X,Yao Y,Li H,Zhong X,Yang X. 2018. Improved oil quality in transgenic soybean seeds by RNAi-mediated knockdown of GmFAD2-1B[J]. Transgenic Research,27(2):155-166.
Zheng L,Shockey J,Guo F,Shi L,Li X,Shan L,Wan S,Peng Z. 2017. Discovery of a new mechanism for regulation of plant triacylglycerol metabolism:The peanut dia-cylglycerol acyltransferase-1 gene family transcriptome is highly enriched in alternative splicing variants[J]. Journal of Plant Physiology,219:62-70.
Zheng Y,Jin Y,Yuan Y,Feng D,Chen L,Li D,Zhou P. 2019. Identification and function analysis of a type 2 diacylglycerol acyltransferase(DGAT2) from the endosperm of coconut(Cocos nucifera L.)[J]. Gene,702:75-82.
(責任编辑 兰宗宝)
