新型植物生长调节剂独脚金内酯生物学功能及应用
2020-05-11郑晨
郑晨
摘要:独脚金内酯(Strigolactones,SLs)是独脚金醇类化合物的总称,是近年来发现的一类能够调控植物内源性发育过程的信号分子,被称为新型植物生长调节剂。近几年来,对独脚金内酯的研究已经越来越多,新的独脚金内酯类化合物及其功能研究报道较多。综述了最近几年来独脚金内酯生物学功能及在农作物种植方面的应用,并对独脚金内酯的研究方向进行了展望。
关键词:独脚金内酯;植物生长调节剂;生物学功能
中图分类号:Q946.885 文献标识码:A
文章编号:0439-8114(2020)02-0009-05
DOI:10.14088/j.cnki.issn0439-8114.2020.02.002 开放科学(资源服务)标识码(OSID):
Biological function and application of new plant growth regulator strigolactones
ZHENG Chen
(Forestry College of Fujian Agriculture and Forestry University,Fuzhou 350000,China)
Abstract: Strigolactones (SLs) is a general term of the alcohol compounds of striga. It is a kind of signal molecule which can regulate the endogenic development of plants in recent years. It is called a new plant hormone. Recently, much researches have been done on SLs, there are many reports on the study of striga compounds and their functions. The research and crop cultivation application of the biological functions of SLs were reviewed,and the future research of SLs was also forecasted.
Key words: strigolactones; plant hormone; biological function
独脚金内酯属于萜类小分子化合物[1],是一些天然的独脚金醇类化合物及人工合成类似物的总称,广泛存在于高等植物中,主要在根中合成[2]。最先发现的独脚金内酯类化合物是独脚金醇(Strigol),由Cook等[3,4]从独脚金的非寄主植物棉花的根际分泌物中分离得到;1998年Yokota等[5]从小列当四叶草中提取出列当醇(Orobanchol),并确定列当醇结构与独脚金醇互为异构体。独脚金内酯可以诱导独脚金属(Striga spp.)、列当属(Orobanche spp.)种子的萌发。2008年,Gomez-Roldan等[6]、Umehara等[7]发现独脚金内脂调节植物分枝功能不同于传统的植物茎分枝由生长素和细胞分裂素两种生长调节剂调控,因此,将其确定为调控植物分枝的第三种生长调节剂[6,7]。近年来,关于独脚金内脂化合物的分离和生物学功能的研究成为了植物学界研究的热点。
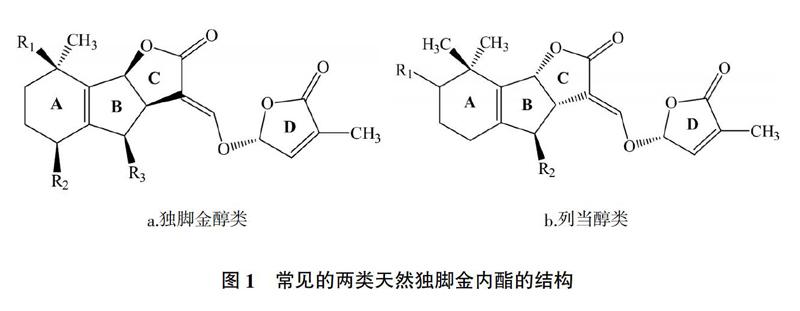
截至目前,从不同的植物中提取到大约36种天然独脚金内酯化合物(SLs),其具有相似的结构,根据立体结构不同一般分为:独脚金醇类,BCD环和(+)-独脚金醇的立体结构一致(图1a);列当醇类,BCD环则与(-)-列当醇类似(图1b)。
从图1可以看出,两类天然独脚金内脂的ABC环均是通过1个烯醇醚键与环丁烯羟酸内酯(D环)相连,但C环的构型不同。研究表明,CD环及其之间的烯醚键对独脚金内脂的生物活性至关重要[8-10],AB环取代基对独脚金内酯的生物活性有一定的影响,而D环上增加1个甲基可以导致独脚金内酯诱发寄宿种子萌发的能力大幅降低[11]。关于独脚金内酯的分离、生物合成机理及其调节机制的研究进展,国内外已有相关文献报道[12-15],本文主要对独脚金内酯的生物学功能及其应用研究进行比较全面的概述,旨在更好地利用独脚金内酯这一新型生长调节剂。
1 独脚金内酯的生物学功能
作为一种新型的植物生长调节剂,随着研究的不断深入,独脚金内酯化合物的很多生物功能被发现,独脚金内酯的主要生物学功能表现在诱导种子萌发、促进丛枝菌根真菌菌丝分子以及调节植物的生长等方面。
1.1 诱导根寄生植物种子萌发
国内外学者对独脚金内酯化合物诱导植物萌发的生物学机理进行了广泛研究。研究发现,独脚金内脂化合物的C环和D环之间的烯醚键是诱导根寄生种子萌发的关键部位,独脚金内酯通过其受体蛋白质htl-3、AtHTL、ShHTLs传递信号唤醒根寄生种子,同时,根寄生种子的对独脚金内脂的敏感度取决于受体的敏感度[16-20]。Nomura等[21]研究发现,结构不同的SLs对同一种寄生植物种子萌发的诱导活性不一样,尽管现在发现的天然独脚金内酯均可诱导根寄生植物种子的萌发,但诱导效果不同,萌发率最低为10%,最高可达50%。同时,同一种SLs对不同寄生植物的效果也不同。Kisugi等[22]研究发现,0.1 nmol/L的獨脚金醇可诱导独脚金种子萌发,但对小列当种子萌发却不起作用。
1.2 促进丛枝菌根真菌菌丝分枝
丛枝菌根真菌(Arbuscular Mycorrhiza fungi,简称AM fungi)是陆地生态系统中的关键微生物,是土壤中与植物关系最密切的微生物之一,参与碳、氮、磷等多种元素的生物地球化学循环过程,能与90%以上的陆地高等植物的营养根系形成互惠共生体,是自然界中一种普遍的植物互惠共生现象。丛枝菌根真菌既具有一般植物根系的特征,又具有专属真菌的特性。对丛枝菌根真菌的研究表明,独脚金内酯可以促进菌丝分枝。研究者从百脉根中成功分离出可诱发丛枝菌根真菌分枝的SLs类似物:5-脱氧独脚金醇,并证明其可以促进枝菌根真菌菌丝分枝[23]。同时研究还发现,独脚金内酯化合物的D环构型或A环或B环是否羟基化对促进丛枝菌根真菌分枝活性有很大的影响[24,25]。因此,在丛枝菌根真菌中发现独脚金内酯的受体是该生物学功能研究取得突破的关键。
1.3 调节植物分枝生长
作为一种新型的植物生长调节剂,独脚金内酯能够抑制植物的分枝和侧芽的生长,参与调控植物的分枝数量[26],这是独脚金内酯最重要的生物学功能。研究表明,天然的5-脱氧独脚金内酯可以高效抑制依赖水解蛋白D14的拟南芥分枝,而且,独脚金醇构型的异构体比列当醇构型的异构体活性稍高[10]。在水稻的分蘖试验中发现,独脚金内酯的D环的R-构型的异构体显示出较高的抑制分蘖活性,同样,独脚金醇构型的异构体比列当醇构型的异构体活性稍高[27,28],独脚金内酯调控水稻分蘖机制也得到了很好的研究和分析[29]。在豌豆分枝试验中发现,独脚金内酯化合物的D环的R或S构型对抑制分枝表现出相似的生物活性[30]。
1.4 调控植物根系生长和根瘤菌的形成
独脚金内酯通过与植物体内的其他生长素、细胞分裂素协同,不仅可以控制植物分枝,还可以调控植物根系的生长。通过对拟南芥、番茄、豌豆等植物的研究发现,独脚金内酯可促进侧根的形成,根毛的伸长以及抑制不定根的生長,调控根系构型[31-33]。根瘤菌具有很强的固氮能力,与豆科植物及另外的9个科植物共生[34],在宿主根部形成根瘤并固定空气中的氮气,供给植物氮素营养,参与大气氮的循环,提高土壤的肥力。研究发现,独脚金内酯可促进苜蓿根瘤、豌豆根瘤的形成[35,36]。由于根瘤菌在生活过程中分泌一些有机氮到土壤中,加之,根瘤在植物的生长末期会自行脱落,从而大大提高了土壤的肥力。
2 独脚金内酯的应用研究
对独脚金内酯的发现及其生物学功能的研究,特别是对其生物学功能机理的研究促进了其在农业方面的应用研究。但是,由于对独脚金内酯的研究还不够充分,限制了其应用。目前,独脚金内酯的应用研究仅表现在以下几个方面,而且有些应用仅仅处于实验室阶段。
2.1 用于控制植物分枝,调控植物株型
独脚金内酯的生物学功能之一是抑制植物的分枝和侧芽的生长,因此,可以通过控制植物体内独脚金内酯的合成和代谢调控植物的分枝发育。水稻是世界主要粮食作物,水稻的分蘖是其生长发育过程中一种特殊的分枝现象,与水稻产量密切相关。研究表明,独脚金内酯的合成与信号传导可以控制水稻、小麦等的分蘖及植株的高度[7,37]。对于一些园艺花卉和经济类果树,可通过控制独脚金内酯的合成来调节植物分枝,达到多开花多结果等调控效果。
2.2 作为除草剂控制寄生杂草生长
独脚金和列当均是一年生或二年生寄生草本植物,独脚金主要寄生在玉米、水稻、高粱、小麦、甘蔗等禾本科植物及大豆、番茄等植物的根上,列当主要寄生在菊科蒿属(Artemisia)植物根上,与寄主争夺土壤营养,甚至导致寄主死亡,导致农作物减产[38]。独脚金内酯可以诱导列当属和独脚金属等根寄生植物种子的萌发,这些种子萌发后如果接触不到寄主的根将会死亡。因此,可以利用独脚金内酯作为除草剂,在农作物播种前用含有独脚金内酯的除草剂喷洒土壤,诱发杂草种子“自杀式”萌发,控制杂草生长。2018年,Uraguchi等[39]研发了一种选择性独脚金内酯激动剂Sphynolactone-7(SPL7),SPL7与独脚金内酯激活种子的受体ShHTL7具有很好的亲和力,可以在飞摩尔浓度激活受体,刺激独脚金种子“自杀式”萌发,从而有效减少独脚金的寄生,但SPL7不影响寄主体内独脚金内酯相关的生理过程,如不影响拟南芥分枝或根毛伸长,也几乎不影响土壤AM真菌菌丝分枝。这项研究为利用独脚金内酯进行杂草的防治提供了新的思路和策略。
2.3 作为独脚金、列当发芽促进剂,使之增产
独脚金和列当既是农作物寄生杂草,也是中草药。独脚金,又名疳积草,具有清热、消积作用。列当,又名“不老草”,具有补肾壮阳、强筋骨、提高免疫力和润肠等一系列功效,是名贵的中药材,为国家三级保护濒危物种。由于市场需求旺盛及乱挖滥采,导致野生列当受到严重破坏,但是,寄生植物的人工栽培及嫁接难度很大,如极其名贵肉苁蓉种子的胚发育不完全,为球形原胚,没有胚根、胚轴、子叶及胚芽的分化,仅为几十个细胞组成的一团胚性细胞[40],自然萌发率极低。利用独脚金内酯可以有效促进独脚金和列当种子萌发的生物学功能,可以考虑诱导肉苁蓉种子的萌发,提高种子自然萌发率。2005年,González-Verdejo等[41]利用独脚金内酯类似物GR24处理分支列当的种子,种子萌发率达到70%。因此,可以利用独脚金内酯作为列当发芽促进剂,人工培育珍贵列当,为提高成活率和规模化种植找到了一个比较可靠的方法。研究发现,大多数天然的独脚金内酯对寄生植物种子萌发具有活性,但对映体通常活性比较低[42],因此,在独脚金内酯的应用方面还需谨慎对待。目前,中国宁夏采用人工控制寄生培养的方法得到名贵肉苁蓉,效果不错[43]。
2.4 利用丛枝菌根真菌菌丝分枝和根瘤菌的形成,增强贫瘠土壤肥力
丛枝菌根真菌能和90%以上的有花植物形成互惠互利的共生体,菌根真菌分泌的球囊霉素相关蛋白不仅能够改善土壤的团聚性,同时可以提高土壤有机碳含量,改善土壤微环境,因此,丛枝菌根真菌又称“生物肥料”。根瘤菌具有很强的固氮能力,与其共生的植物可以通过根瘤菌从大气中获得氮素养分。据估测,每公顷苜蓿年均可积累300 kg氮肥,相当于1 500 kg硫铵,并可增加土壤中的腐殖质,大大提高土壤的肥力。中国幅员辽阔,但可耕地面积却逐渐萎缩,贫瘠土壤面积增加,恢复贫瘠土壤的可耕作能力势在必行。利用独脚金内酯可以促进丛枝菌根真菌的分枝和根瘤菌形成的功能,对于贫瘠土壤上的植物接种丛枝菌根真菌,并施以适量的独脚金内酯刺激物,可以促进丛枝菌根真菌的分枝,同时可适当种植能形成根瘤菌的苜蓿等植物,可以有效恢复贫瘠土壤的肥力。研究表明,在中国西南石漠化的贫瘠土壤地区接种丛枝菌根真菌苗木,如香椿、任豆、喜树、桑树、茶条木和降香黄檀等成活率和生长速度明显提高[44-46]。丛枝菌根真菌可以促进互惠共生的植物的生长,同时抑制互惠植物根系合成独脚金内酯,从而解除植物自身独脚金内酯对地上部分蘗的抑制作用,促进植物增加地上部的生物量[47]。
3 小结
独脚金内酯从发现至今已经有五十多年,对其生物学功能及其相关作用机理的研究不断深入,研究表明作为一种新型的植物生长调节剂在植物生长过程中有着不可替代的作用,但仍然有许多难题没有研究清楚,如SLs受体识别蛋白的认知。SLs信号转导途径中有些假定,如SLs对细胞分裂素的生物合成、代谢或者运输的影响机制等[48],都有待于进一步研究证明,这些关键步骤不能破解,加上天然的独脚金内酯化合物的取得十分困难,这都将阻碍独脚金内酯的应用。关于独脚金内酯对植物生长的影响机制的研究是目前植物学、分子生物学及交叉学科研究的热点,独脚金内酯研究的每一步突破都对其应用起到推动作用,未来对于独脚金内酯的研究主要在独脚金内酯的生物学功能的作用机制、独脚金内脂类似物的合成及其功能研究、独脚金内酯化合物的应用推广等方面。
参考文献:
[1] ZWANENBURG B,BLANCO-ANIA D,PRANDI C. Strigolactones:New plant hormones in the spotlight[J].J Exp Bot,2018,69(9):2205-2218.
[2] 陈虞超,巩 檑,张 丽,等.新型植物激素独脚金内酯的研究进展[J].中国农学通报,2015,31(24):157-162.
[3] COOK C E,WHICHARD L P,WALL M E,et al. Germination stimulants. II. Structure of strigol,a potent seed germination stimulant for witchweed (Striga lutea Lour.)[J].J Am Chem Soc,1972,94(17):6198-6199.
[4] COOK C E,WHICHARD L P,TURNER B,et al. Germination of witchweed (Striga lutea Lour.):Isolation and properties of a potent stimulant[J].Science,1966,154(3753):1189-1190.
[5] YOKOTA T,SAKAI H,OHUNO K,et al. Alectrol and orobanchol,germination stimulants for Orobanche minor,form its host red clover[J].Phytochemistry,1998,49(7):1967-1973.
[6] GOMEZ-ROLDAN V,FERMAS S,BREWER P B,et al. Strigolactone inhibition of shoot branching[J].Nature,2008,455 (7210):189-194.
[7] UMEHARA M,HANADA A,YOSHIDA S,et al. Inhibition of shoot branching by new terpenoid plant hormones[J].Nature,2008,455(7210):195-200.
[8] ZWANENBURG B,POSPISIL T. Structure and activity of strigolactones:New plant hormones with a rich future[J].Mol Plant,2013, 6(1):38-62.
[9] ZWANENBURG B,ZELJKOVIE S C,POSPISIL T. Synthesis of strigolactones,a strategic account[J].Pest Manag Sci,2015,72(1):15-29.
[10] SCAFFIDI A,WATERS M T,SUN Y K,et al. Strigolactone hormones and their stereoisomers signal through two related receptor proteins to induce different physiological responses in Arabidopsis[J].Plant physiol,2014,165(3):1221-1232.
[11] ZWANENBURG B,NAYAK S K,CHARNIKHOVA T V,et al. New strigolactone mimics:Structure-activity relationship and mode of action as germinating stimulants for parasitic weeds[J].Bioorg Med Chem Lett,2013,23(18):5182-5186.
[12] NAKAMURA H,ASAMI T. Target sites for chemical regulation of strigolactone signaling[J].Front Plant Sci,2014,5:623.
[13] 刘 虎,姬朝光,刘 坤,等.DWARF14响应独角金内酯信号的分子机制[J].湖北农业科学,2018,57(20):9-12,22.
[14] EVA-SOPHIE W,VADIR L-S,THOMAS G. Strigolactone versus gibberellin signaling:Reemerging concepts?[J].Planta,2016,243(6):1339-1350.
[15] FLEMATTI G R,SCAFFIDI A,WATERS M T,et al. Stereospecificity in strigolactone biosynthesis and perception[J].Planta,2016,243(6):1361-1373.
[16] PRANDI C,ROSSO H,LACE B,et al. Strigolactone analogs as molecular probes in chasing the (SLs) receptor/s:Design and synthesis of fluorescent labeled molecules[J].Mol Plant,2013, 6(1):113-127.
[17] TSUCHIYA Y,YOSHIMURA M,SATO Y,et al. Probing strigolactone receptors in Striga hermonthica with fluorescence[J].Science,2015,349(6250):864-868.
[18] RASMUSSEN A,HEUGEBAERT T,MATTHYS C,et al. A fluorescent alternative to the synthetic strigolactone GR24[J].Mol Plant,2013,6(1):100-112.
[19] TOH S,HOLBROOK-SMITH D,STOGIOS P J,et al. Structure-function analysis identifies highly sensitive strigolactone receptors in Striga[J].Science,2015,350(6257):203-207.
[20] CONN C E,BYTHELL-DOUGLAS R,NEUMANN D,et al. Convergent evolution of strigolactone perception enabled host detection in parasitic plants[J].Science,2015,349(6247):540-543.
[21] NORMURA S,NAKASHIMA H,MIZUTANI M,et al. Structural requirements of strigolactones for germination induction and inhibition of Striga gesnerioides seeds[J].Plant cell reports,2013,32(6):829-838.
[22] KISUGI T,XIE X,KIM H J,et al. Strigone,isolation and identification as a natural strigolactone from Houttuynia cordata[J].Phytochemistry,2013,87(3):60-64.
[23] AKIYAMA K,MATSUZAKI K,HAYASHI H. Plant sesquiterpenes induce hyphal branching in arbuscular myeorrhizal fungi[J].Nature,2005,435(7043):824-827.
[24] ARTUSO E,GHIBAUDI E,LACE B,et al. Stereochemical assignment of strigolactone analogues confirms their selective biological activity[J].J Nat Prod,2015,78(11):2624-2633.
[25] AKIYAMA K,OGASAWARA S,ITO S,et al. Structural requirements of strigolactones for hyphal branching in AM fungi[J].Plant cell physiology,2010,51(7):1104-1117.
[26] 陳彩艳,邹军煌,张淑英,等.独角金内酯能抑制植物的分枝并介导植物与枞枝真菌及寄生植物间的相互作用[J].中国科学C辑(生命科学),2009,39(6):525-533.
[27] UMEHARA M,CAO M,AKIYAMA K,et al. Structural requirements of strigolactones for shoot branching inhibition in rice and Arabidopsis[J].Plant cell physiology,2015,56(6):1059-1072.
[28] XU J,DING C,DING Y,et al. A proteomic approach to analyze differential regulation of proteins during bud outgrowth under apical dominance based on the auxin transport canalization model in rice(Oryza sativa L.)[J].J Plant Growth Regul,2015,34:122-136.
[29] 黎舒佳,高 谨,李家洋,等.独脚金内酯调控水稻分蘖的研究进展[J].植物学报,2015,50(5):539-548.
[30] BOYER F D,DE SAINT GERMAIN A,PILLOT J-P,et al. Structure-activity relationship studies of strigolactonerelated molecules for branching inhibition in garden pea:Molecule design for shoot branching[J].Plant physiology,2012,159:1524-1544.
[31] KAPULNIK Y,DELAUX P M,RESNICK N,et al. Strigolactones affect lateral root formation and root- hair elongation in Arabidopsis[J].Planta,2011,233(1):209-216.
[32] RASMUSSEN A,MASON M G,CUYPER C D,et al. Strigolactones suppress adventitious rooting in Arabidopsis and pea[J].Plant physiology,2012,158(4):1976-1987.
[33] KOHLEN W,CHARNIKHOVA T,LAMMERS M,et al. The tomato CAROTENOID CLEAVAGE DIOXYGENASE8(SlCCD8) regulates rhizosphere signaling,plant architecture and affects reproductive development through strigolactone biosynthesis[J].The new phytologist,2012,196(2):535-547.
[34] GRIESMANN M,CHANG Y,LIU X,et al. Phylogenomics reveals multiple losses of nitrogen-fixing root nodule symbiosis[J].Science,2018,361(6398):1743.
[35] FOO E,DAVIES N W. Strigolactones promote nodulation in pea[J].Planta,2011,234(5):1073-1081.
[36] SOTO M J,FERNANDEZ-APARICIE M,CASTELLANOS-MO RALES V,et al. First indications for the involvement of strigolactones on nodule formation in alfalfa(Medicago sativa)[J].Soil biology and biochemistry,2010,42(2):383-385.
[37] WANG Y H,LI J Y. Branching in rice[J].Curr Opin Plant Biol,2011,14(1):94-99.
[38] YOSHIDA S,MARUYAMA S,NOZAKI H,et al. Horizontal gene transfer by the parasitic plant Striga hermonthica[J].Science,2010,328(5982):1128.
[39] URAGUCHI D,KUWATA K,HIJIKATA Y,et al. A femtomolar-range suicide germination stimulant for the parasitic plant Striga hermonthica[J].Science,2018,362(6420):1301-1305.
[40] 李天然.寄生被子植物的种子生理及其与寄主的相互关系[J].植物生理学通讯,1996,32(6):450-457.
[41] GONZ?魣LEZ-VERDEJO C I,BARANDIARAN X,MORENO M T,et al. An improved axenic system for studying pre-infection development of the parasitic plant Orobanche ramose[J].Annals of botany,2005,96:1121-1127.
[42] CAVAR S,ZWANENBURG B,TARKOWSKI P. Strigolactones:Occurrence,structure,and biological activity in the rhizosphere[J].Phytochem Rev,2015,14:691-711.
[43] 陈虞超,张 丽,巩 檑,等.管花肉苁蓉人工控制寄生技术研究[J].时珍国医国药,2017,29(10):2507-2510.
[44] 曹 敏,余 米,卢 敏,等.菌根桑苗在石漠化和消落带地区逆境胁迫下的生态适应性[J].蚕业科学,2017,43(2):189-195.
[45] 甘春雁,姚瑞玲,项东云,等.丛枝菌根化香椿幼苗对干旱胁迫的生长响应[J].广西林业科学,2013,42(1):20-24.
[46] 张中峰,张金池,周龙武,等.丛枝菌根真菌对石漠化地区造林苗木生长的影响[J].生态学杂志,2018,37(10):2927-2934.
[47] 徐 鵬,程亭亭,张 超,等.丛枝菌根真菌对柳枝稷苗期生长作用机制的研究[J].草地学报,2017,26(5):1097-1102.
[48] 高 雨,李 颖,谢寅峰,等.独脚金内酯调控植物侧枝发育的分子机制及其与生长素交互作用的研究进展[J].植物资源与环境学报,2013,22(4):98-104.
收稿日期:2019-04-20
基金项目:河南省教育厅科学技术研究重点项目(15A150088)
作者简介:郑 晨(1996-),女,河南洛阳人,本科,研究方向为林业科学,(电话)15093178969(电子信箱)819363425@qq.com。
