三维细胞模型在肿瘤研究中的应用
2020-05-11刘佳敏贾晓青
刘佳敏,贾晓青,狄 斌**
(1中国药科大学药学院,南京 211198;2上海药明生物技术有限公司,上海 200131)
肿瘤是人类死亡的主要原因之一,肿瘤治疗一直是科学领域研究的热点。目前临床前细胞模型仍以传统的二维(two-dimensional,2D)细胞模型为主导,但二维细胞模型的细胞形态与信号传递呈现生理学不相关性,不能反映体内细胞真实生存状态,因而基于该模型所产生的体外结果临床预测性有限[1-2]。约90%通过临床前细胞实验的药物,因在临床试验阶段未达到治疗效果、产生严重不良反应或迅速耐药而以失败告终[3]。1977年,研究者在三维胶原凝胶上培养细胞,首次建立了三维(three-dimensional,3D)细胞模型[4]。
三维细胞模型通过模拟体内环境,缩小了体外细胞模型与体内组织之间的差距。越来越多证据表明,三维细胞模型加速了肿瘤生物学研究。本文综述了近几年三维细胞模型在肿瘤微环境、癌症转移以及抗肿瘤药物研发中的应用与进展,并对目前三维细胞模型存在的不足和未来的发展进行了展望。
1 三维细胞模型
1.1 三维细胞模型的概念
三维细胞模型在二维细胞模型的基础上增加了上下的维度。增加的维度使细胞能够完全浸润在培养基中,接受来自各个方向的营养。如图1所示,三维细胞的生长方向不局限于平铺延展,而是朝向空间发展。因此,三维细胞模型能够形成具有立体形态的单个细胞或者细胞聚集体。这种立体结构,促进了细胞与周围细胞在空间上的交流。另外,三维细胞模型通过人为增加细胞外基质(extracellular matrix,ECM)的方式,与二维细胞模型相比,有更多的细胞与ECM之间的信号传递[4-6]。
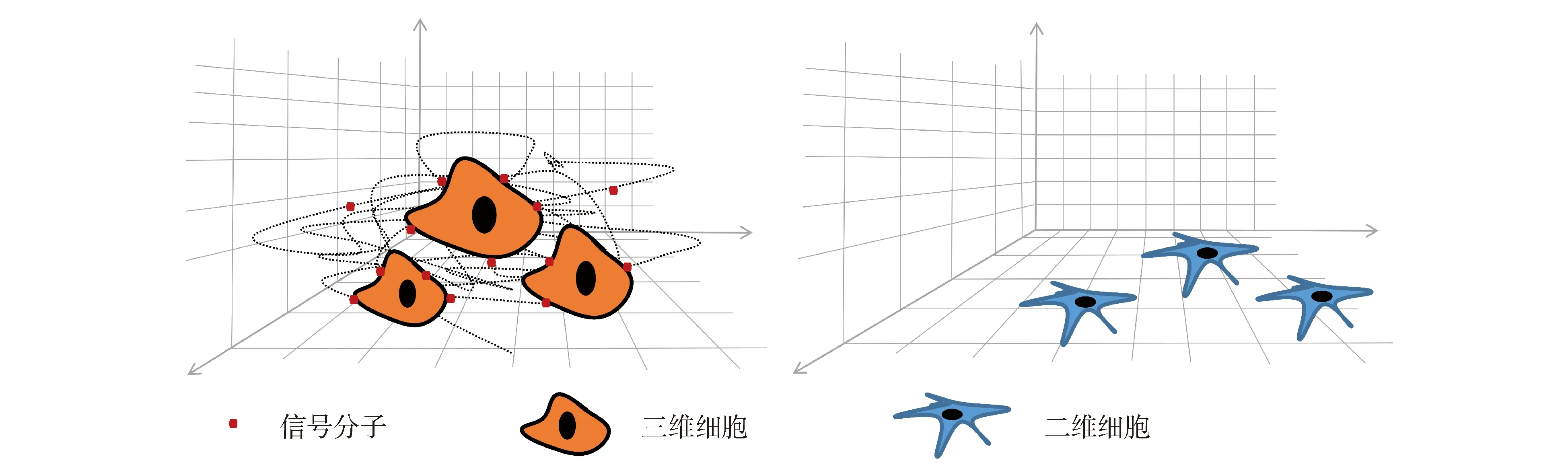
图1 三维细胞与二维细胞示意图
物理构象改变及细胞与细胞之间、细胞与ECM之间信号传递增加使三维细胞在多方面与二维细胞存在差异(见表1)。首先,二维细胞形态扁平,这种形态影响细胞核形状,进而影响基因表达和蛋白质合成[7]。其次,二维细胞只有横向的细胞与细胞相互作用,细胞增殖速率快而分化能力降低,而三维细胞的增殖速率明显低于二维细胞[8]。再者,由于二维细胞的接触抑制作用,细胞长到一定密度后即停止生长,三维细胞则可以进行长时间培养[9]。已有实验研究将三维细胞模型运用于体外难以长期培养的细胞如肾单位祖细胞的培养[10]。
表1 二维细胞模型与三维细胞模型的比较

培养结果二维细胞模型三维细胞模型细胞形态扁平,不符合体内细胞生长状态立体,符合体内细胞生长状态细胞增殖倍增时间短倍增时间长培养时间由于接触抑制,长到一定密度停止生长可进行长时间培养细胞交流有限的细胞-细胞交流,生理学相关性弱合适的细胞-细胞交流,生理学相关性强
1.2 建立三维细胞模型的方法
建立三维细胞模型的方法可分为无支架培养法和基于支架培养法。无支架培养法利用特殊材料或外力迫使细胞自身结团生长,建模起始阶段主要依赖于细胞间的附着;基于支架培养法为细胞提供特定的附着载体,建模起始阶段主要依赖于细胞与载体间的附着。
1.2.1 无支架培养法 无支架培养法也被称为液体悬浮培养法,即为细胞提供一个能维持悬浮状态的环境,并促使细胞生长为多细胞球体。如图2所示,无支架培养法包括超低吸附法、悬滴法、旋转培养法、微流控装置培养法等。超低吸附法采用惰性疏水材料涂布细胞培养容器表面,再通过离心让细胞结团生长。悬滴法利用平皿表面垂悬液滴,依靠重力和表面张力,细胞在液滴顶点处聚集生长。旋转培养法对装有细胞悬液的容器进行连续旋转,通过细胞的随机碰撞来组装成细胞聚集体。微流控装置多采用软光制造的微孔阵列,细胞以足够慢速在阵列通道中流动,并被阵列腔室捕获。阵列腔室无附着面,细胞只能在腔室中自身聚集生长。无支架培养方式体系简单,易于扩大规模,实现高通量,但产生出来的细胞球体往往存在尺寸不均一的现象[11]。
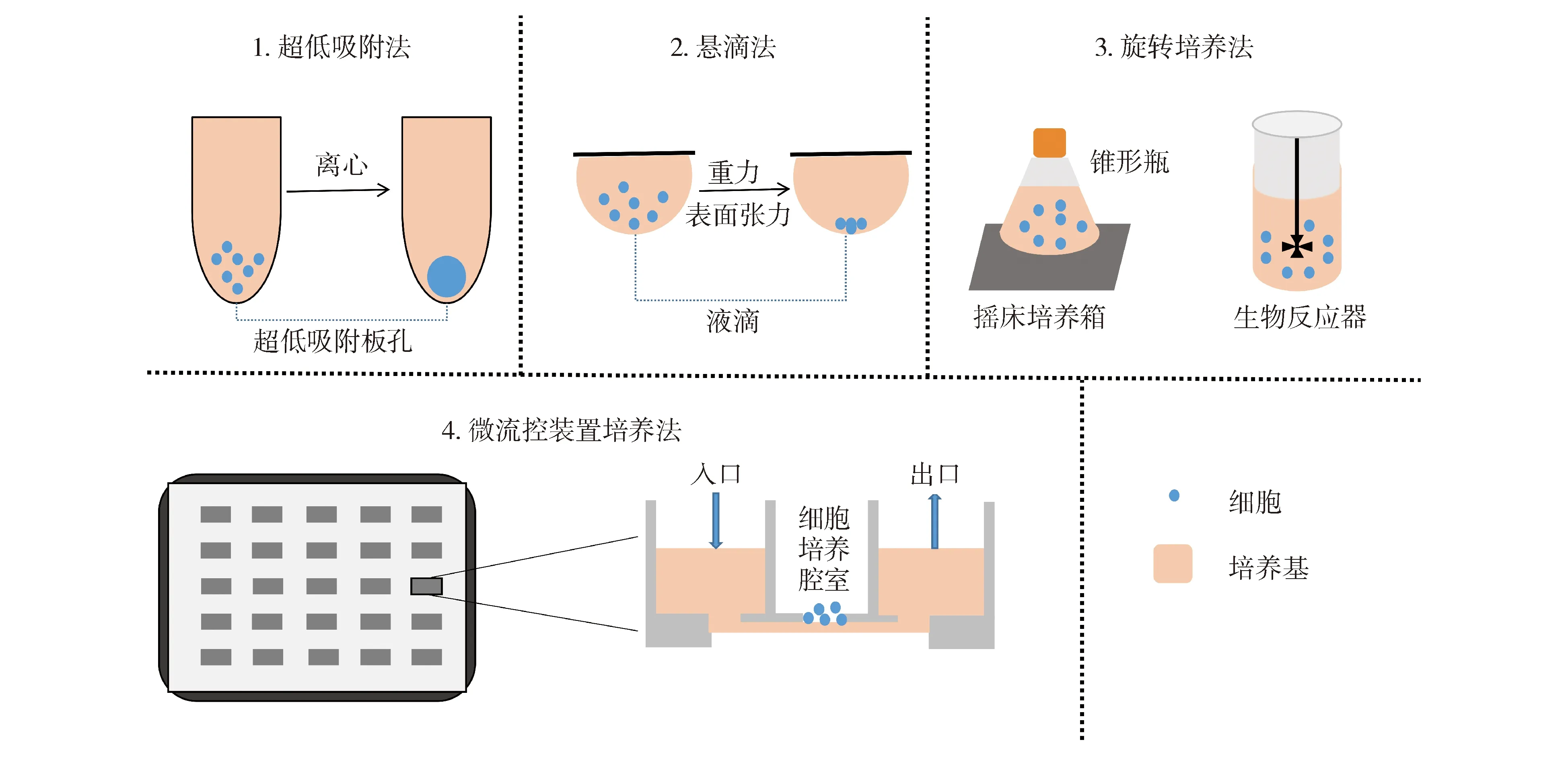
图2无支架的三维细胞模型建立方法
1.2.2 基于支架培养法 基于支架培养法则为细胞提供一个利于细胞黏附、增殖和迁移的生物相容性载体,并促进细胞与载体形成复合物。支架材料主要包括天然支架和化学合成支架,不同的支架性能有差别。天然支架利用天然衍生的基质材料,包括哺乳动物来源的胶原蛋白、纤黏蛋白、基质胶,也有非哺乳动物来源的壳聚糖、丝素蛋白。化学合成支架一般采用具有生物相容性并可生物降解的聚合材料,常用的材料有聚己内酯(PCL)、单甲氧基聚乙二醇(mPEG)、聚乳酸(PLA)等。相比化学合成支架,天然支架一般能为细胞提供更好的支持[12]。而化学合成支架又有天然支架不具备的易获得、低成本以及可修饰以满足用于不同需求的三维细胞培养体系的优势[13]。
1.3 用于肿瘤研究的三维细胞模型
用于肿瘤研究的三维细胞模型分为4种,分别是器官型多细胞球体模型、肿瘤衍生的类器官模型、肿瘤球模型和多细胞球体模型。表2 对这4种三维细胞模型的优缺点进行了比较。前3种模型均利用切割、解离或筛选的手段前处理来自患者的肿瘤组织,再利用三维细胞模型的建模方法对这些处理后的材料进行建模。器官型多细胞球体模型和肿瘤衍生的类器官模型保留了母体肿瘤组织学特征和遗传特性。这类模型是衔接细胞培养和体内实体组织的桥梁,虽然成本高,但有望为实现个体化用药、促进精准医疗发展提供潜在有利的工具[14]。肿瘤球模型利用无血清培养基培养细胞,该模型培养的细胞具有干细胞特征。肿瘤干细胞在癌症复发和侵袭中可能扮演重要角色[15],所以肿瘤球模型可用于干细胞样细胞的富集和研究。多细胞球体模型通过三维细胞模型的建模方法培养细胞系,更像是二维细胞模型的延伸,与原发癌的组织学特性相似度低,但该法能够模拟体内肿瘤微环境中的物理、化学梯度,可用于肿瘤发展进程的分子机制研究。并且,该模型所需要的材料易得,操作相对简便,适用于高通量筛选,为药物开发早期提供一个新型可靠的方法[16-17]。
表2 用于肿瘤研究的三维细胞模型优缺点

细胞模型优 点缺 点器官型多细胞球体模型保留了母体肿瘤组织学特征和遗传特性成本高,无法进行高通量筛选肿瘤衍生的类器官模型可用于研究肿瘤的发展进程成本及操作要求高肿瘤球模型无血清培养,培养的细胞具有干细胞特征与母体肿瘤的组织学特性相似度低多细胞球体模型模拟肿瘤微环境的物理、化学梯度,材料易得,适于高通量筛选与母体肿瘤的组织学特性相似度低
2 三维细胞模型在肿瘤研究中的应用
2.1 三维细胞模型在肿瘤微环境研究中的应用
虽然肿瘤药物的研发不断取得突破,如抗体药物的成功研发提高了药物靶向性和临床应答率,但依旧没攻克癌症。一个重要原因在于,过去一直把研究焦点聚集在肿瘤细胞上。然而,肿瘤不仅由单一的肿瘤细胞组成,考虑肿瘤所处的肿瘤微环境具有重要意义。肿瘤微环境包含了ECM和除肿瘤细胞外的其他类型细胞如成纤维细胞、免疫细胞、内皮细胞和肿瘤干细胞。肿瘤细胞与其他类型的细胞相互作用,共同调控肿瘤的发生和发展进程[18]。二维细胞模型受限于单层形态,无法重现出复杂的肿瘤微环境。越来越多证据表明,三维细胞模型通过控制细胞球体尺寸,能够模拟肿瘤微环境中理化梯度。细胞球体对各类分子的扩散限制为150~200 μm。当球体直径大于400 μm时,细胞球体可形成外圈增殖细胞层,中间静止细胞层和内部坏死中心[19]。另外,因为肿瘤细胞与其他类型细胞的共培养能够产生肿瘤细胞与其他类型细胞及ECM之间的信号传递,所以建立三维细胞共培养模型是研究肿瘤微环境的有效手段[20]。
天然支架提供生物来源的ECM以及肿瘤微环境中大量的细胞因子、趋化因子,促进细胞间相互作用和信号传递,是建立肿瘤微环境研究三维模型的常用材料[21]。采用共培养的方式将肿瘤细胞与成纤维细胞、内皮细胞或肿瘤微环境中其他类型细胞在同一体系中培养可以模拟不同类型细胞间的信号传递。共培养的细胞种类根据研究目的的不同有所差别。例如,研究肿瘤微环境血管生成现象可将肿瘤细胞和内皮细胞共培养;研究肿瘤免疫可将肿瘤细胞和免疫细胞共培养。另外,使用三维细胞模型模拟肿瘤微环境时,需要根据肿瘤特点选用特定的培养方式。譬如,胰腺癌的特点是丰富的纤维化并有大量的异常脉管,研究可用胰腺癌细胞系、成纤维细胞系和内皮细胞共培养成异性多细胞肿瘤球体的方式对胰腺癌建模[22]。
三维细胞模型通过重现肿瘤微环境,可能为发现药物新靶点和提出癌症治疗新策略提供平台。肿瘤相关成纤维细胞与癌细胞相互作用,为癌细胞提供生存和转移的生态位,影响肿瘤的发展进程。Burgstaller等[23]将成纤维细胞植入到去细胞化的离体肺组织支架来构建三维细胞模型以研究成纤维细胞的功能,研究发现成纤维细胞以局部灶黏连的方式定植在支架上,且定植生态位的差异影响成纤维细胞的细胞形态、细胞行为、蛋白质表达以及磷酸化水平。由于免疫抑制,肿瘤微环境中T细胞被免疫沉默,但其免疫再激活后可显示良好的预后[24]。肿瘤相关巨噬细胞在促进肿瘤血管生成和纤维基质沉积中起协调作用,并且能够抑制T细胞增殖和NK细胞的细胞杀伤作用[25]。Osswald等[26]利用三维细胞共培养模型模拟免疫细胞对肿瘤的主动浸润,并研究了肿瘤微环境中免疫细胞的激活和免疫调节机制,这可能为解决临床上免疫应答不足问题以及提出免疫治疗新思路提供参考。
2.2 三维细胞模型在癌症转移研究中的应用
约90%的肿瘤患者死于癌症转移[27-28],但目前对于癌症转移的有关机制了解甚少,因此,建立合适的体外细胞模型是帮助探究这一领域的重要手段。癌症转移是一个循序渐进的过程,包括癌细胞迁移、渗入到血管或淋巴管、成为循环细胞存活、停留到转移部位以及定植为二级肿瘤。每个步骤都受基因调控以及肿瘤微环境影响[29]。常规的二维细胞模型无法重现体内肿瘤细胞的特性,并且其细胞-细胞之间、细胞-ECM之间的信号传递大大衰减,信号通路改变,无法为转移机制的研究提供可靠的体外模型[27]。三维细胞模型通过对肿瘤微环境的模拟,是研究癌症转移的较理想的体外模型。
根据研究目的来设计特定的三维细胞模型具有重要意义。ECM的重现是建立转移模型的关键,因此常采用基于支架三维细胞模型。因为天然来源的支架成分不明晰,无法精准控制体系中影响细胞行为的相关参数如孔隙率、基质刚度、降解率等,故合成支架使用频率更高[28]。基质弹性对癌症转移的进展有重要影响,研究需要采用与体内基质刚度相当的材料。另外,体内实体瘤一般具有缺氧中心,但并非所有支架培养都能产生足够尺寸的细胞球体,形成缺氧中心[30]。目前,已有大量针对癌症转移的三维细胞模型的建模研究。Balachander等[30]用多孔聚(ε-己内酯)材料成功建立癌症转移的三维细胞模型,并证明该模型相比于二维细胞模型,在癌症转移的起始和进展中均表现出更强的侵袭力。Janani等[31]采用电纺明胶纳米纤维基质作为支架建立癌症转移三维细胞模型,并证明该模型可用于研究乳腺癌上皮间充质转换事件。理想的转移机制研究模型还应具备能够实时监控原发肿瘤的ECM定位、定量变化的能力。Toh等[32]开发了一种基于微流体的培养芯片三维细胞模型,该模型模拟了乳腺癌的早期转移,并且可对细胞迁移进行实时监测。
癌症转移模型的成功建立为癌症早期转移机制的研究铺路,启发研究者针对机制提出相应的治疗策略。前期研究已经证明,ECM的多种特性影响癌症转移进程,胶原蛋白是ECM的主要成分之一[33]。Velez等[34]借助具有小孔和短纤维的胶原基质培养癌细胞。结果发现,胶原蛋白的拓扑结构通过诱导癌细胞基因表达的改变,导致癌细胞形成血管拟态结构,以此调节癌细胞运动并且可作为预测转移进展的独立因子。基质金属蛋白酶家族(matrix metalloprotein,MMP)在促进ECM的降解、癌细胞侵袭和转移部位的定植发挥关键作用。Leight等[35]用基于PEG材料的水凝胶对处于不同进展阶段的黑色素瘤细胞分别建立三维细胞模型,并以原位荧光传感肽实时监测加入常规药物后黑色素瘤细胞的MMP活性。实验结果表明,不同药物对MMP活性及细胞的运动性影响不同,该发现可能帮助临床决策。
2.3 三维细胞模型在抗癌药物研发中的应用
药物研发是人类对抗癌症的重要手段,具有周期长、消耗高的特点。药物研发过程分为临床前研究阶段和临床研究阶段。因现有的临床前细胞模型主要为二维细胞模型,而其呈现生理学不相关性,只有7%针对癌症治疗的药物能从临床前研究顺利进入临床Ⅰ期试验[36]。并且,约90%在二维细胞模型中被证明有效的药物,到了临床上却发现缺乏药效,造成巨额研发资金的损失。而三维细胞模型模仿细胞的真实生长状态,基因表达更接近体内,被认为更适于药物筛选[37]。
几乎所有的三维细胞模型被运用于药物研发临床前各阶段的研究。在药物筛选阶段,Mosaad等[38]开发了在微孔中共培养前列腺癌细胞和骨髓细胞的高通量细胞模型,用于筛选治疗前列腺癌转移的药物;Rijal等[39]从体内提取全ECM来培养乳腺癌细胞系以及共培养乳腺癌细胞系和基质细胞,为药物筛选提供细胞模型;Yan等[40]用基于支架的微阵列来培养卵巢癌细胞系,实现对56种丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)抑制剂的高通量筛选。在药物评估阶段,Lu等[41]在胶原中共培养卵巢癌细胞、间质细胞和成纤维细胞建立三维细胞模型,并利用该模型评估了几种抗卵巢癌转移的纳米药物效果;Ma等[42]利用微流控装置建立了多形性胶质母细胞瘤细胞三维细胞模型,对肿瘤微环境的ECM、流体特征进行了模拟,并利用该模型评估了一种潜在抗侵袭药物作用。
越来越多研究表明,三维细胞模型相较于二维细胞模型显示出较高的抗癌药物抗性和临床相关性。Liu等[43]发现乳腺癌细胞系和胶质母细胞瘤细胞系的三维细胞模型相对二维细胞模型对顺铂更具抗性,并提出抗性的产生可能与三维细胞模型中肿瘤微环境相关。类似的,Imamura等[44]发现三种乳腺癌细胞系的多细胞球三维细胞模型对紫杉醇的抗性明显高于二维细胞模型,并且多细胞球三维细胞模型对药物的反应与人源性肿瘤组织异种移植模型类似。该研究指出多细胞球三维细胞模型显示的抗性可能是由于球体缺氧,导致细胞休眠、半胱天冬酶-3(caspase-3)下调。临床上,由于肿瘤组织增长快速,体积高度膨胀,而部分细胞偏离血管或者血管生成异常,导致氧的供需不平衡,从而形成肿瘤组织局部缺氧微环境。缺氧条件下,由于细胞增殖速度减慢,细胞对于周期依赖性药物抗性增强。Li等[45]的研究表明,缺氧条件下3种肝细胞细胞系对氟尿嘧啶(5-FU)的抗性显著增加。低氧一方面降低了肝细胞中基础胸苷酸合酶(TS)和功能性TS的水平,导致dTMP合成及DNA复制减少,影响5-FU对细胞的增殖抑制作用;另一方面减少细胞线粒体膜电位的丧失,抑制半胱天冬酶活化,导致细胞凋亡减少。另外,缺氧情况下,细胞应激性高表达缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)。HIF-1是一种转录因子,可调节包括编码外排泵蛋白P-gp的MDR1基因及编码抗凋亡蛋白Bcl-2基因等多种与药物抗性相关的基因表达,进而诱导细胞产生药物抗性[46]。
除三维细胞模型的缺氧环境外,三维细胞模型的形态学参数,比如细胞球体的尺寸和球形度,也影响细胞的药物抗性[47]。细胞的三维细胞模型呈现的形态大致分为致密细胞球、细胞聚集体和疏松细胞团[48]。三维细胞的形态差异可能与细胞黏附因子的表达有关。Ivascu等[49]研究了8种乳腺癌细胞系的成球状况和黏附因子表达的关系,结果发现形成致密细胞球的4种乳腺癌细胞系均有高的E-钙黏蛋白表达,且这种形态仅被E-钙黏蛋白抗体解除;形成疏松细胞团的4种乳腺癌细胞系缺失E-钙黏蛋白的表达,但通过在建模时加入细胞基底膜,这4种乳腺癌细胞系通过β1整合素-ECM相互作用,也可以形成致密细胞球。由于细胞间交流的增加以及细胞形态引起的基因表达的改变,三维细胞模型产生细胞接触介导的耐药(cell adhesion mediated drug resistance,CAM-DR)[46]。Imamura等[44]发现呈现疏松细胞团的乳腺癌细胞系三维细胞模型与二维细胞模型对紫杉醇及阿霉素的敏感性相似,而呈现致密细胞球的乳腺癌细胞系则显示更强的细胞抗性。类似的,Schwartz等[50]在水凝胶上建立乳腺癌细胞系三维细胞模型时,发现呈现致密细胞球的细胞比单个细胞存在的细胞对靶向受体酪氨酸激酶(RTK)的药物索拉菲尼和拉帕替尼的抗性更高。
三维细胞模型重现肿瘤微环境,提供了一个助于产生药物抗性的条件,在药物研发中可作为研究药物抗性机制及发现药物新靶点的合适工具。Breslin等[51]比较了3种HER2阳性的乳腺癌细胞系分别在三维细胞模型和二维细胞模型对来那替尼的反应。结果表明,来那替尼在三维细胞模型中表现出更强的药物抗性。来那替尼是酪氨酸酶抑制剂,阻断Akt-mTOR-S6K信号通路。而最近的研究发现,相比于二维细胞模型,三维细胞模型在Akt-mTOR-S6K信号传递途径中显示出相对较低的活性,当抑制该信号通路时,三维细胞模型显示出与二维细胞模型不同的反应[52]。Lu等[53]的研究也表示信号通路的改变是抗性产生的原因。他们发现乳腺癌三维细胞模型对阿霉素的抗性可能是由于细胞周期停滞于G2/M期,再通过Chk2/p53/NF-kB途径上调蛋白转运体P-gp引起。另外,基因表达差异也是三维细胞模型产生药物抗性的原因。研究发现,精氨基琥珀酸合成酶1是在3种间皮瘤细胞的三维细胞模型和人类肿瘤一致上调的基因,但在二维细胞模型没有发生上调。这可能是三维细胞模型显示对治疗间皮瘤药物更强抗性的原因[54]。设计并验证三维细胞模型对药物的抗性,可能对临床用药方案有指导意义。Qin等[55]在低氧条件下建立了3种黑色素瘤细胞系三维细胞模型和二维细胞模型,并验证在低氧条件下这两种模型相对正常氧条件下的二维细胞模型对维罗非尼显示出更高抗性。研究进一步发现,低氧条件下,HGF/MET信号上调,这与在耐药性黑素瘤患者组织和小鼠异种移植物中结果显示一致。并且,抑制c-Met/Akt途径可逆转低氧条件下黑色素瘤细胞系三维细胞模型和二维细胞模型对维罗非尼的敏感性。类似的,Song等[56]利用肝细胞癌细胞系分别建立致密细胞球形态的三维细胞模型和疏松细胞团形态的三维细胞模型研究CAM-DR机制,结果发现,致密细胞球形态相比于疏松细胞团形态的三维细胞模型高表达胶原1A1(COL1A1),并对索拉菲尼具有更高抗性。通过siRNA敲低COL1A1的表达,减弱了致密细胞球形成的能力,并且减弱了对索拉菲尼的化学抗性。研究还发现,在呈现致密细胞球的三维细胞模型中,血管紧张素Ⅱ通过不依赖TGF-β的Smad信号传导途径直接诱导CTGF和COL1A1表达,利用血管紧张素Ⅱ拮抗剂氯沙坦可减轻致密细胞球对索拉菲尼的抗性。
3 总结与展望
三维细胞模型与二维细胞模型在细胞形态、增殖分化、基因表达等方面存在差异。近些年的研究表明三维细胞模型有着更高的生理学相关性,适于肿瘤微环境、癌症转移和药物研发的研究。但是,三维细胞模型仍存在一些问题和挑战。(1)建立三维细胞模型所需耗材比较昂贵,提高了总体研究成本。(2)三维细胞模型的建模方法如悬滴法、支架培养法均对实验操作有相对较高的要求,往往需要训练有素的操作人员。(3)针对特定目的,要建立与体内环境相近的三维细胞模型需要先对体内肿瘤微环境各组分进行全面表征,再借助三维细胞模型建模方法重现该环境。因此,三维细胞模型的建立往往需要花费较长时间,然而,并非所有细胞都能在体外成功建立三维细胞模型。(4)针对不同的研究目的,需要开发特定的三维细胞模型,尚无统一化的标准模型[37],并且,对于同样的研究,采用不同的三维细胞模型对研究结果的影响可能存在较大差异。(5)目前的模型只是重现癌症进展中某一特定环节,并未实现在单一培养体系中重现出肿瘤的发展进程。
未来的潜在趋势将可能组合不同的三维细胞模型建模方法,以研究目的为导向建立最适三维细胞模型。随着建模技术的不断改进和组合创新,三维细胞模型作为二维细胞模型与体内肿瘤的桥梁,有望助力于精准医疗和生物药物的发展。例如,通过三维细胞模型培养直接来自患者的细胞或组织[57],测试培养物对不同化疗药物的敏感性,根据结果为患者制定独特的用药方案,达到个体化用药目的。近些年来,随着抗体药物在癌症治疗中显示出的优越性,抗体药物的研究成为新的热点。把三维细胞模型运用到抗体研发的各个环节有希望成为未来的趋势,譬如将三维细胞模型运用于基于细胞实验的抗体类药物质量控制中。本课题组通过旋转培养法,已经成功建立了三维细胞模型,并验证了该模型可用于基于抗体药物的抗体依赖细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)机制以及基于白介素-6(interleukin-6,IL-6)依赖的细胞凋亡机制的生物活性检定中。在未来,三维细胞模型也有可能帮助攻破现有癌症治疗手段的某些壁垒,比如帮助阐明嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)用于实体瘤效果不佳的机制[58]、探究引起肿瘤微环境免疫抑制环境的上级信号[59]。
