胃肠道肿瘤合并肾损害30 例报告并文献复习
2020-05-11肖润沙唐文彬陈子华成小苗
肖润沙,唐文彬,陈子华,成小苗
(中南大学湘雅医院 1.普通外科 2.肾内科,湖南 长沙 410008)
恶性肿瘤是我国和其他发达国家的主要公共卫生问题,它与心血管疾病、糖尿病和呼吸系统疾病一起被列为世界四大主要非传染性疾病。虽然近20年来,癌症病死率持续下降,但仍存在地区间的差异[1],需持续努力,防治结合。而胃肠道恶性肿瘤有很高的发病率和病死率[2-3],GLOBOCAN数据显示,2018年新增大肠癌180多万例和胃癌超过1 0 0 万例[4]。同时,有胃肠道肿瘤与肾损害的相关病例报告[5-6]。有报告[7]认为,肾病综合症(nephrotic syndrome,NS)患者确诊5年后的患癌风险比无肾病的人群更高。也研究[8-9]发现,NS合并胃肠肿瘤的患者,在肿瘤切除或化疗后,肾病症状减轻。由此,提出肾损害是潜在的副肿瘤过程[10]。慢性肾脏疾病(chronic kidney disease,CKD)包括原发性和继发性肾小球肾炎、肾小管损伤和肾血管病变等,而肿瘤细胞分泌如细胞因子和肿瘤抗原等产物[11],通过免疫反应引起肾小球疾病。近期有研究[12]表明,25(OH)D缺失可能是CKD患者结肠癌发病过程中的危险因素。此外,老龄化、烟酒、不健康饮食、高胆固醇、高血糖、高血压等危险因素,也大大增加了肾病患者患恶性肿瘤的可能[13]。为探讨肿瘤和肾损害之间存在的联系,笔者收集了30例胃肠道肿瘤合并肾损害患者的临床资料,并复习相关文献,以期为临床诊疗提供参考。
1 资料与方法
1.1 一般资料
收集整理中南大学湘雅医院2 0 1 7 年3 月— 2019年11月收治的胃肠道肿瘤合并肾损害的病例共30例。所有患者均经病理证实为恶性肿瘤,本项研究经医院伦理委员会评审通过,治疗时患者家属均知情同意。患者中男24例,女6例;平均年龄(65.6±10.32)岁。其中结肠癌18例,直肠癌 9例,胃癌3例。
1.2 方法
患者检测血清总蛋白、血清白蛋白、尿素氮,血肌酐和血尿酸,用公式计算出肾小球滤过率并进行CKD分期。
1.3 统计学处理
数据采用SPSS 17.0软件分析。计量资料采用均数±标准差(s)表示。
2 结 果
2.1 血液指标化验结果
患者的血液检验指标包括血红蛋白、血清总蛋白、血清白蛋白、尿素氮,血肌酐和血尿酸结果,用均值±标准差(s)表示(表1)。
表1 30 例患者血液检验结果
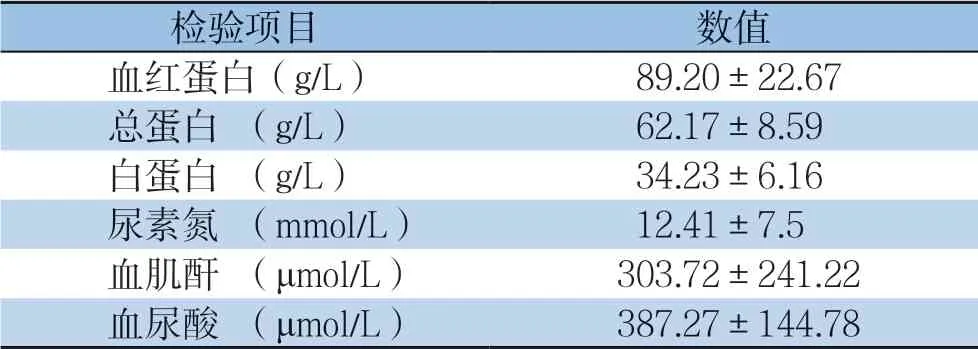
表1 30 例患者血液检验结果
2.2 性别、年龄和高危因素
本组有肿瘤合并肾损害患者3 0 例, 男 2 4 例(8 0.0%),女6 例(2 0.0%);平均年龄(65.6±10.32)岁,最小的是38岁、最大的是83岁;其中0~39岁1例,40~49岁1例,50~59岁6例,60~69岁11例,70~79岁9例,80以上2例。高危因素中,有吸烟史16例(46.7%),无吸烟 14例(53.3%);吸烟史时长20~50年。有饮酒史 12例(40.0%),无饮酒史18例(60.0%);饮酒史时长20~40年。有糖尿病史8例,无糖尿病史 2 2 例。有高血压史2 0 例,无高血压史1 0 例 (表2)。
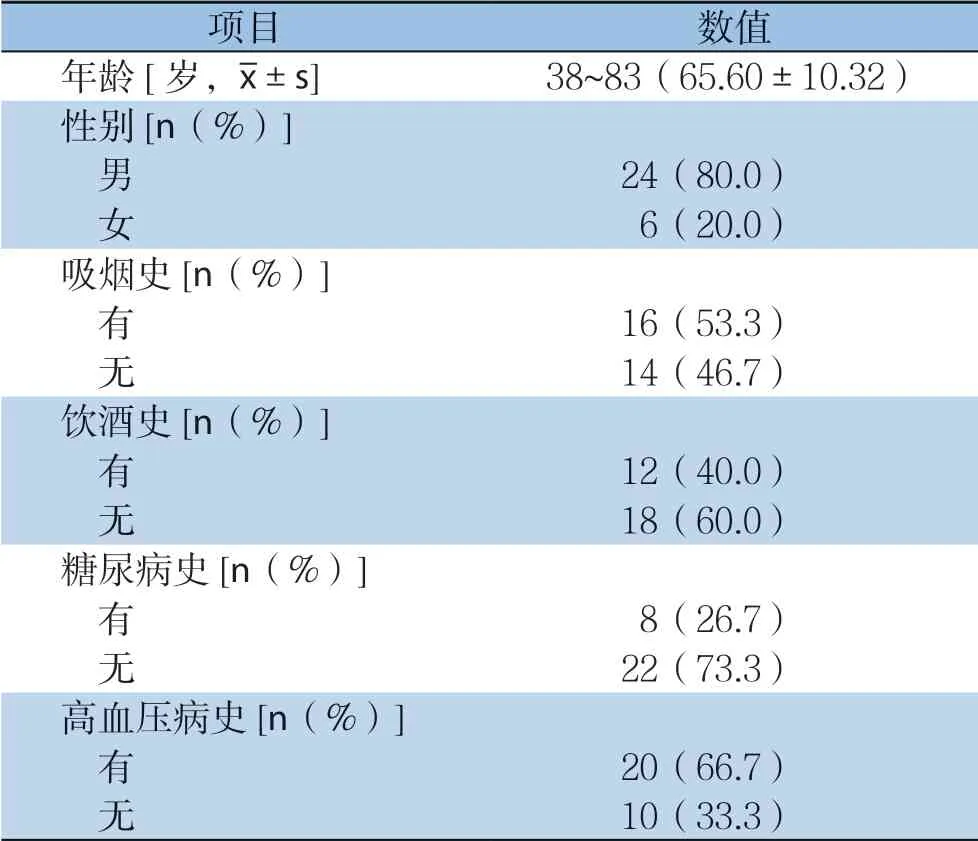
表2 30 例患者的高危因素及一般资料
2.3 患者肿瘤类型、治疗方式、肿瘤和肾损害的时间先后和肾功能情况
肿瘤类型:胃癌3例,结肠癌18例,直肠癌9例。治疗方式:26例肿瘤手术切除,2例做化疗未手术,2例未手术及化疗。截至患者入院时,肿瘤切除术后生存期最长者已有16年。肿瘤与肾损害发生前后关系是:肿瘤发生在肾损害之前5例,时间最长16年,最短1周;肿瘤发生在肾损害之后22例,最长14年,最短7个月。肿瘤和肾损害同时发现3例。肾功能情况是:急性肾损伤(acute kidney injury,AKI) 2例、CKD28例;计算肾小球滤过率并进行CKD分期,结显示5例CKD 2期, 7 例C K D 3 期,6 例C K D 4 期 和1 0 例C K D 5 期 (表3)。
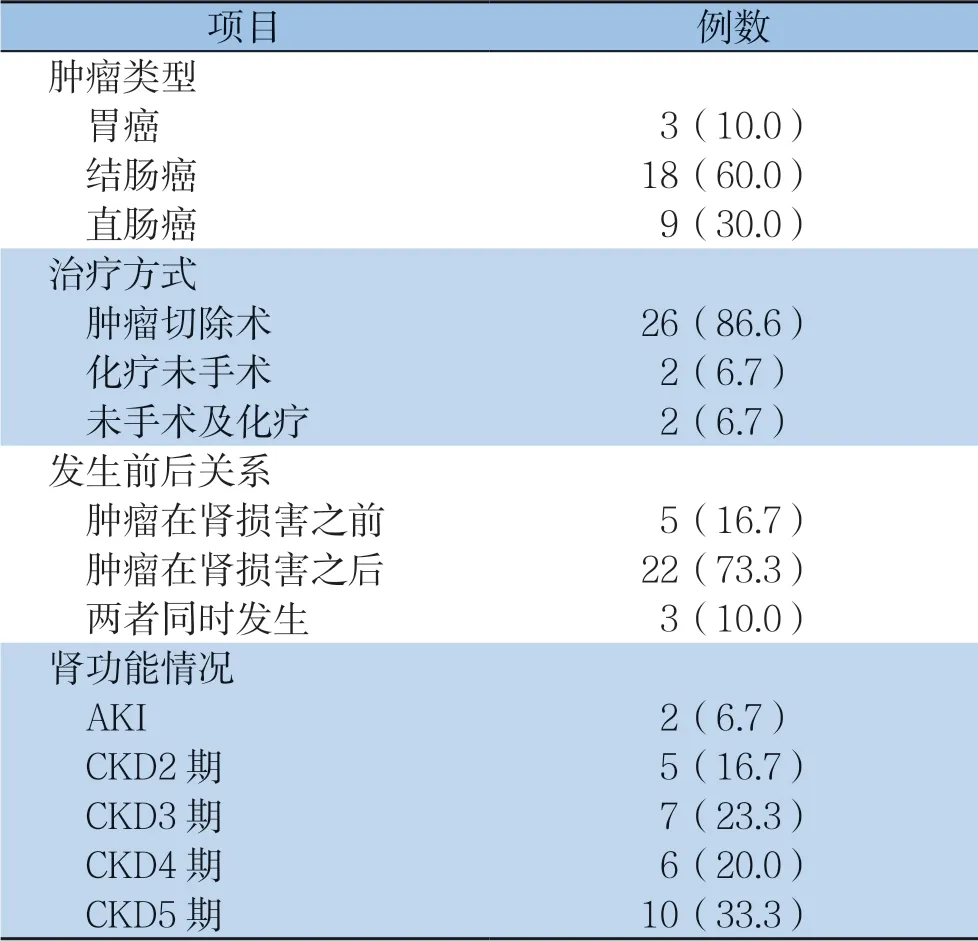
表3 30 例肿瘤类型、治疗方式、与肾损害前后关系及肾功能[n(%)]
3 讨 论
我国的CKD问题已成为重要的公共卫生问题[14],高龄、CKD家族史、糖尿病、高血压、高蛋白饮食、高血脂症、高尿酸血症、高钙血症、自身免疫性疾病、泌尿系感染、乙肝、肿瘤的放化疗、肾毒性药物史等均是CKD的易患因素,各种原发和继发性肾脏疾病最终进展为尿毒症。一方面,尿毒症毒素导致胃肠道紊乱和诱发炎症,增加胃肠道恶性肿瘤发生的风险性。另一方面,肿瘤的发生发展也与免疫系统存在着相关性,过量的癌症发病率与潜在的未确诊肿瘤(其抗原引发肾小球肾炎)或免疫抑制疗法(引发或激发肿瘤细胞)[15]引起肾损伤有关。有学者[16]建立了类似于人肾小球肾炎的兔实验模型,发现沿着肾毛细血管基底膜有免疫复合物的沉积,推测肿瘤可能作为抗原,刺激机体产生抗体,抗原-抗体复合物的沉积损害了肾脏;一些肿瘤患者可能容易受到肿瘤相关抗原-抗体复合物在肾小球内沉积的影响,从而导致严重的肾小球损伤[17]。
胃肠道肿瘤相关肾损害表现有慢性肾炎、肾小管间质病变、急进性肾炎、AKI或CKD的不同阶段。尿毒症毒素刺激胃肠道,破坏肠道的免疫屏障,释放细胞因子及炎症介质[18],随着肾小球滤过率的下降,恶性肿瘤的危险性也增加。与本组报告的30例中,CKD占大多数有28例,其中有CKD 2期5例,CKD3期7例,CKD4期6例,CKD5期10例相一致;另外本组还有AKI 2例,提示急性或慢性肾功能衰竭仍是癌症及其治疗的重要并发症[19-20]。
胃肠道肿瘤相关肾损害的病理类型以膜性肾病(membranous nephropathy,MN)多见、其次有膜增生性肾炎[21]、IgA肾病[22]、新月肾小球肾 炎[23]等。有相当多文献[24-25]报道,胃肠道肿瘤的患者病理类型M N 多见, 尤其是6 5 岁以上的患者存在癌症风险过高的流行病学证据。本组患者的年龄段最小者3 8 岁、最大者8 3,平均年龄(65.60±10.32)岁,与文献[26]报道的恶性肿瘤的发生率随年龄增长而增加相一致。如何利用实验室指标来帮助筛选表现为MN的恶性肿瘤[27], 这里要提到M型抗磷脂酶A2受体(M-type phospholipase A2 receptor,PLA2R),它是2009年Beck LH 等[28]确认的导致成人MN发病的一个特异性抗原,位于肾小球足细胞上;抗PLA2R抗体在原发性MN患者血清中的阳性率约为70%~80%,但在继发性MN患者血清中阳性率很低且肾组织 PLA2R 几乎不表达。因此血清和肾组织 PLA2R 表达能协助区分原发性MN和肿瘤导致的继发性MN。
在肾脏病的治疗方面,NS患者可以选用类固醇、其他免疫抑制剂或ACEI/ARB等药物治疗,还应预防血栓和感染等并发症。某些患者在抗肿瘤治疗后蛋白尿持续存在,可能反映存在不可逆的肾损害或隐匿的残余肿瘤。因此,有学者[29]认为蛋白尿可作为肿瘤患者出现肾损害的标志。在出现AKI后,经激素治疗、血液透析及全胃切除术后肾功能改善[30]。
肿瘤和肾损害发生的前后关系方面,肾损害可早于胃肠道肿瘤之前、之后或者同时发生。有学者[31]报告,MN从肾脏损害到发现肿瘤最长历时 10年,22%的MN存在恶性肿瘤。在本组的30例患者中,肿瘤出现在肾损害之前的患者5例,最长时间是肿瘤术后16年被发现有肾损害。肿瘤和肾损害同时发现者3例;肿瘤出现在肾损害之后者22例,最长时间是肾损害14年后发现肿瘤,与文献报道相符。
在胃肠道肿瘤合并肾损害患者的高风险因素方面,笔者发现本组30例患者中,有糖尿病史 8例(26.7%)、无糖尿病史22例(73.3%)。糖尿病是一种复杂的代谢综合征,以长期高血糖为特征,常伴有危及生命的心肾脑并发症。2017年《中国糖尿病防控专家共识》统计我国糖尿病患者人数将近1亿。查阅相关资料,糖尿病患者患癌症的比率已明显高于非糖尿病患者,癌症的发生与糖尿病以及某些糖尿病危险因素和治疗有关。 2010年由 Giovannucci 等[32]为首的专家组发表了美国糖尿病协会和美国癌症协会关于《糖尿病与癌症共识报告》。糖尿病患者患癌症风险增加的机制包括高血糖、刺激IGF-1轴的高胰岛素血症、作为癌症和糖尿病共同土壤的肥胖及其他危险因素。风险评估显示,糖尿病和高体重指数(B M I)与多种癌症风险增加相关[33]。有证据表明2 型糖尿病患者患某些癌症的风险增 加[34],而降糖药二甲双胍似乎可以降低癌症风 险[35]。复旦大学研究团队[36]发现,糖尿病造成的高糖环境影响抑癌基因T E T 2 的活性,从而导致癌症风险的增加。二甲双胍依赖T E T 2 的发挥肿瘤抑制的作用。本组胃肠道肿瘤合并糖尿病的 8 例患者,已出现了蛋白尿,有明显的肾损害。这提醒了在糖尿病早期就有筛查肿瘤的价值;本组患者有高血压史20例(66.7%),无高血压史10例(33.3%),可能与高血压造成肾小球内毛细血管袢压力增加,牵拉刺激可损伤足细胞,最终导致肾小球硬化有关[37];本组患者有吸烟史 16例(46.7%)、无吸烟史14例(53.3%),吸烟史时长20~50年。有饮酒史12例(40%)、无饮酒史18例(60%),饮酒史时长20~40年。提示吸烟、饮酒不仅是高血压、糖尿病的危险因素,同时也可能是恶性肿瘤的危险因素。
恶性肿瘤的治疗包括手术切除、化疗或放疗等。如选择腹腔镜辅助胃癌根治术带来明显的优势[38],同时还能提高手术R0切除率[39];联合机器人辅助和腹腔镜直肠癌手术具有良好的安全性和疗效[40]。根治性切除加完全腹腔辅助化疗是治疗结肠癌、结直肠癌腹膜癌的有效手段[41-42]。多西他赛的新辅助化疗治疗进展期胃癌,可提高根治性手术切除率和减少术后并发症的发生[43]。
而在肿瘤治疗过程中,有越来越多的因素成为肾损伤的原因。肿瘤药物副作用引起重度呕吐可以通过电解质紊乱对肾脏产生间接影响[44],呕吐导致容量不足,止痛药,高凝状态及肿瘤相关血栓性微血管病可导致的AKI[19]。肿瘤给予放疗或化疗后,导致肿瘤细胞大量溶解破坏,核酸分解导致高尿酸血症,尿酸结晶在肾组织沉积诱发炎症反应造成间质损害;肿瘤合成和分泌甲状旁腺相关蛋白增多诱导骨转化和钙贮存释放,引起高钙血症、炎症细胞浸润、肾小管坏死和间质纤维化。肿瘤可能作为抗原和特异性抗体组成复合物沿着肾小球基底膜沉积引起肾脏的损伤[45]。此外,造影剂肾病、放射性肾病[46]、还有疗药物如奥沙利铂在治疗癌症的同时,也可能导致肾脏的损 伤[47-48],严重时需要进行血液净化来提供帮助[49]。
本组的2 6 例患者的胃肠道肿瘤已行手术切除,2例因其他原因未手术,2例给予化疗但未手术。截至入院时,肿瘤切除术后存活时间最长者为16年。对于恶性肿瘤相关的肾病综合征患者,最好的治疗方案是完全切除肿瘤,当肿瘤移除完成后,患者的肾病综合征将缓解[50-51]。对于胃肠道肿瘤患者,选择外科手术切除、辅助化疗及其他生物治疗具有减少复发和降低病死率的效果[31,52]。
综上,随着CKD 患者的发病率逐年升高[53],对于有肾脏基础疾病的患者,特别是有吸烟饮酒史、糖尿病或高血压病史等高风险因素存在的患者,建议积极筛查肿瘤的发生,如血清学检测、胃镜、肠镜、C T 等辅助检查。对于胃肠肿瘤患者,早发现并选择合理治疗方案,如手术切除、辅助化疗或靶向治疗,可以减少或减轻肾损害,从而改善胃肠肿瘤的整体预后。
