头尾侧联合入路腹腔镜右半结肠癌根治术的近期临床疗效分析
2020-05-11杨熙华罗吉辉肖方涛郭仪
杨熙华,罗吉辉,肖方涛,郭仪
(湖南省郴州市第一人民医院 肿瘤外科,湖南 郴州 423000)
结肠癌是我国常见的消化系恶性肿瘤,发病率和病死率均呈逐年上升趋势,数据统计表明右半结肠癌是其中较为常见的结肠癌类型,范围包括部分横结肠、结肠肝曲癌、升结肠癌及阑尾恶性肿瘤,临床症状主要表现为腹部隐胀痛不适、腹部包块、大便性状改变和贫血等,根治性手术是最为重要的治疗手段[1]。自1991年Jacobs等[2]首次将腹腔镜技术用于治疗右半结肠癌以来,该术式逐步获得认可并被不断丰富和发展[3]。相关指南与规范建议:腹腔镜技术具有创伤小、出血少、恢复快的特点,其安全性也得到了权威研究结果的支持,除外局部晚期、急性梗阻或穿孔的结肠癌患者,推荐腹腔镜结肠癌根治手术[4]。然而,目前关于该术式的手术入路尚具有较大分歧[5],本文回顾性分析过去4年间在我肿瘤外科行腹腔镜手术的右半结肠癌患者120例的临床病理资料,分析和探讨不同手术入路腹腔镜右半结肠癌的近期临床疗效,以期为临床诊疗及术式选择提供帮助,现将结果报告如下。
1 资料与方法
1.1 临床资料
将2014年11月—2018年11月期间,在湖南省郴州市第一人民医院肿瘤外科行腹腔镜手术的120例右半结肠癌患者纳入本研究。病例纳入标准:⑴ 年龄≥18岁;⑵ 术前均经肠镜活检确诊为结肠癌;⑶ 经CT、MRI、PET等影像学检查排除肝、肺部或腹膜后等远处转移;⑷ 无腹腔镜手术禁忌并完成腹腔镜根治性手术治疗。排除标准:⑴ 急诊手术、姑息性切除;⑵ 有远处转移患者;⑶ 术中中转开腹;⑷ 合并严重心肺功能障碍或其它恶性疾病不能耐受手术患者。其中采用头尾侧联合入路共68例(观察组),采用中间入路共52例(对照组)。两组患者在性别、年龄、体质量指数(BMI)、肿瘤部位、病理类型、术前白蛋白水平、美国麻醉医师协会评分(ASA评分)、肿瘤术后TNM分期方面的基线情况见表1。上述差异均无统计学意义(均P>0.05),两组资料具有可比性(表1)。
1.2 治疗方法
1.2.1 麻醉与体位 两组患者均于术前合理调整饮食并进行肠道清洁,常规气管插管全麻,患者取仰卧位,呈“人”字分腿型。气腹压力为12~15 mmHg (1 mmHg=0.133 kPa)。完成Trocar 孔布局后手术台呈头低脚高、左侧倾斜15~30°。
1.2.2 Trocar 孔选择及术者站位 采用“5 孔法”Trocar 布局,位置分别为:观察孔在脐下约 3 cm、主操作孔位于左锁骨中线与横结肠体表投影处,右锁骨中线肋缘下、麦氏点及反麦氏点作为辅助操作孔。主刀位于患者左侧,第一助手位于患者右侧,扶镜手位于患者两腿之间。
1.2.3 建立操作平台后 先进行腹腔镜探查、排除腹腔种植转移。选取不同手术入路进行腹腔镜右半结肠癌根治术。腹腔镜游离完毕,终止气腹,均取脐上腹部正中切口,长约5 cm,一次性保护套保护切口,将游离的右半结肠提出体外,在直视下离断10~15 cm 末段回肠和横结肠行右半结肠切除,选择回肠- 结肠吻合,吻合口直视下3-0 可吸收缝线加固缝合。严格止血、生理盐水冲洗腹腔,右侧结肠旁沟留置腹腔引流管行术后引流。手术由同一组医生完成(每年腔镜手术量超过100 台),手术过程必须严格遵守CME 原则和根治原则。
1.2.4 头尾侧联合入路主要手术步骤 首先确认小肠系膜根部,以此为标志,于胰颈前方、屈氏韧带根部上方切开进入横结肠系膜后间隙,在距胰颈约2 cm 处可见结肠中动脉,予以淋巴结清扫暂不结扎动脉,沿肠系膜上静脉(SMV)、肠系膜上动脉(SMA)游离并清扫淋巴脂肪组织直至胰颈,爬坡向上至胰颈表面,向上可透视到横结肠系膜腹侧叶上方的胃大弯。此时已清晰显露出胰头及胰颈,于胰前筋膜处放置纱条作为标识 (图1A),当尾侧入路沿右腹膜后间隙向上分离时可准确、快速进入横结肠肝曲系膜后间隙,避免进入胰十二指肠后间隙。于胃大弯中点前下横行切开胃结肠韧带进入网膜囊,可见纱条 (图1B-C);然后沿胃大弯自左向右将右侧胃结肠韧带离断,向外至结肠肝曲,离断肝结肠韧带 (图1D)。将回盲部翻向头侧,在右髂总动脉上方约1.0 cm 处(此为肠系膜根背侧投影线),可透视见到右生殖血管与输尿管。在其内侧横弧形切开该线(图1E),较容易找到右腹膜后间隙,向上锐性分离至十二指肠降部、水平部,此时可见胰头颈处留置作为标识的纱条(图1F),向内侧达到SMV 右侧即可。将回盲部放回原位,在腹侧回结肠血管下方横弧形自然皱折处切开(图1G),即与右腹膜后间隙相通(图1H),此时向内侧可轻易解剖SMV(图1I)。将SMV 所属分支全部走行分离显露后(图1J),再据术式(标准右半或扩大右半结肠切除)切断右结肠静脉或加上胃网膜右静脉(图1K)。
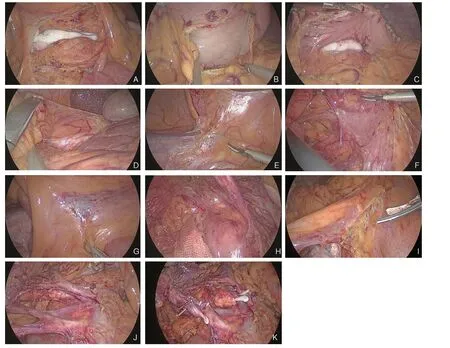
图1 结肠肝曲癌头尾侧联合入路腹腔镜右半结肠癌根治术 A:屈氏韧带根部上方切开进入横结肠系膜后间隙,胰前被膜处放置纱条作为标识;B:于胃大弯中点处横行切开胃结肠韧带进入小网膜囊;C:沿胃结肠韧带向胃窦十二指肠方向游离,可见之前留置于胰前被膜处的纱条;D:离断肝结肠韧带至结肠肝曲;E:切开进入右腹膜后间隙(回盲部背侧入路);F:拓展右侧Toldt 间隙;G:回结肠血管下方横弧形自然皱折处切开(回盲部腹侧入路);H:与右腹膜后间隙相通;I:血管走行清楚可见;J:解剖并网络化血管;K:根据术式离断血管Figure 1 Laparoscopic right radical hemicolectomy through combined craniolateral and caudolateral approach for tumor of hepatic flexure of the colon A: Entering the posterior space of the transverse mesocolon by incision of the superior side of the root of the ligament of Traitz, and placing the gauze strips at the anterior pancreatic fascia as a marker; B: Transecting the gastrocolic ligament at the middle point of the greater curvature of the stomach and entering into the lesser omental sac; C: Dissociation toward the antrum and duodenum along the gastrocolic ligament, seeing the gauze strips previously placed in the anterior pancreatic fascia; D: Detaching the hepatocolic ligament to hepatic flexure of colon; E: Incision into the right retroperitoneal space (ileocecal dorsal approach); F: Expanding the right Toldt’s fascia; G: Incision of the transverse arc natural folds beneath the ileocolic vessels were incised (ileocecal ventral approach); H: Connection to the right retroperitoneal space; I: Clear presence of running pattern of the blood vessels; J: Dissecting and networking blood vessels; K: Division of the vessels according to the procedure
1.2.5 中间入路主要手术步骤 准确找到回结肠血管提起,在其下方剪开右结肠系膜前叶,找到Toldt 间隙,沿回结肠血管根部解剖出肠系膜上静脉和动脉,并进行淋巴结清扫,将肠系膜上静脉裸化,清晰显露出外科干;将肠系膜上血管向右半结肠的属支血管离断后,沿升结肠系膜后叶深层的Toldt 间隙向外侧游离。上至十二指肠水平部和胰头前方,完整切除结肠系膜的前后叶并清扫系膜内的淋巴结及脂肪组织。于胃大弯中点前下横行切开胃结肠韧带进入网膜囊。然后沿胃大弯自左向右将右侧胃结肠韧带离断,向外至结肠肝曲,离断肝结肠韧带,向后、向下方分离达十二指肠水平部和胰头前方的胰腺被膜并用超声刀打开,与外侧、后方的分离面相贯通。
1.3 手术标本质量评估
采用文献[6]分级系统评价手术标本质量。A级固有肌层面:仅切除少量结肠系膜,轴向最近切缘到肠壁固有肌层;B级结肠系膜内层面:不规则切除部分结肠系膜,轴向最近切缘超过肠壁固有肌层;C级结肠系膜层面:完整切除结肠系膜,系膜脏层完整光滑,供养血管高位结扎。
1.4 观察指标
手术时间、术中出血量、淋巴结清扫总数、手术标本质量、术后首次通气时间、术后并发症及术后住院时间。
1.5 统计学处理
应用SPSS 20.0软件进行统计处理。计量资料用均数±标准差(x±s)表示,组间比较采用独立样本t检验。计数资料用例数(百分数)[n(%)]表示,组间比较采用χ2检验或Fisher确切概率检验,取双侧α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结 果
2.1 两种手术入路观察指标比较
观察组在手术时间、术中出血量方面明显优于对照组,差异有统计学意义(均P<0.05);而在术后首次排气时间、手术标本质量、淋巴结清扫总数、术后并发症及术后住院时间方面,两组相比较,差异均无统计学意义(均P>0.05)。观察组术后并发症发生率为22%(15/68),2例肠梗阻经保守治疗后治愈;2例淋巴漏经积极营养支持治疗后治愈;9例伤口感染经积极伤口换药、抗感染等治疗后愈合;1例出现肺部感染经抗感染、雾化等治疗后好转、治愈;1例术后出现吻合口漏,考虑与术前低蛋白血症、营养不良有关,经保守治疗后逐步愈合。对照组术后并发症发生率为 25%(13/52),术后并发症发生情况如下:1例肠梗阻、1例淋巴漏、2例肺部感染、1例腹腔脓肿、7例伤口感染,均经积极治疗后治愈。无手术相关死亡病例。两组术后并发症发生率差异无统计学意义(χ2=0.142,P=0.706)(表2)。

表2 观察组与对照组临床指标比较Table 2 Comparison of the clinical variables between observation group and control group
2.2 肥胖、结肠肝曲肿瘤患者不同手术入路观察指标比较
两组患者均完成腹腔镜右半结肠癌根治术,在肥胖、结肠肝曲癌患者中,观察组手术时间短、术中出血少、术后首次排气时间快(均P <0.0 5),而在淋巴结清扫数、术后住院时间和术后并发症方面两组差异无统计学意义(均P>0.05)(表3-4)。

表3 观察组与对照组肥胖患者临床指标比较Table 3 Comparison of the clinical variables in obese patients between observation group and control group

表4 观察组与对照组结肠肝曲肿瘤患者临床指标比较Table 4 Comparison of the clinical variables in patients with tumor of hepatic flexure of the colon between observation group and control group
3 讨 论
近10余年来,随着腹腔镜技术的迅速普及、手术器械的改进,腹腔镜右半结肠癌根治术因其微创、术后切口疼痛轻、恢复快等优势,已被广泛接受并开展[7-9]。有学者[10]认为头侧较尾侧入路手术时间短,出血少,更易操作;也有学者认为尾侧较头侧入路更易找到右腹膜后间隙、进入正确的外科操作间隙,并行血管根部淋巴结清扫与高位结扎,淋巴结清扫数目更多、更彻底[5],目前中间入路手术方式被大部分学者接受[11-14]。然而至今,哪一种手术入路更易学习掌握并同时进行完整结肠系膜切除术(complete mesocolic excision, C M E)尚存在争议[15-16]。本研究回顾性分析了腹腔镜右半结肠癌手术的120例患者的临床病理资料显示:头尾侧联合入路手术方式手术时间为(110.9±3.8)min、出血量(25.5±5.9)mL,均小于中间入路手术方式,且有统计学差异(P<0.05)。出现这种差别的主要原因可能是:⑴ 经横结肠系膜后间隙,显露出胰头及胰颈,放置纱条作为标识,当尾侧入路沿右腹膜后间隙向上分离时可准确、快速进入横结肠肝曲系膜后间隙,避免进入胰十二指肠后间隙。⑵ 回盲部背侧入路游离在Toldt筋膜与Gerota筋膜之间[17],可完整切除结肠及结肠系膜,此时整个右侧腹膜后间隙已经空旷、当沿腹侧回结肠血管下方横弧形自然皱折处切开后可与之汇合,避免进入结肠系膜内。⑶ 以往中间入路游离肠系膜上静脉时,会出现肠系膜上静脉或其他血管出血可能,此时只能依靠小纱布压迫止血。而当整个右半结肠及其系膜能像帐篷一样撑起来,此时有利于辨别并解剖SMV、SMA。即使有出血,止血方式除压迫止血外,还可以应用无损伤钳夹血管,控制出血。
本研究显示,与中间入路组比较,头尾侧联合入路组在术后首次排气时间、手术质量、淋巴结清扫总数、术后并发症、术后住院时间方面未见明显劣势。因此,可认为腹腔镜下右半结肠癌根治术采取头尾侧联合入路是安全可行的。
腹腔镜右半结肠癌根治术的要点与难点在于胃结肠干及其属支的解剖与分离[18]。朱广伟等[19]采用“头侧-中央混合入路方式”行腹腔镜右半结肠癌手术,认为能够更好地显露胃结肠干及其属支,减少手术的出血,减少手术时间,能够更容易的完成手术。黄晓天等[20]认为小肠系膜根部入路的手术方式,符合传统开腹手术习惯,有利于胃结肠干及其属支的辨认,还具有安全性高、手术技术易掌握等优势。有研究表明,肥胖[21-22]、肿瘤位置[23-24]均是手术入路选择重要的参考指标。这是因为肥胖患者腹腔内结肠系膜脂肪垫肥厚以致回结肠血管不易观察,此类患者往往脂肪脆、牵拉时易出血,术中超声刀烧灼后加之脂肪液化使术野不清,影响寻找正确的解剖层次及操作[21]。此种情况如仍采用中央入路方式,容易走错层次;且胃结肠静脉干及其属支的解剖关系复杂,再加上胰十二指肠静脉往往较细小、静脉壁非常菲薄,腹腔镜手术中常会因为忽略它的存在而过度牵拉、或者盲目解剖而致其出血,甚至有少部分患者不得不中转开腹手术[25]。结肠肝曲癌多数向后浸润肾前脂肪囊,该区域呈现病理性变化、肿瘤与周边组织、器官粘连导致原本清晰的解剖层次变得不再清楚;此时,如果仍采用传统中间入路由下而上分离,难以找到正确的外科操作平面或容易走错间隙,增加手术难度、不利于淋巴结清扫[26]。另外有部分结肠肝曲肿瘤与十二指肠的解剖关系术前尚不能真正明确,如果选择中间入路,先行离断右半结肠主要血管,可能出现区域结肠肠管缺血坏死、手术被动的局面[27-28]。为此,本研究进一步将肥胖、结肠肝曲肿瘤两个因素行亚组分型显示:与中间入路相比,肥胖或者结肠肝曲癌患者采用头尾侧联合入路手术方式行腹腔镜右半结肠癌根治术在手术时间、术中出血量及术后排气时间方面更具有优势。这是因为经头尾侧联合入路分离后视野更开阔,层次更清晰,逐层分离,可以更好地保护重要血管,整体上有利于节省手术时间、减少或避免出血,为患者术后快速康复创造条件。
综上所述,在各种治疗原则不变的情况下,腹腔镜下右半结肠癌根治术采取头尾侧联合入路是安全可行的,特别适用于肥胖、肿瘤位于结肠肝曲的患者[21],值得在临床推广。诚然,至今还没有循证医学结果来证实哪种手术入路具有绝对优势。因右半结肠系膜根部所涉及的解剖结构复杂、血管变异情况较多[29],所以选择手术入路时需遵循 “利于解剖并减少副损伤”的指导原则;当选择某种入路如果出现出血、视野暴露不清楚、层次寻找困难等情况,应及时灵活调整手术入路或必要时中转开腹[30]。无论选择哪种手术方式均需规范化操作,以提高手术质量、改善预后生存为目的。由于本研究数据来自单中心回顾性临床资料,不可避免地存在一些不足,比如缺少生存随访数据,不能明确两种手术入路在远期疗效上是否有差别;再者右半结肠癌根治术并发症发生率较低,加之本研究样本量偏少、可能导致结果偏倚。关于不同手术入路的远近期疗效差异亦期待多中心、前瞻性的进一步的临床研究。
