重组融合蛋白MBP-PAI 的表达、纯化及酶活测定
2020-05-11黄昕畑张白曦陈海琴
黄昕畑, 张白曦, 陈海琴, 张 灏, 陈 卫
(江南大学 食品学院,江苏 无锡214122)
反10,顺12-共轭亚油酸(t10,c12-CLA)是一种具有两个共轭双键的十八碳二烯酸,是共轭亚油酸最重要的活性单体之一[1]。t10,c12-CLA 具有多种生理功能,如减少机体脂肪积累、预防动脉粥样硬化、调节免疫、抗肿瘤等[2]。 该脂肪酸也因此成为目前研究的热点,在食品工业和药品、保健品行业拥有巨大的发展前景。
来源于痤疮丙酸杆菌的亚油酸异构酶(PAI)是惟一一种晶体结构已知的亚油酸异构酶[3]。 由于痤疮丙酸杆菌是一种致病菌,因此将PAI 在其他宿主微生物中表达迫在眉睫,在这之中研究最多的就是PAI 在大肠杆菌的表达。 研究表明, 在大肠杆菌中PAI 多以不可溶的包涵体形式存在[4-5];将PAI 与组氨 酸 标 签 (His-tag)、 谷 胱 甘 肽 巯 基 转 移 酶(Glutathione S-transferase,GST)和小分子泛素样修饰蛋白(Small ubiquitin-likemodifier,SUMO)融合表达也不能有效减少其包涵体的形成,PAI 活性蛋白的表达量依然很低[6-8],这给PAI 未来的应用造成了困难。 因此,作者通过基因工程手段,将能够提高蛋白质可溶性的标签——麦芽糖结合蛋白 (Maltosebinding protein, MBP)与PAI 在低温诱导表达载体pColdV 中融合表达,通过优化诱导培养条件,提高了PAI 在大肠杆菌中的可溶性表达水平,并将重组融合蛋白纯化得到了具有活性的可溶性蛋白质。
1 材料与方法
1.1 菌株和质粒
菌株E.coliBL21、E.coliBL21 (DE3)(pET24apai):均保藏于江南大学生物技术中心;质粒pColdV:购自宝生物工程(大连)有限公司。
1.2 主要试剂
限制性内切酶: 购自New England Biolabs (北京)有限公司;氨苄青霉素(Amp)、溶菌酶(lysozyme)、异丙基-β-D-硫代半乳糖苷(IPTG):购自上海生工生物工程技术有限公司;MBP 亲和层析柱MBPTrap HP:由GE Healthcare 提供;质粒小提试剂盒、PCR产物纯化试剂盒:均购自天根生化科技(北京)有限公司;其余试剂:为国产分析纯产品。 全基因合成由金斯瑞生物科技有限公司(南京)提供,本实验所需的引物合成及测序工作均由华大基因完成。
蛋白质纯化所需缓冲液配方如下: 结合缓冲液(100 mmol/L Tris-HCl,100 mmol/L NaCl,1 mmol/L EDTA,pH 7.4),洗脱缓冲液(100 mmol/L Tris-HCl,100 mmol/L NaCl,1 mmol/L EDTA,10 mmol/L 麦芽糖,pH 7.4)。
1.3 培养基
LB 培养基:胰蛋白胨体积分数1%,酵母浸出粉体积分数0.5%, 氯化钠体积分数1%,pH 7.0,高压灭菌20 min。 所需抗生素为100 μg/mL 氨苄青霉素。 固体培养基是在上述培养基中加入2 g/L 的琼脂。
1.4 重组融合蛋白质表达载体的构建
以来源于E.coli编码MBP 的基因malE(Genbank:AHM36606.1)为模板,将malE基因合成并连接至质粒pUC57 上,全基因合成由南京金斯瑞公司完成。 分别用KpnI/HindIII限制性内切酶双酶切pUC57-MBP,切下malE基因并切胶回收,与同样酶切的载体pColdV 在16 ℃连接反应过夜,构建pCold-MBP 重组质粒。
以PAI 的基因pai(Genbank:AX062088)为模板,设计PCR 扩增引物。 上游引物P1:5’-CCCAAGCTT ATGTCCATCTCGAAGGATTCACG-3’,下游引物P2:5’-GCTCTAGATTACACGAAG AACCGCGTCAC-3’,其中划线部分分别为限制性酶切酶识别位点HindIII、XbaI。引物均由华大基因合成。以作者所在实验室前期构建的含有pai基因的质粒pET24a-pai为模板,PCR 扩增基因pai,PCR 程序为:95 ℃2 min,95 ℃20 s,60 ℃20 s,72 ℃24 s, 72 ℃5 min, 30个循环。HindIII/XbaI双酶切纯化回收后的PCR 产物, 用并与同样酶切的pColdV-MBP 载体在16 ℃连接反应过夜,转化E.coliBL21 感受态细胞,涂布于含100 μg/mL 氨苄青霉素的LB 平板上, 挑选菌落,质粒抽提并经酶切鉴定筛选阳性单克隆并送至华大基因测序,构建融合蛋白质表达质粒pCold-Mpai。
1.5 重组融合蛋白质诱导表达条件的优化
挑取重组菌株单个菌落, 接种于5 mL 含100 μg/mL 氨苄青霉素的LB 培养基中,37 ℃振荡培养过夜, 再以2%的比例转接于50 mL 含100 μg/mL氨苄青霉素的LB 培养基中。
1.5.1 诱导温度对MBP-PAI 蛋白表达的影响 将重组菌株培养3~4 h 至OD600值为0.4~0.5 时, 取5支试管,每管分装扩大培养液10 mL,分别将试管放在冰水中冷却培养液到10、15、20、28、37 ℃并放置30 min, 加入IPTG 至终浓度为1 mmol/L, 分别于10、15、20、28、37 ℃培养24 h。 以4 ℃、10 000 r/min离心收集菌体,并将其重悬于结合缓冲液中,超声破碎细菌并于4 ℃、6 000 r/min 离心10 min, 收集上清液即为全细胞蛋白质,加入适量1×蛋白质上样缓冲液,吹打混匀后沸水浴10 min,利用SDS-PAGE电泳分析蛋白质表达情况并确定最佳诱导温度。
1.5.2 诱导剂IPTG 浓度对MBP-PAI 蛋白表达的影响 将重组菌株在摇瓶中培养至OD600为0.4~0.5时,取5 支试管,每管分装扩大培养液10 mL,分别按0.01、0.05、0.1、0.5、1 mmol/L 的终浓度加入诱导剂IPTG,15 ℃下培养24 h,离心、破碎菌体后收集上清液作为全细胞蛋白质, 利用SDS-PAGE 分析、比较蛋白质表达量的多少以确定最佳诱导浓度。
1.5.3 诱导时间对MBP-PAI 蛋白表达的影响 加入IPTG 至终浓度为0.1 mmol/L, 在15 ℃下诱导表达,在培养3、6、12、18、24 h 时分别取10 mL 菌液,离心收集菌体并超声破碎,再次离心收集上清液并利用SDS-PAGE 研究培养时间对重组蛋白质表达的影响。
1.6 最佳诱导条件下MBP-PAI 蛋白的可溶性表达量比较
将本研究构建的重组菌株在上述最佳诱导条件下诱导表达,取全细胞蛋白质于4 ℃、12 000 r/min再次离心20 min,取上清液即为可溶性蛋白质。 将全细胞蛋白质与可溶性蛋白质进行SDS-PAGE 分析, 并与本实验室构建的含有pai基因的E.coliBL21(DE3)(pET24a-pai)进行可溶性表达比较,以研究融合标签MBP 对PAI 可溶性表达的影响。
1.7 MBP-PAI 重组蛋白的纯化
将MBP 亲和层析柱用结合缓冲液预先平衡,待层析柱完全平衡后, 将MBP-PAI 可溶性蛋白以0.5 mL/min 的速度缓慢上样至层析柱,静置0.5 h 使蛋白质与柱填料充分结合; 再用结合缓冲液以1 mL/min 的速度进行洗脱,并同时用紫外检测器(280 nm)和记录仪观察洗脱情况,待洗脱液中无蛋白质后, 换含有10 mmol/L 麦芽糖的洗脱缓冲液洗脱MBP-PAI 融合蛋白,洗脱速度为1 mL/min。 收集各阶段样品进行SDS-PAGE 电泳检测。
1.8 酶活测定
酶活测定方法参考宋宇航酶活测定方法[9]。 将底物LA 与适量粗酶液或纯化后的蛋白质反应1 h,经氯仿-甲醇提脂,并用重氮甲烷甲酯化,进行气相色谱测定。
以LA 转化生成t10,c12 -CLA 的转化率代表PAI 粗酶液的酶活, 转化率%=[CLA]/([LA]+[CLA])×100%。 以气相色谱结果计算纯蛋白质的比酶活。
2 结果与分析
2.1 融合表达载体pCold-MPAI 的构建及鉴定
对转化后的阳性克隆子进行鉴定, 用KpnI/XbaI双酶切的结果见图1。 双酶切后分别产生大小约为4 398 bp 和2 418 bp 的产物,与预期相符。 将重组质粒送至测序, 序列与Genbank 比对一致,无移位与突变。

图1 重组质粒pCold-Mpai 的图谱(a)及双酶切鉴定电泳图谱(b)Fig. 1 Map of pCold-Mpai (a) and restriction map of pCold-Mpai(b)
2.2 诱导温度对重组蛋白质表达的影响
诱导温度是重组菌体的生长和蛋白质表达的一种重要影响因素。 为了探究最佳的诱导温度,将重组蛋白MBP-PAI(90 000)分别在10、15、20、28、37 ℃下进行表达,SDS-PAGE 电泳结果见图2。在诱导温度为10、15、20 ℃时, 灰度扫描分析重组蛋白MBP-PAI 表达量基本相同,15 ℃表达量略高于其他两组;随着诱导温度继续升高至28 ℃时,表达量明显降低;诱导温度继续升高为37 ℃时,MBP-PAI表达情况与空载体对照相比无差异,灰度扫描分析也证明了MBP-PAI 无表达。 因此,重组菌株的最佳诱导温度为15 ℃。pColdV 是一个冷休克表达载体,它利用了大肠杆菌的低温表达基因cspA作为启动子调控蛋白质的表达,因此,较高的温度不利于该启动子发挥其作用,这一结果也与Qing 的研究一致[10]。

图2 不同诱导温度对重组蛋白MBP-PAI 表达的影响Fig. 2 Effect of different induction temperature on the expression of MBP-PAI
2.3 诱导剂IPTG 浓度对MBP-PAI 蛋白表达的影响
为了探究诱导剂对于重组蛋白质表达的影响,设置了5 个不同的IPTG 浓度梯度, 分别为0.01、0.05、0.1、0.5、1 mmol/L。 将重组菌株在15 ℃下诱导24 h 后,取胞内蛋白质进行SDS-PAGE 分析,结果见图3。 与空白对照相比,在这5 个不同的IPTG 浓度下重组蛋白质均有表达。 当IPTG 浓度由0.01 mmol/L上升至0.1 mmol/L 时,重组蛋白质的表达量明显增大,在浓度为0.1 mmol/L 时,蛋白质表达量达到最高;但随着IPTG 浓度继续增大,表达量明显降低。这证明较高的IPTG 浓度会影响菌株正常生长,从而影响蛋白质的表达量。 为了减少IPTG 对细菌毒性作用,确定IPTG 最佳浓度为0.1 mmol/L。
2.4 诱导时间对MBP-PAI 蛋白表达的影响
为了使重组蛋白质最大量表达,我们在上述试验的基础上, 进一步对诱导表达时间进行了优化,见图4。 在3~12 h 范围内, 随着诱导时间的延长,MBP-PAI 重组蛋白质的表达量逐渐增大; 在12 h之后,目的蛋白质表达量趋于稳定。 为了提高效率,确定诱导表达的最佳诱导时间为12 h。
2.5 最佳诱导条件下重组蛋白质的可溶性表达情况
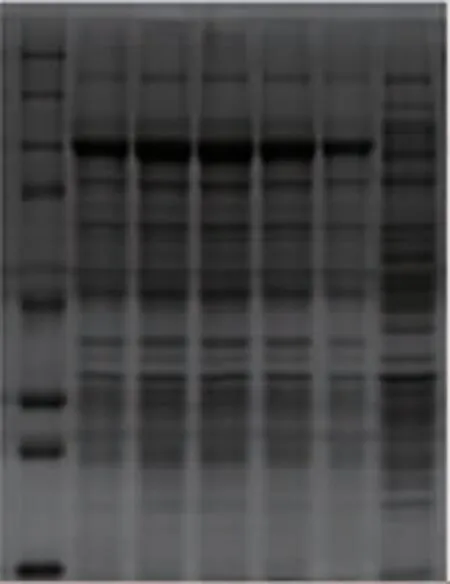
图3 不同IPTG 浓度对重组蛋白MBP-PAI 表达的影响Fig. 3 Effect of IPTG on the expression of MBP-PAI

图4 不同诱导时间对重组蛋白MBP-PAI 表达的影响Fig.4 Effect of induction time on the expression of MBP-PAI
在上述确定的最佳诱导条件(诱导温度15 ℃、IPTG 添加量0.1 mmol/L 、诱导时间12 h)下,比较融合蛋白MBP-PAI 与非融合蛋白PAI 的可溶性表达情况, 以确定融合标签MBP 对PAI 可溶性表达的影响。SDS-PAGE 结果见图5,泳道1、2 分别为本实验构建的重组菌株的可溶性蛋白质和全细胞蛋白质,箭头所示为融合蛋白MBP-PAI 的条带;泳道3、4 分别为将pai 基因单独表达的重组菌株E.coliBL21(DE3)(pET24a-pai)的可溶性蛋白质和全细胞蛋白质,箭头所示为PAI 的条带(50 000)。分析结果显示, 融合蛋白MBP-PAI 在该诱导条件下大量表达,表达量约是PAI 的12 倍。 同时,在电泳图中可以清楚的看到, 重组蛋白MBP-PAI 大部分以可溶蛋白质的形式存在, 而未与MBP 融合的PAI 可溶性表达量非常低,大部分以包涵体形式存在,二者的可溶性蛋白质的比例约为18∶1 (MBP-PAI∶PAI)。证明与MBP 融合表达后, 无论是PAI 的表达量还是可溶性表达量都大幅提高。

图5 最佳诱导条件下重组蛋白质的可溶性表达情况Fig. 5 Soluble expression of recombinant protein underoptimal induction condition
2.6 MBP-PAI 重组蛋白的纯化
经MBP 标签亲和纯化后的结果见图6。 泳道1为最佳诱导表达条件下重组菌株的可溶性蛋白质;泳道2 为上样后的流出液;泳道3 为经结合缓冲液洗脱的杂蛋白质, 可见有极少量MBP-PAI 被洗脱下来,但对后续的洗脱影响不大;泳道4 为洗脱缓冲液洗脱下的蛋白质, 可见MBP-PAI 融合蛋白纯度较高。

图6 重组菌株E.coli BL21(pCold-Mpai)的表达产物纯化及SDS-PAGE 分析Fig.6 Purification and SDS-PAGE analysis of the expression products of recombinant strain E.coli BL21 (pCold-Mpai)
2.7 MBP-PAI 重组蛋白的酶活测定
分别对重组菌株E.coliBL21(pCold-Mpai)和对照菌株E.coliBL21(DE3)(pET24a-pai)的粗酶液进行酶活测定并计算其转化率,结果见图7。重组菌株MBP-PAI 粗酶液转化率为66.1%,约是对照菌株的1.5 倍。 这证明融合蛋白质能够转化LA 形成t10、c12-CLA,MBP 能够通过提高PAI 的可溶性而提高酶的活性。 对纯化后的MBP-PAI 蛋白进行酶活性测定, 根据气相色谱测定结果计算得出比酶活为1.58 U/mg。 以上结果是MBP 融合标签在蛋白质表达中发挥优势作用的又一例证。

图7 MBP-PAI 粗酶液与PAI 粗酶液催化LA 生成CLA的转化率Fig.7 Conversion rate of LA to CLA catalyzed by recombinant MBP-PAI and PAI
3 结 语
目前,大部分重组蛋白质使用的表达载体是大肠杆菌细胞,这是因为大肠杆菌表达的外源蛋白质量大, 通常达到细胞内蛋白质总量的5%~20%,甚至达到50%以上。 但是,由于大肠杆菌细胞缺少折叠机制,当外源蛋白质大量表达时,这些蛋白质通常以包涵体形式存在,这些不可溶的蛋白质甚至可以占到胞内蛋白质的50%以上,这大大影响了蛋白质在大肠杆菌中的表达和应用。 PAI 酶在大肠杆菌中的表达就出现上述情况[3-6,8]。
为了解决这一问题, 作者利用MBP 与PAI 融合表达,并结合低温诱导型启动子cspA 的特性,将PAI 在大肠杆菌中融合表达。 MBP 是一种来自大肠杆菌周质的高可溶性蛋白质,常被当作促溶标签与目的蛋白质融合表达以提高可溶性。 研究表明,当麦芽糖结合在融合环境中使用时,MBP 通过显示分子伴侣的内在性质来促进目标蛋白质的溶解,同时,MBP 还能够促进靶蛋白的适当折叠, 有利于靶蛋白的构象和活性中心的恢复[11]。 cspA 是一种低温诱导型启动子,启动强度较弱,在较低的温度下可以使目的蛋白质的表达较为缓慢,有利于蛋白质的折叠及细胞对蛋白质的加工和转运,从而形成更多具有活性的可溶性蛋白质[12]。 本研究构建的重组菌株E.coliBL21 (pCold-Mpai) 结合了上述两者的优势,将PAI 在大肠杆菌中高效可溶性表达,其最佳诱导表达条件为诱导温度15 ℃、IPTG 添加量0.1 mmol/L 、诱导时间12 h。在该诱导条件下,与未融合MBP 的PAI 相比,MBP-PAI 的表达量是后者的12倍,可溶性表达量是后者的18 倍。 同时,与未融合的PAI 相比, 重组蛋白MBP-PAI 的粗酶液酶活是前者的1.5 倍,纯化后的融合蛋白MBP-PAI 比酶活为1.58 U/mg,是目前报道的较高水平。 本研究结果不仅提供了减少PAI 包涵体的解决方法, 还为PAI在工业中生产t10,c12-CLA 奠定了基础。
