长链非编码RNA LOXL1-AS1在胃癌中的表达及其临床意义
2020-05-11谭诗云
李 明,谭诗云,柴 红
武汉大学人民医院消化内科 消化系湖北省重点实验室,湖北 武汉 430060
胃癌是常见的消化道恶性肿瘤,其死亡率很高。特别是在发展中国家,胃癌患者的数量占全球胃癌患者的70%以上[1]。幽门螺杆菌感染、不良生活习惯(如吸烟、饮酒和高钠摄入量)和遗传因素是导致胃癌的主要原因。目前,改善胃癌患者预后的治疗手段有限。在早期胃癌中由于缺乏诊断标志物,大多数患者在诊断时已处于晚期阶段。并且,由于复发和远处转移,传统的治疗手段经常治疗效果不佳[2]。随着生物学的迅速发展,阐明胃癌发生和发展的分子机制是实现胃癌靶向治疗的关键。
长链非编码RNA(long non-coding RNA,lncRNA)为长度超过200个核苷酸,但不具有蛋白编码能力的RNA分子。虽然lncRNA不具有编码蛋白的能力,但它可在转录水平、转录后水平和翻译水平等层面调控基因的表达[3]。lncRNA在各种生物过程中起重要作用,如细胞生长、分化、死亡,肿瘤的发生和发展[4-10]。LOXL1-AS1是一种lncRNA,编码在赖氨酰氧化酶样1(LOXL1)基因的相反链上[11]。它在细胞应激反应中起重要作用,并与剥脱综合征的发展相关[12]。有研究报道,LOXL1-AS1在胶质母细胞瘤的间充质亚型(MES)中高表达,并通过NF-κB途径促进MES特征的表达[13]。另一项研究发现,LOXL1-AS1通过激活PI3K/AKT途径调节成神经管细胞瘤的增殖和转移[14]。然而,LOXL1-AS1在胃癌中的作用尚不明确,本研究旨在观察LOXL1-AS1在胃癌中的表达,探讨其与胃癌生物学行为和临床病理特征的关系,以期为阐明胃癌发生、发展机制及胃癌治疗提供新的思路。
1 资料与方法
1.1 样本收集收集2018年1月至2019年1月在武汉大学人民医院行手术治疗的89例胃癌患者资料,取其癌组织样本及距癌组织2 cm的癌旁正常组织,术后均经病理检查明确诊断。男49例,女40例,年龄26~70岁。所有患者术前均未行放化疗,未服用过靶向治疗药物,并签署知情同意书。将收集的癌组织和癌旁正常组织冻于-80 ℃保存备用。
1.2 qRT-PCR检测胃癌组织及癌旁组织标本中LOXL1-AS1的表达使用RNAiso Plus试剂(Takara,大连,中国)从胃癌组织及癌旁正常组织中分别提取总RNA。根据试剂盒使用说明书,使用cDNA合成试剂盒(Takara,大连,中国)合成第一链cDNA,采用ABI Prism 7500实时荧光定量PCR仪实时PCR检测LOXL1-AS1表达水平,以GAPDH为内参。每20 μl反应体系内加入400 ng cDNA、10 μl TB Green series(Takara,大连,中国)、正反链引物各0.6 μl及6.88 μl RNase-free ddH2O。qRT-PCR实验条件为95 ℃ 15 min 预变性,95 ℃ 10 s、56 ℃ 20 s、72 ℃ 30 s 重复40 个循环。引物及探针序列如下:LOXL1-AS1引物:Forward:5′-GATATGTTGGATGATGGA-3′,Reverse:5′-GATATGTTGGATGGATGA-3′;GAPDH引物:Forward:5′-GAAGGTGAAGGTCGGAGTC-3′,Reverse: 5′-GAAGATGGTGATGGGATTTC-3′。使用比较循环阈值(Ct)计算基因的相对表达(2-△△Ct),实验重复3次。
1.3 利用Kaplan Meier plotter数据库分析LOXL1-AS1表达水平与胃癌患者预后的相关性目前Kaplan Meier plotter数据库(http://kmplot.com/analysis/)提供了631例胃癌患者的基因表达结果和生存资料,使用者可利用该数据库实现目的基因表达水平与肿瘤患者总生存期(overall survival,OS)的相关性[15]。数据分析条件设定:(1)肿瘤类型:Gastric cancer;(2)目的基因:LOXL1-AS1;其他设定为数据库默认设定。观察指标为LOXL1-AS1表达结果、不同LOXL1-AS1表达下胃癌患者的总生存曲线。生存比较采用风险比(HR)及其95%CI和相应P值。
1.4 统计学分析采用Graphpad Prism统计学软件进行统计学分析,计量资料两组间比较采用t检验;LOXL1-AS1的表达与胃癌临床病理指标的相关性分析采用χ2检验。采用Kaplan-Meier法绘制生存曲线,并进行Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 LOXL1-AS1在胃癌组织及癌旁组织中的表达情况采用qRT-PCR检测武汉大学人民医院89对胃癌组织和癌旁组织样本中LOXL1-AS1基因表达水平,数据分析显示,胃癌组织中LOXL1-AS1表达量为3.98±2.24,癌旁组织中的表达量为2.20±1.18,胃癌组织中LOXL1-AS1表达量显著高于癌旁组织(P<0.001)(见图1)。
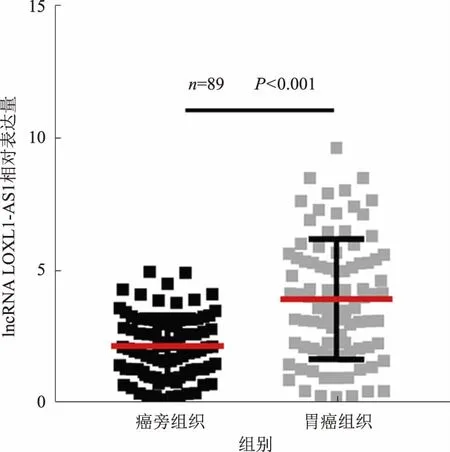
图1 lncRNA LOXL1-AS1在89对胃癌组织及癌旁组织中的表达情况
Fig 1 The expression of lncRNA LOXL1-AS1 in 89 pairs of gastric cancer tissues and adjacent tissues
2.2 LOXL1-AS1的表达与胃癌患者的肿瘤病理指标相关性为了明确LOXL1-AS1在胃癌发生和发展中的作用和相关影响因素,继而分析89例患者LOXL1-AS1表达与其各肿瘤病理指标的相关性(见表1)。χ2检验提示,肿瘤组织中LOXL1-AS1高表达与胃癌患者的肿瘤直径增加(P=0.0165)、局部淋巴结转移(P=0.0065)、远处转移阳性(P=0.0084)和TNM分期增加(P=0.0041)密切相关,但与年龄、性别、腹膜转移、肿瘤分化程度等无相关性(P>0.05),提示LOXL1-AS1可能促进胃癌的发生和转移。
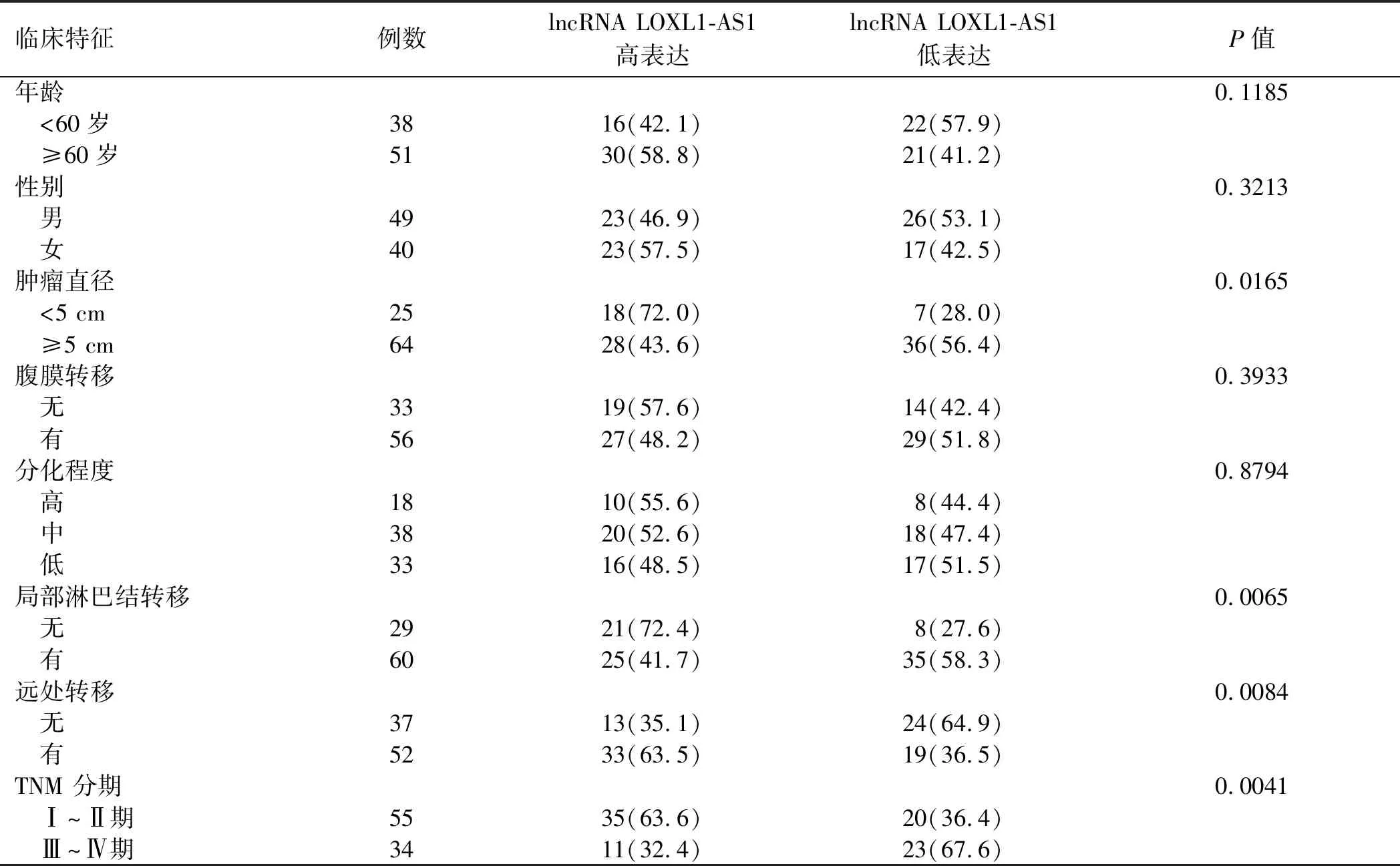
表1 89例胃癌患者临床病理指标与LOXL1-AS1表达水平的相关性 [n(%)]Tab 1 Correlation between clinicopathological parameters and expression of LOXL1-AS1 in 89 gastric cancer patients [n(%)]
2.3 LOXL1-AS1表达量与患者长期预后的关系我们使用Kaplan Meier plotter数据库(http://kmplot.com/analysis/)分析了LOXL1-AS1表达水平与胃癌患者预后的相关性。纳入分析的631例胃癌组织中,455例为高表达组,176例为低表达组。生存分析结果显示,LOXL1-AS1高表达组胃癌患者生存率显著低于LOXL1-AS1低表达组,差异有统计学意义(HR=1.52,95%CI:1.17~1.97,P=0.0014)。表明高水平的LOXL1-AS1与胃癌患者的低总生存时间密切相关(见图2)。
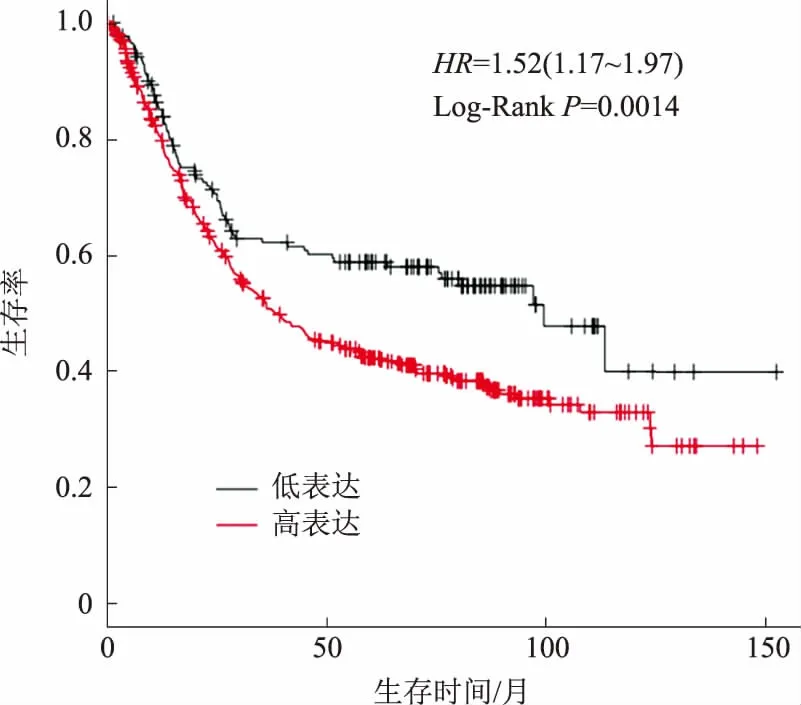
图2 不同LOXL1-AS1表达状态的总生存曲线图Fig 2 The overall survival curves of different LOXL1-AS1 expression states
3 讨论
胃癌的发生、发展是多因素、多基因参与的过程。lncRNA是生物过程中的重要调节剂,可在转录水平、转录后水平、翻译水平等层面调控基因的表达,并通过充当致癌基因或肿瘤抑制因子在肿瘤发生和发展中发挥重要作用。LOXL1-AS1在多种肿瘤中异常表达并影响肿瘤进展。如LOXL1-AS1可调节髓母细胞瘤的增殖,并促进细胞侵袭、转移[14];LOXL1-AS1可促进骨肉瘤细胞增殖、迁移和侵袭[16]。LOXL1-AS1在胃癌中的作用尚不明确,本研究旨在观察LOXL1-AS1在胃癌组织中的表达,并探讨其与胃癌生物学行为和临床病理特征的关系。本研究结果发现,与癌旁组织相比,LOXL1-AS1在胃癌组织中表达显著上调,且其高表达与多项不良临床特征,包括肿瘤直径、局部淋巴结转移、远处转移和TNM分期密切相关。这些结果提示,LOXL1-AS1在胃癌进展中具有重要作用,并可能主要发挥了促癌的作用。
我们进一步利用公开的Kaplan Meier plotter数据库分析了LOXL1-AS1表达水平与胃癌患者预后的相关性。结果发现,LOXL1-AS1高表达组胃癌患者生存率显著低于LOXL1-AS1低表达组患者,差异有统计学意义。表明高水平的LOXL1-AS1与胃癌患者的低总生存时间密切相关,提示LOXL1-AS1表达水平的高低可能预测胃癌患者的预后。
综上所述,本研究发现,LOXL1-AS1在胃癌中的表达水平显著高于癌旁组织,且LOXL1-AS1在胃癌中的高表达与肿瘤直径、局部淋巴结转移、远处转移、TNM分期和患者预后密切相关。LOXL1-AS1可能参与了胃癌发生、发展过程,并可能作为预测胃癌患者预后评估的指标。但其是否可作为评估胃癌患者预后的独立影响因素还需进一步大样本数据研究证实。我们将在细胞和动物模型中进一步探讨LOXL1-AS1在胃癌中的生物学功能。
