三个油菜F1组合小孢子培养及双单倍体结实性分析
2020-05-09万丽丽王转葺杨光圣
万丽丽 王转葺 杨光圣


摘要:为了研究不同油菜(Brassica napus L.)基因型小孢子培养试验中不同浓度秋水仙碱和氟乐林加倍剂对不同基因型材料小孢子再生、加倍率以及成株结实性的影响,选取3个遗传背景不同的F1杂交组合,利用秋水仙碱或氟乐林处理小孢子细胞以及对从小孢子直接再生的植株根系进行秋水仙碱浸泡处理,采用流式细胞仪(FCM)检测不同处理方式下小孢子成苗的倍性水平,并对双单倍体植株开展结实性考察分析。结果表明,3个F1组合的小孢子细胞经过85 mg/L秋水仙碱处理后得到的再生苗数目最多,并且所得到的双单倍体植株的数目最多。不同浓度的氟乐林加倍剂处理试验显示,10 μmol/L氟乐林处理小孢子后获得双单倍体相比其他浓度氟乐林处理后的数目多。3个F1组合的小孢子胚在4 ℃处理10 d后能够显著提高胚的一次成苗率。对3个F1组合的小孢子自然加倍和加倍剂处理后获得的DH群体的结实性考察结果显示,自然加倍获得的双单倍体植株的平均角果长、平均每角果粒数和平均千粒重与不同浓度秋水仙碱或者氟乐林处理后获得的双单倍体无显著差异。
关键词:油菜(Brassica napus L.);小孢子培养;秋水仙碱;氟乐林;倍性分析;结实性
中图分类号:S565.4 文献标识码:A
文章编号:0439-8114(2020)01-0032-07
DOI:10.14088/j.cnki.issn0439-8114.2020.01.007 开放科学(资源服务)标识码(OSID):
Abstract: To investigate the ploidy levels of microspore-derived plants and effect of colchicine and trifluralin treatment on regeneration, double haploid, and seed setting of regenerated plants in oilseed rape (Brassica napus L.), the effects of microspore culture treatment with antimitotic agents colchicine and trifluralin on the frequency of embryo formation, embryo development, plant regeneration and diploidization rate in three F1 hybrids of rapeseed cultivars were compared, and the ploidy levels of young plantlets were measured by flow-cytometry (FCM). The results indicated three F1 combinations obtained the most number of regenerated plantlets after treatment with 85 mg/L colchicine. The mean rates of DH plants from colchicine(85 mg/L) were higher than the other colchicine concentration, and maximum DH plants were derived from the trifluralin treatment(10 μmol/L). After 4 ℃ cold treatment with embryos derived from three F1 hybrid combination for 10 days, the number of embryos to plants conversion (EPC) was significantly increased. The fruity characters of DH population obtained by natural doubling and doubling agent of three F1 combinations were investigated, and the results showed that the average pod length,pod number and 1 000-grain weight of double haploid plants treated from antimitotic agents was similar to the spontaneous double haploid plants.
Key words: rapeseed (Brassica napus L.); microspore culture; colchicine; trifluralin; ploidy analysis; seed setting characters
小孢子培養是将油菜单核晚期至二核早期的花粉进行培养,促进细胞分裂和形成单倍体胚,进而诱导发育成单倍体植株的过程。这种单倍体植株经过加倍剂处理后,形成完全基因型纯合的二倍体植株,也就是双单倍体(Double haploid,DH)。利用游离的小孢子培养获得单倍体的优势在于:小孢子培养通过胚发生途径发育成单倍体,避免了花药壁、花丝,药室隔等体细胞组织再生愈伤组织的干扰,降低了因孢子体变异而引起的农艺性状的退化;一般植物的花药中能够分离出1.5万~2.0万个小孢子,培养过程具有周期短、加倍剂处理能够达到一致性等优点。小孢子培养技术受到育种家们的广泛关注,截至目前,在芸薹属植物的6个种(Brassica napus、Brassica carinata、Brassica juncea、Brassica campestris、Brassica nigra、Brassica oleracea)中均已经成功应用[1]。
自从1982年德国的Lichter[2]首次报道从甘蓝型油菜中成功分离得到游离的小孢子后,利用小孢子培养诱导单倍体继而加倍获得双单倍体取得了显著成就。在遗传学和分子生物学研究中,利用小孢子培养建立的DH群体被用于油菜重要农艺性状的遗传图谱构建以及重要性状QTLs定位[3]。DH群体在定位数量性状基因中最突出的优点表现在两个方面,一是DH群体中每个株系的基因型高度纯合,通过种子扩繁得到的株系可设置不同的重复小区,消除环境因素造成的变异;二是由于基因型纯合,排除可能存在的超显性和低显性效应,能够对每个QTL评估更加简单和精准。在育种实践中,小孢子培养技术被用于新品种选育、种质资源创建以及加速育种进程。此外,利用小孢子培养所得胚数量多、再生能力强等,应用到转基因试验中能够快速获得纯合转基因材料。为了提高油菜小孢子培养获得双单倍体的成功率,学者们对不同基因型来源的油菜材料中调控胚发生率、胚再生能力、加倍能力等方面进行了研究,如供体植株的生长环境、小孢子发育阶段、小孢子预处理类型、诱导培养基的组成成分以及再生培养基成分都会影响小孢子再生[4,5]。胁迫预处理如冷胁迫和热胁迫处理小孢子能够影响小孢子胚再生过程[6-8]。在培养基中添加2,4-油菜素内酯、硝酸银、活性炭以及博莱霉素到培养基中能够促进小孢子胚的发生[9-11]。在油菜小孢子培养试验中,小孢子直接再生成植株而不经历愈伤组织脱分化的过程再生成苗,能够极大程度加速DH系构建进程。
研究发现有一些外源因素影响着植株的再生,如赤霉素、脱落酸、组织培养的温度、培养基的渗透压、小孢子干燥的程度、小孢子的成熟度等都决定着再生能力[12-14]。对胚进行预处理,如低温、ABA以及干燥处理能够增加一次成苗能力,将胚放置在隔着滤纸的琼脂培养基上或者在高浓度卡拉胶培养基上能够有效提高小孢子胚再生能力[15-21]。理想的情况下,小孢子细胞直接加倍后再生得到的植株是基因型纯合的双单倍体。目前在芸薹属植物中天然加倍的机理还未被揭示[22,23]。天然加倍率和种质资源的基因型密切相关,如天然加倍率高的基因型植株在加倍剂处理下未必能够提高加倍率。而对于天然加倍率低的植株进行外源添加加倍剂处理以提升加倍率是十分必要的[24]。加倍剂种类包括叠氮化钠、微管抑制剂如氟乐林、甲酰氨草磷(APM)、秋水仙碱等应用到植物的加倍试验中,结果显示使用最为广泛的化学加倍剂是秋水仙碱,它能够有效地抑制有丝分裂时纺锤丝的形成,阻止染色体的分离,最终导致加倍[25,26]。本研究对3个不同遗传背景来源的F1组合通过小孢子培养构建了DH群体,比较分析了天然加倍、分别施加不同浓度的加倍剂(秋水仙碱或者氟乐林)以及对单倍体油菜0.1%秋水仙碱浸泡根系处理后的出胚率、成苗率、植物倍性,并考察了4 ℃处理3个F1组合基因型材料小孢子胚后一次成苗率以及双单倍体植株成熟后的结实性状,得出不同基因型材料在加倍剂以及低温处理后的出胚、苗再生、染色体加倍、双单倍体植株角果成熟等性状,以期建立提高油菜小孢子培养加倍率和一次成苗率的实验技术体系。
1 材料与方法
1.1 材料
供试材料为6R×ZS11、7DH×ZS11、ZR×R11共3个油菜杂交F1组合,每个组合田间各种植50个单株。
1.2 方法
1.2.1 油菜小孢子培养以及加倍试验 油菜小孢子培养试验程序参考Lichter[2]的方法进行。分离得到的小孢子分别添加不同终浓度的秋水仙碱(50、85、125 mg/L)和氟乐林(5、10、15 μmol/L)。将悬浮小孢子的密度调整为104个/mL,10 mL悬浮培养的小孢子在直径为90 mm的培养皿中32 ℃暗培养24 h,每个处理设置3个重复。不施加加倍剂的处理作为天然加倍试验。培养后的小孢子用新鲜的NLN培养基重悬置于25 ℃暗环境静置培养。3周之后,观察出现至少2 mm长度的鱼雷型和子叶型胚后进行计数,转移到转速为70 r/min摇床上培养,直到子叶胚长度为4 mm转移到固体B5培养基上生长,培养温度保持在22 ℃,16 h光照/8 h黑暗,光量子通量密度为300 μmol/(m2·s)。经过4~6周培养,再生的植株转移到新鲜的固体B5培养基中直至生根。將生根的植株移栽到盛有营养土的穴盘中生长。对于体外加倍试验,配制0.1%的秋水仙碱对前期小孢子培养试验中未加入秋水仙碱再生得到的植株浸根处理8 h,之后转移至自来水中浸泡1 h,移栽到盛有营养土的穴盘中。
1.2.2 3个不同油菜组合小孢子胚再生成苗能力分析 选取3个不同油菜F1组合经过小孢子培养获得的4~7 mm的胚转移到B5固体培养基中,分别在4 ℃环境下冷处理5、10 d,与未进行低温处理的相同大小胚相比较,统计胚直接转化成植株、胚形成次生胚后转化成植株以及胚形成愈伤组织后再脱分化形成植株的数目,分析不同时间的低温处理对一次成苗的作用。
1.2.3 倍性测定 取供试材料的新鲜嫩叶约50 mg放入1 mL裂解液的培养皿中,用刀片切碎、过滤、收集滤液,在离心机中1 100 r/min离心6~10 min后,倒掉上清液,向沉淀物中加入200 μL碘化丙啶(PI)染色液(50 μg/mL),置于4 ℃冰箱中黑暗处理20 min,利用流式细胞仪(FCM)对其进行检测。检测试验中,先用普通单倍体油菜调整流式细胞仪,使得对照材料的主峰位于荧光强度为100附近,根据检测图,荧光强度为50、150、200附近的峰显示的细胞核相对DNA含量分别为荧光强度为100的0.5、1.5、2.0倍。以已经确定了染色体倍性的单株即位于荧光强度为100和200的材料作为对照,对其余供试材料进行流式细胞仪检测。
1.2.4 DH群体结实性状的考察分析 植株开花以后根据雄蕊的发育特征考察植株的单倍体、二倍体、四倍体或者非整倍体或者嵌合体类型,对单株自由授粉,待植株成熟之后按照单株考察角果长度、每角粒数和千粒重等结角果性状。
2 结果与分析
2.1 不同基因型材料在不同处理下小孢子胚发生率和成苗率分析
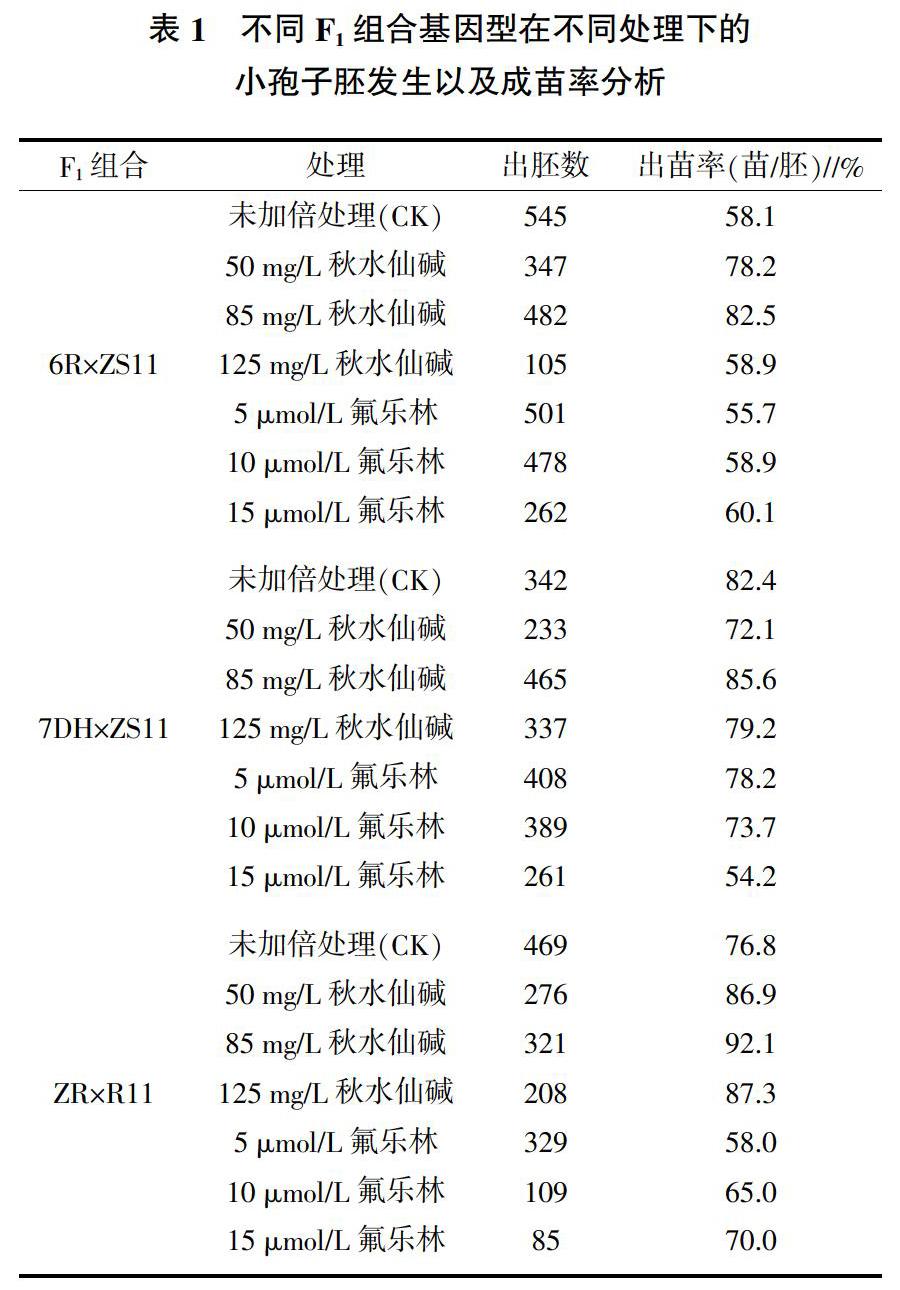
对种植在田间的6R×ZS11、7DH×ZS11、ZR×R11共3个不同F1组合基因型的材料取长度3.0~4.5 cm的花蕾,利用B5液体培养基抽提和收集小孢子细胞,之后对收集的小孢子分别进行不加入加倍剂和加入不同浓度秋水仙碱(50、85、125 mg/L)、氟乐林(5、10、15 μmol/L)处理,每种方法处理200个花蕾的小孢子细胞。经过胚状体诱导出苗、植株再生等多次继代培养,最终获得再生植株移栽田间。表1是3个F1组合从小孢子培养至出苗的全过程统计总结。其中,F1组合6R×ZS11和ZR×R11的未加倍处理的出胚数最多,组合7DH×ZS11的85 mg/L秋水仙碱处理出胚数最多。3个F1组合材料的小孢子在85 mg/L秋水仙碱处理后的胚再生成苗的比例最高。
2.2 3个F1组合小孢子培养所得再生植株的倍性测定与分析
小孢子培养后代群体是不同染色体倍性的混合,除了未加倍的单倍体,还有天然加倍或者加倍剂处理后产生的正常双单倍体、四倍体以及非整倍体或者嵌合体。利用流式细胞仪可测定植株细胞内核酸含量,确定被检测单株的倍性水平等,如果所示峰值位于荧光强度为100左右的被测样品为二倍体,位于荧光强度为50、200的分别为单倍体和四倍体,非整倍体可能是单倍体染色体的消除,所以在图示中为荧光强度50的位置,而分离峰纵坐标达到2 000(图1)。对用流式细胞仪初步测定的50株单倍体油菜进行0.1%秋水仙碱浸泡根系处理试验。接下来利用流式细胞仪对3个经过未加倍处理、不同浓度加倍剂处理小孢子培养的F1组合以及秋水仙碱浸根处理后获得的植株进行倍性分析,结果见表2和图2。由图2可知,F1组合6R×ZS11中有31.27%植株为双单倍体,组合7DH×ZS11中有49.60%植株为双单倍体,组合ZR×R11中有52.00%植株为双单倍体。不同秋水仙碱浓度处理试验结果显示,85 mg/L秋水仙碱处理小孢子后获得的双单倍体植株比例最高。不同浓度的氟乐林加倍剂处理试验显示,10 μmol/L氟乐林处理小孢子后获得双单倍体比例较高。在3个不同F1组合基因型的小孢子培养试验中,秋水仙碱处理后获得的双单倍体的植株数高于氟乐林处理后的双单倍体数目,表明秋水仙碱在油菜小孢子阶段处理能够获得双单倍体的能力高于氟乐林加倍剂的处理作用。此外比较了3个F1组合中50个单倍体在0.1%秋水仙碱浸根处理后的加倍率,结果显示,F1组合6R×ZS11加倍率最高,为42%,组合7DH×ZS11为26%,组合ZR×R11为22%,表明不同基因型材料在浸根过程中对0.1%秋水仙碱处理的敏感性存在差异。分析3个F1组合小孢子培养过程中天然加倍率,统计分析显示,F1组合6R×ZS11天然加倍获得双单倍体率为23.73%,组合7DH×ZS11为21.35%,组合ZR×R11为25.00%,表明这3个F1组合基因型材料在小孢子培养过程中天然加倍率和基因型关联性不大,加倍率都低于秋水仙碱处理小孢子后再生成植株的加倍率,与氟乐林处理小孢子后再生植株的加倍率差异不大。总之,85 mg/L秋水仙碱处理上述3个F1杂交组合材料小孢子得到的双单倍体比例最高,效果优于天然加倍处理、不同浓度氟乐林处理以及浸泡单倍体油菜根系获得双单倍体的方法。
2.3 不同基因型材料小孢子培养的胚在低温处理条件下一次成苗率分析
将3个F1组合材料经过小孢子培养后成胚,选取长度为4~7 mm的胚从NLN液体培养基中转移到B5固体培养基后,置于4 ℃分别处理5 d和10 d,之后置于25 ℃培养室16 h光照、8 h黑暗培养4周,统计成苗情况。结果(表3)显示,与未经过低温处理的胚相比,4 ℃处理10 d后,3个F1组合的小孢子胚一次成苗率最高,并且达显著水平;而小孢子胚形成次生胚进一步再成苗或者分化为愈伤组织后脱分化成苗的比率显著降低。由此可知,3个F1组合材料的小孢子胚在4 ℃处理10 d后能够显著提高胚的一次成苗率,降低胚分化成次生胚再形成植株的比率,极大程度上缩短了胚形成植株的生长过程。
2.4 不同基因型再生植株经过染色体加倍获得的双单倍体的结实性考察与分析
为了确定加倍剂秋水仙碱和氟乐林在油菜小孢子培养获得的双单倍体植株是否会对结荚和油菜子粒的发育存在影响,本试验中对供试的3个F1组合经自然加倍和加倍剂处理后获得的DH群体的结实性进行考察和比較。结果(表4)显示,F1组合6R×ZS11、7DH×ZS11以及7DH×ZS11小孢子培养后自然加倍获得双单倍体植株平均角果长、平均每角果粒数和平均千粒重与不同浓度秋水仙碱以及氟乐林加倍剂处理后获得的双单倍体无显著差异。秋水仙碱和氟乐林这两类加倍剂处理这3种不同基因型材料的小孢子细胞所得到的双单倍体以及秋水仙碱浸泡根系加倍获得的双单倍体能够正常结实,与天然加倍获得的植株无显著差异。
3 讨论
3.1 小孢子胚发生能力的影响因素
油菜小孢子培养试验中胚发生能力受到很多因素影响。供体植株的生长环境是决定小孢子是否能够通过孢子体发育阶段的重要因素,供体植株的基因型决定了小孢子是否具备胚细胞发生能力。前人研究在19个不同基因型的甘蓝中有15个基因型材料每100个花蕾的成胚能力为0~3 000不等[1]。在本试验中不同基因型的小孢子胚发生能力存在差异。F1组合6R×ZS11、ZR×R11在85 mg/L秋水仙碱处理所得到的出胚数最高,随着秋水仙碱处理浓度进一步提高,出胚率下降。在加倍剂氟乐林处理下发现,随着氟乐林浓度的增加,出胚率降低。在F1组合7DH×ZS11处理后可见,在85 mg/L秋水仙碱以及低浓度氟乐林(5 μmol/L)处理下的出胚数目高于未加倍处理小孢子细胞的出胚数目。对小孢子的胁迫处理如低温和高温,能够使得小孢子从配子体发育途径向孢子体发育途径转变,提高小孢子形成胚的能力。对抽提的小孢子细胞进行32 ℃黑暗处理24 h能够有效提高小孢子发育成胚的能力,可能是热激能够影响染色体微管的分布导致小孢子的对称性分裂,从而阻止了小孢子细胞向配子体发育途径,直接进行雄性单性生殖阶段。不同基因型对热处理的反应存在差异,单一因素的胁迫处理并不能适用于所有基因型材料,需要根据不同基因型对热胁迫温度以及时间的敏感性来进一步优化处理方式。
3.2 不同類型以及浓度的加倍剂对小孢子胚再生的影响
有效的染色体加倍是创建大量DH系的关键,本试验3个F1组合的天然加倍率均低于50%,表明3个组合在小孢子培养过程中只有少数的细胞在细胞分裂的早期进行了细胞核融合途径(C途径),相比前人研究中发现甘蓝型油菜天然加倍率高达70%的结果有着较大的差距[25],这可能是不同基因调控网络途径决定不同遗传来源材料的细胞核融合过程,最终决定了加倍率。前人研究认为对油菜小孢子进行不同浓度加倍剂处理能够影响小孢子胚的发生途径。加倍剂黄草消和氟乐林施加后会延迟胚的发育,进一步影响胚的直接再生以及成苗过程[26]。不同加倍剂如秋水仙碱以及氟乐林在小孢子培养时期的加入对小孢子生长产生不同程度的胁迫,这类胁迫能够阻止小孢子向配子体发育阶段进行,转而获得胚性再生能力。在培养过程中由于抽提和纯化小孢子细胞会诱导小孢子的活性氧反应(ROS),高浓度的ROS会促进小孢子进行细胞程序性死亡(PCD)过程,在加倍剂处理后及时更新小孢子细胞培养基能够清除ROS反应后的代谢物,保证小孢子的活力,有效降低小孢子细胞的死亡率。
3.3 低温处理小孢子胚对一次成苗的作用
前人研究得出在水稻、玉米、小麦和大麦等作物中低温预处理小孢子能够提高小孢子雄性单性生殖的能力[27]。此外冷处理能够提高小孢子胚再生能力,促使子叶胚的正常生长。通过冷处理胚能够增加胚萌发率高达90%,促进58.46%的油菜生长[28]。本试验通过对4~7 mm小孢子胚进行冷处理10 d能够显著提高小孢子胚再生成植株的能力。这可能是由于冷处理降低了小孢子再生反应中超氧化物酶活力,极大地加速了呼吸速率和热量产生,从而减少了次生代谢物质的产生,最终避免了细胞的脱分化。
参考文献:
[1] FERRIE A M R,CASWELL K L. Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production[J].Plant cell tissue & organ culture,2011,104(3):301-309.
[2] LICHTER R. Induction of haploid plants from isolated pollen of Brassica napus L.[J].Zeitschrift für pflanzenphysiologie,1982, 105(5):427-434.
[3] PINK D,BAILY L,MCCLEMENT S,et al. Double haploids,markers and QTL analysis invegetable Brassicas[J].Euphytica,2008,164(2):509-514.
[4] FERRIE A. Microspore culture of Brassica species[A].MALUSZYNS
KI M,KASHA K J,FORSTER B P,et al. Doubled haploid production in crop plants[M].New York:Springer science business media,LLC,2003.205-215.
[5] FERRIE A M R,M LLERS C. Haploids and doubled haploids in Brassica spp. for genetic and genomic research[J].Plant cell tissue organ culture,2011,104(3):375-386.
[6] SATO S,KATOH N,IWAI S,et al. Effect of low temperature pretreatment of buds or inflorescence on isolated microspore culture in Brassica rapa(syn B. campestris)[J].Breeding science,2002,52(1):23-26.
[7] GU H H,ZHOU W J,HAGBERG P. High frequency spontaneous production of doubled haploid plants in microspore cultures of Brassica rapa ssp. Chinensis[J].Euphytica,2003,134(3):239-245.
[8] WANG T T,LI H X,ZHANG J H,et al. Initiation and development ofmicrospore embryogenesis in recalcitrant perple flowering stalk (Brassica campestris ssp. Chinesis var. purpurea Hort.)[J].Sci Hort,2009,121(4):419-424.
[9] FERRIE A M R,DIRPAUL J,KRISHNA P,et al. Effects of brassinosteroids on microspore embryogenesis in Brassica species[J].In Vitro Cell Dev Biol,2005,41(6):742-745.
[10] PREM D,GUPTA K,GAUTAM S,et al. Activated charcoal induced high frequency microspore embryogenesis and efficient doubled haploid production in Brassica juncea[J].Plant cell tissue and organ culture,2008,93(3):269-282.
[11] ZENG X,WEN J,WAN Z,et al. Effects of bleomycin on microspore embryogenesis in Brassica napus and detection of somaclonal variation using AFLP molecular marker[J].Plant cell tissue and organ culture,2010,101(1):23-29.
[12] WEI Z. Effects of colchicine with heat shock and cold induction on plant regeneration from microspore-derived embryos in Brassica napus[J].Acta agronomica sinica,2002,28(3):369-373.
[13] ZHANG G Q,ZHANG D Q,TANG G X,et al. Plant development from microspore-derived embryos in oilseed rape as affected by chilling,desiccation and cotyledon excision[J].Biologia plantarum,2006,50(2):180-186.
[14] HUANG B,BIRD S,KEMBLE R,et al. Plant regeneration from microspore-derived embryos of Brassica napus:Effect of embryo age,culture temperature,osmotic pressure,and abscisis acid[J].In Vitro Cell Dev Biol,1991,27P(1):28-31.
[15] KOTT L,BEVERSDORF W D. Enhanced plant regeneration from microspore-derived embryos of Brassica napus by chilling,partial dessication and age selection[J].Plant cell tissue and organ culture,1990,3:187-192.
[16] ORR W,JOHNSONFLANAGAN A M,KELLER W A,et al. Induction of freezing tolerance in microspore-derived embryos of winter Brassica napus[J].Plant cell reports,1990,8(10):579-581.
[17] WAKUI K,TAKAHATA Y,KAIZUMA N. Effect of abscisic acid and high osmoticum concentration on theinduction of desiccation tolerance in microspore-derived embryos of Chinese cabbage(Brassica campestris L.)[J].Japanese journal of breeding,1994,44(1):29-34.
[18] XU L,NAJEEB U,TANG G X,et al. Haploid and doubled haploid technology[J].Advances in botanical research,2007, 45(7):181-216.
[19] TAKAHATA Y,KELLER W A. High frequency embryogenesis and plant regeneration in isolated microspore culture of Brassica oleracea L.[J].Plant science,1991,74(2):235-242.
[20] TAKAHASHI Y,YOKOI S,TAKAHATA Y. Effects of genotypes and culture conditions on microspore embryogenesis and plant regeneration in several subspecies of Brassica rapa L.[J].Plant biotechnology reports,2012,6(4):297-304.
[21] BHATIA R,DEY S S,SOOD S,et al. Optimizing protocol for efficient microspore embryogenesis and doubled haploid development in different maturity groups of cauliflower (B. oleracea var. botrytis L.) in India[J].Euphytica,2016,212(3):439-454.
[22] KASHA K J. Chromosome doubling and recovery of doubled haploid plants[A].DON PALMER C E,KELLER W A,KASHA K J. Haploids in crop improvement II[M].Berlin:Springer,2005.123-152.
[23] KASHA K J,HU T C,ORO R,et al. Nuclear fusion leads to chromosome doubling during mannitol pretreatment of barley (Hordeum vulgare L.) microspores[J].J. Exp Bot,2001,52(359):1227-1238.
[24] DA SILVA DIAS J C. Effect of incubation temperature regimes and culture medium on broccoli microspore culture embryogenesis[J].Euphytica,2011,119(3):389-394.
[25] KL?魱MA M,VYVADILOV?魣,KUCERA V. Chromosome doubling effects of selected antimitotic agents in Brassica napus microspores culture[J].Czech journal of genetics and plant breeding,2008,44(1):30-36.
[26] WEBER S,?譈NKER F,FRIEDT W. Improved doubled haploid production protocol for Brassica napus using microspore colchicine treatment in vitro and ploidy determination by flow cytometry[J].Plant breeding,2005,124(5):511-513.
[27] UR I,DUBAS E,GOLEMIEC E,et al. Stress-related variation in antioxidative enzymes activity and cell metabolism efficiency associated with embryogenesis induction in isolated microspore culture of triticale(x Triticosecale Wittm.)[J].Plant cell reports,2009,28(8):1279-1287.
[28] ZHANG G Q,HE Y,TANG G X,et al. Genetic analyses of agronomic and seed quality traits of doubled haploid population in Brassica napus through microspore culture[J].Euphytica,2006,149(1-2):169-177.
