粪菌移植对溃疡性结肠炎小鼠的抗炎作用及可能机制▲
2020-05-08梁赵良吕晓丹刘耿峰王慧琴谷光丽李世权谢彦飞覃立锋詹灵凌吕小平
梁赵良 吕晓丹 刘耿峰 王慧琴 卢 飞 谷光丽 李世权 金 卉 谢彦飞 陈 兰 覃立锋 詹灵凌 吕小平
(广西医科大学第一附属医院消化内科,南宁市 530021,电子邮箱:744982276@qq.com)
溃疡性结肠炎(ulcerative colitis,UC)主要表现为直肠和结肠黏膜慢性炎症,呈连续性分布,发病机制可能是遗传易感个体肠道菌群失衡导致黏膜免疫系统的异常激活[1]。粪菌移植是一种新型的微生物治疗方法,其对复发的梭状芽胞杆菌感染有明显疗效[2],但对UC的疗效尚不明确。使用2-4-6三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)建立小鼠炎症性肠病模型是应用较为广泛的一种实验方法[3]。本实验采用TNBS建立UC小鼠模型,探讨粪菌移植对UC小鼠肠黏膜炎症的改善作用,以及对脾脏中滤泡辅助性T细胞(follicular helper T cell,Tfr)及滤泡调节性T细胞(follicular regulatory T cell,Tfh)水平的影响,为粪菌移植治疗UC提供理论依据。
1 材料与方法
1.1 实验动物 健康雌性C57BL/6小鼠45只,9~12周龄,体质量40~45g,购自广西医科大学实验动物中心(生产许可证 SCXK桂2014-0002;使用许可证 SYXK桂2014-0003)。小鼠饲养在无特定病原体级别饲养间,适应性喂养3 d,室内温度20℃~22℃,湿度50%,明暗交替12 h/周期,所有操作的试剂及器械均经过紫外灯照射消毒。
1.2 主要试剂及仪器 TNBS 购自Sigma公司;淋巴细胞分离液购自北京索莱宝公司;流式细胞术荧光标记抗体均购自美国BD公司,包括异硫氰酸荧光素(fluorescein isothiocyante,FITC)标记小鼠抗CD4抗体(批号:ab183685)、PerCP-CyTN5.5 标记大鼠抗小鼠CXCR5抗体(批号:ab551959)、别藻蓝蛋白(allophycocyanin,APC)标记仓鼠抗小鼠PD-1抗体(批号:NBP1-77277)、藻红蛋白(phycoerythrin,PE) 标记大鼠抗小鼠Foxp3抗体及对应的同型对照抗体(批号:ab54501、ab210233、ab133706、ab18473、ab553930)。冷冻离心机购自德国Eppendorf公司;流式细胞仪购自美国BD公司;石蜡切片机及病理图像分析仪购自日本Olympus公司。
1.3 动物分组及建立UC模型 将45只小鼠按随机数字表法分为对照组、模型组、干预组各15只。对照组予一次性结肠灌注0.9%氯化钠溶液0.4 mL,模型组及干预组参照相关文献[4-5]制备UC小鼠模型。建模主要步骤:适应性喂养3 d,小鼠于造模前禁食24 h,给予4%水合氯醛按40 mg/kg腹腔注射麻醉后,由肛门插入直径2 mm聚乙烯灌肠管至肠道内约6 cm,一次性结肠灌注100 mg/kg TNBS灌肠液(溶于50%乙醇溶液)0.4 mL,提起小鼠尾部倒立3 min,麻醉苏醒放回笼内常规饲养。
1.4 粪菌移植干预 参照粪菌移植标准[6],造模后第2天开始对干预组进行粪菌移植:(1)收集对照组小鼠新鲜粪便到无菌试管中并称重,加入无菌0.9%氯化钠溶液震荡混匀制成400 mg/mL浓度的粪菌液。(2)腹腔注射4%水合氯醛0.3 mL麻醉后,将小鼠倒悬位,将灌肠管经肛门插入至肠道内约6 cm,注入新鲜粪菌液(mL)=[小鼠体质量(mg)×1/500]÷400(mg/mL),20 g小鼠则注入0.1 mL新鲜粪菌液,灌肠后将小鼠倒立悬挂1 min,1次/d,共7次。模型组及对照组小鼠给予等体积无菌0.9%氯化钠溶液灌肠,1次/d,共7次。
1.5 小鼠一般情况的观察 采用UC疾病活动指数(disease activity index,DAI)[7]对造模过程中各组小鼠每天的一般情况进行评价,DAI=(体重下降分数+大便性状分数+血便程度分数)/3。DAI评分方法见表1。

表1 DAI评分标准
注:*正常指成形大便;松散指不黏附于肛门的糊状、半成形大便;稀烂便指可黏附于肛门的稀烂水样便。
1.6 标本收集 干预后第8天,颈椎脱臼法处死小鼠,取出脾脏及结肠,用无菌冰0.9%氯化钠溶液反复冲洗干净。脾脏组织剪去附着脂肪,放入磷酸缓冲盐溶液中备用。结肠纵行切开,模型组和干预组小鼠以出现溃疡部位为中心用清洁的眼科剪剪取直径约1 cm结肠组织数块,对照组小鼠参照模型组溃疡肠段对应部位剪取,置入4%多聚甲醛溶液固定。
1.7 小鼠结肠组织病理变化观察 (1) 取小鼠结肠标本,评估小鼠结肠黏膜大体形态损伤指数(colon mucosal damage index,CMDI),评分标准见表2。(2)取结肠组织制成石蜡切片,行苏木精-伊红(hematoxylin-eosin,HE) 染色,在光学显微镜下观察肠黏膜组织损伤情况,参照Schmidt等[8]的评分标准评价组织损伤情况,见表3。

表2 CMDI评价标准

表3 小鼠结肠黏膜组织损伤评分标准
1.8 小鼠脾脏CD4+CXCR5+PD-1+Tfh和CD4+CXCR5+Foxp3+Tfr的检测 取小鼠新鲜脾脏组织,剪去附着的脂肪,置于200目细胞筛中,加入少量磷酸缓冲盐溶液,在组织表面剪若干创口,挤压过筛,用2 mL磷酸缓冲盐溶液冲洗细胞筛收集细胞悬液,1 200 r/min离心5 min后,磷酸缓冲盐溶液清洗重悬细胞悬液。每个样本分别设置阴性对照管和样本管,标记后样本管中加入150 μL细胞悬液和FITC-CD4抗体、PerCP-CyTN5.5-CXCR5抗体、APC-PD-1抗体(或PE-Foxp3抗体),阴性组加入50 μL细胞悬液及对应的同型对照抗体。悬液和抗体混匀,避光孵育15min。1 200 r/min离心5 min,清洗,2℃~8℃下避光孵育45 min,最后重悬液采用流式细胞仪检测CD4+CXCR5+PD-1+Tfh、CD4+CXCR5+Foxp3+Tfr在CD4+T细胞中的比例。
1.9 统计学分析 采用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组小鼠一般情况比较 对照组小鼠实验期间反应灵敏,饮食活动正常,毛发有光泽,无便血。模型组于造模次日出现懒动、拱背、厌食、体质量下降、粪便隐血阳性,进食和饮水量减少;随着时间推移,模型组小鼠症状逐渐加重,造模第2~7天出现不同程度的肉眼血便。与模型组相比,干预组小鼠自粪便移植的第2天起症状有所好转。3组小鼠实验终点的DAI差异有统计学意义(P<0.05),其中对照组、干预组、模型组的DAI依次升高(均P<0.05),见表4。
2.2 3组小鼠结肠组织病理变化 (1)各组小鼠结肠组织大体形态学观察:对照组小鼠肠黏膜光滑,皱襞纹理清晰,肠壁厚薄均匀,肠黏膜无糜烂及溃疡形成;与对照组比较,模型组小鼠结肠缩短、肠壁增厚、肠管明显扩张,与腹腔内周围组织粘连严重,糜烂、炎性渗出、多灶性浅溃疡形成;干预组小鼠肠壁增厚、肠管增粗改善,黏膜糜烂、溃疡较模型组明显减轻。(2)各组小鼠结肠组织病理组织学观察:对照组小鼠结肠黏膜层单层柱状上皮细胞排列整齐完整,肠腺清晰,可见大量吸收细胞与杯状细胞,形态正常,无炎性细胞浸润,肌层薄厚均匀无异常改变;模型组小鼠结肠炎症主要累及黏膜和黏膜下层,少数可达浆膜层,结肠黏膜不完整,可见多灶性浅溃疡,大部分腺体被破坏,腺体正常结构丧失,排列紊乱,腺腔大多消失,可见大量淋巴细胞、中性粒细胞等炎性细胞浸润;干预组小鼠结肠黏膜炎症程度介于正常对照组和模型组之间。(3)3组的CMDI评分和组织学损伤评分差异均有统计学意义(P<0.05),其中对照组、干预组、模型组的CMDI评分及组织学损伤评分均依次升高(均P<0.05)。见表4及图1、图2。
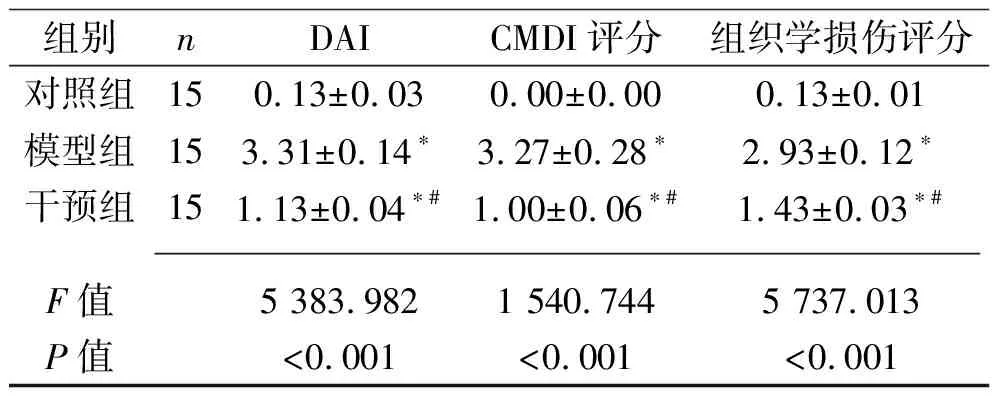
表4 3组小鼠DAI、CMDI评分及组织损伤评分比较(x±s,分)
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
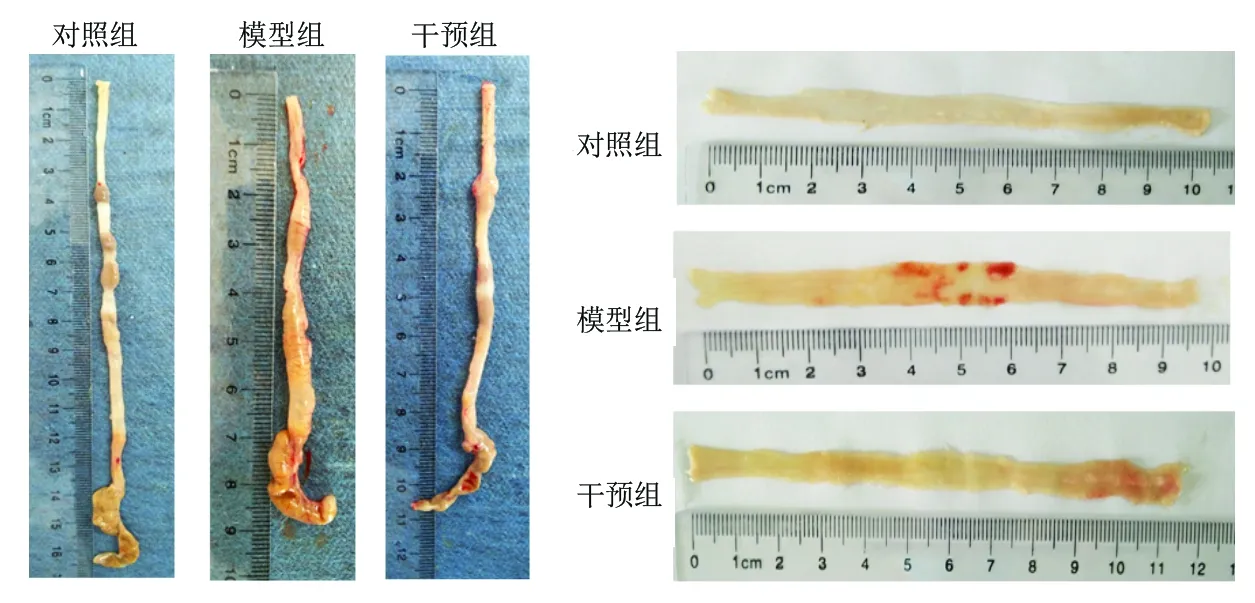
图1 3组小鼠结肠组织大体形态学观察结果
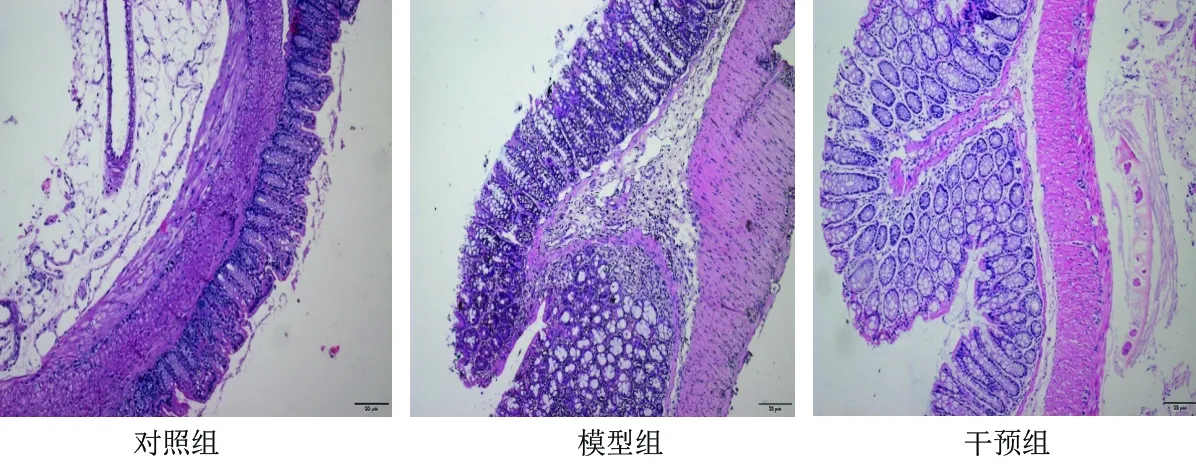
图2 3组小鼠结肠黏膜的镜下病理组织学观察结果(HE染色,×400)
2.3 3组小鼠脾脏组织Tfh和Tfr水平比较 与对照组比较,模型组Tfh及Tfr水平、Tfh/Tfr比值均升高,干预组Tfh及Tfr水平升高,而Tfh/Tfr比值降低(均P<0.05);与模型组比较,干预组Tfr水平升高,而Tfh水平及Tfh/Tfr比值降低(均P<0.05)。见表5。

表5 3组小鼠脾脏Tfh和Tfr水平比较(x±s)
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
3 讨 论
研究表明,UC在世界各地的发病率和患病率呈逐渐升高的趋势,已成为全球性的疾病[9]。UC的传统药物治疗方法包括氨基水杨酸制剂、糖皮质激素、免疫抑制剂、生物制剂等,且需要长期联合用药,并根据疾病类型、病变部位、严重程度、并发症发生情况、药物相互作用和不良反应、患者的经济条件等因素综合制定合理、个性化的治疗方案[10]。目前,传统药物出现对部分UC患者不应答、失效的问题,因此迫切需要新的治疗方案。
近年来,粪便移植治疗炎症性肠病的相关研究报道越来越多。粪菌移植是通过将健康肠道粪便有效地移植入患者消化道来治疗疾病。Bennet等[11]于1989年首次报告1例使用粪便移植成功治愈的严重UC患者。Cui等[12]对16例激素依赖型UC患者进行粪便移植治疗,发现临床症状改善率为57.1%,临床缓解率为28.6%。2017年的一项非对照研究表明,在30例粪便移植治疗UC患者中,有13例(43.3%)在第12周获临床及内镜缓解;在12周随访期间,大多数患者未出现不良事件;在随访终点,9名患者(30%)为无应答者,7例患者(23.3%)出现轻度不良反应,如恶心、呕吐、腹痛、腹泻等[13]。以上研究均表明粪便移植可作为治疗UC的方法之一。本研究结果显示,建模后,模型组及干预组小鼠均出现血便等UC症状,结肠黏膜出现炎症性肠炎的病理改变,且DAI、CDMI、组织学损伤评分均高于对照组(均P<0.05);而干预组小鼠经粪菌移植后症状减轻,以上评分均低于模型组(均P<0.05),这提示粪菌移植可减轻UC小鼠的肠道黏膜炎症,缓解病情。
Tfh和Tfr是CD4+T淋巴细胞新的亚型,主要在淋巴滤泡生发中心分化产生,对平衡机体免疫起重要作用[14]。研究表明,自身免疫性疾病(炎症性肠病、系统性红斑狼疮、重症肌无力等)的发病风险增加与Tfh/Tfr的比例失衡紊乱有关[15]。我们的前期研究结果显示,TNBS诱导的UC小鼠Tfh水平及Tfh/Tfr比例升高,两者可能参与UC的发病过程[16]。Tfh是一类帮助B细胞发育的T细胞,能提高其抗原亲和力,在维持长期体液免疫应答等方面有关键性的作用[17]。Tfr从调节性T细胞分化而来,和Tfh一样表达趋化受体CXCR5,能趋化定位到生发中心调节Tfh的数量,抑制B细胞的分化成熟及抗体生成[18]。本研究结果显示,模型组小鼠脾脏组织CD4+CXCR5+PD-1+Tfh、CD4+CXCR5+Foxp3+Tfr的水平均较对照组升高(P<0.05),且以Tfh升高显著,因此Tfh/Tfr比值升高(P<0.05)。由此可见,模型组小鼠在TNBS诱导下发生抗原抗体免疫反应,Tfh及Tfr均被刺激分化生成,以Tfh升高为主,进一步促进免疫应答。而接受粪菌移植的干预组小鼠脾脏组织细胞CD4+CXCR5+Foxp3+Tfr水平较模型组上升,Tfh水平及Tfh/Tfr比值较模型组有所下降(P<0.05),即接受粪菌移植的小鼠Tfh下调,Tfr升高,由此进一步证实Tfh细胞具有促炎因子作用,而Tfr是UC的保护因子。
Paramsothy等[19]纳入81例UC患者进行随机双盲对照试验,发现在41例粪便移植患者中32例(78%)患者发生不良事件,而在40例使用安慰剂患者中则有33例(83%)发生不良事件,但两组之间的不良事件数量和类型差异无统计学意义。该研究同时进行了粪便标本16S rRNA分析,发现接受粪便菌群移植的患者微生物多样性随粪便菌群移植量增加而增加,并持续存在;一些细菌性分类群与临床结果相关,特别是梭杆菌的存在与临床缺乏缓解有关。此研究启示我们可以通过分析粪便评估肠道相关微生物群的变化,精确定义粪菌移植最佳治疗强度和基于微生物谱的供体-受体匹配的作用制定个性化的治疗方案。
综上所述,粪菌移植可减轻UC小鼠肠道黏膜炎症,其可能的机制为降低促炎症因子Tfh的表达,并促进保护因子Tfr的表达,改善Tfh/Tfr比例,从而抑制炎症进展。
