多学科联合治疗儿童难治性消化道多发息肉的疗效分析
2020-05-08赵红梅湛美正李晓明陈卫坚欧阳红娟刘段佳琪罗艳红张文婷游洁玉
赵红梅 湛美正 李 勇 胡 原 李晓明 陈卫坚 欧阳红娟刘 莉 段佳琪 罗艳红 张文婷 徐 斌 游洁玉
消化道息肉是一种腔道内增生性疾病,由于儿童肠腔小,息肉增长速度快,容易引起肠套叠、肠梗阻等,以往常常需外科手术治疗。随着儿童消化内镜的发展,尤其是小肠镜的应用,几乎解除了胃镜及结肠镜难以到达的盲区,内镜下早期干预可大大降低并发症的发生率。然而,儿童肠腔小,小肠镜进镜困难,成为低龄儿童行小肠镜检的阻碍。有学者提出气囊辅助小肠镜治疗在成人黑斑息肉综合征(Peutz-Jeghers syndrome,PJS)中的安全性好,临床价值高[1]。本研究探讨多学科联合,腹腔镜下辅助小肠镜进镜并行息肉切除在儿童难治性消化道息肉中的临床价值及安全性。
材料与方法
一、一般资料
收集2008年1月1日至2018年12月30日由湖南省儿童医院确诊的21例消化道多发息肉患儿作为研究对象,其中男童14例,女童7例,平均年龄(7±2.1)岁。病因:15例(71.43%)为PJS;1例(4.76%)为家族性多发性腺瘤样息肉;5例(23.81%)为小肠多发息肉。临床表现:反复发生肠套叠16例(76.19%);不完全性肠梗阻5例(23.81%)。所有患儿反复多次行腹部B超、CT检查,提示消化道多发巨大息肉。术前所有患儿由家长签署知情同意书,该研究获得湖南省儿童医院伦理委员会审批。
二、相关定义
1. 难治性消化道息肉临床诊断标准[2]:息肉直径>2 cm,病变位于十二指肠降段以下,横结肠以上,或跨越皱襞、或扁平无蒂广基的息肉。
2. PJS临床诊断标准[3]: ①有2个或2个以上经组织学证实的P-J息肉; ②任何数目的息肉合并PJS家族史; ③典型的皮肤黏膜黑斑表现合并PJS家族史; ④任何数目的P-J息肉合并典型的皮肤黏膜黑斑表现; ⑤STK11胚系突变合并任何数目的P-J息肉或典型的皮肤黏膜黑斑表现。符合其中任何一条均可确诊。每例患儿都进行内镜及组织病理学检查。
3. 巨大息肉定义:直径≥2 cm为巨大息肉[4]。
三、检查设备及过程
小肠镜采用OLYMPUS公司的SIF-Q260型单气囊电子小肠镜。腹腔镜:STORZ-EJ-MLA26CK1;彩色超声型号:Philip EPIC7C ; CT型号为Philips Brilliance 64排CT。B超检查时首先按顺序扫查,必要时适当加压,以驱走肠腔内容物,使肠腔前后壁尽可能靠近,便于发现病变。针对病变要聚焦放大视野,重点观察病变与周围肠管的关系,明确病变起源,避免假阳性。对于儿童而言,小肠CT也具有一定的难度,多层螺旋CT可在最短时间内进行大范围的薄层容积扫描,需要多种图像后期处理技术。多平面重建能够良好显示向肠腔内、外生长的占位性病变结构、轮廓和肿块内部实质密度情况、肿块对肠壁、肠外间隙的浸润及周围淋巴结转移等。
四、手术方法
影像学明确诊断后,先采用小肠镜经口腔/肛门到达小肠(空肠/回肠),若操作者感到进镜困难,无法观察到息肉或息肉全貌,应立即吸尽肠腔内气体。再经腹腔镜从网膜内将肠管牵拉改变方向,利于小肠镜进一步进镜,若能从浆膜层发现息肉增生改变,则可明确息肉位置,协助小肠镜到达目的地。在息肉切除过程中,由于息肉直径较大,无法窥见息肉全貌或蒂时,需要再次在腹腔镜协助下改变肠管位置或方向,以利于息肉的切除,若术中出现穿孔,可第一时间发现,立即在腹腔镜下修补或内镜下钛铗钳闭。
结 果
一、术前情况
术前腹部彩超检查发现16例肠套叠表现为继发性肠套叠,套叠中心可见团块状改变,彩色多普勒可见丰富的血流信号,息肉呈球形、椭圆形或分叶状结节,边界清晰,内部回声不均匀,高低回声相间(图1A)。超声检查发现的96粒息肉中有58粒(60.4%)可测及确切的蒂部结构,表现为息肉与肠壁相连的高回声索带样结构(图1B、图1C),直径0.1~0.6 cm,蒂边缘区域见线样低回声,呈轨道样。根据肠管走行初步判断息肉的位置为:十二指肠或空肠息肉39粒,回肠或高位结肠息肉56粒。

图1 彩色多普勒超声所见小肠息肉
Fig.1 Small intestinal polyps on color Doppler ultrasonography
5例患儿通过小肠CT,多平面重建及仿真内镜检查可清晰见到十二指肠、空肠、回肠、回盲部弥漫分布大小不等类圆形软组织密度结节影,横断面见多个同心圆(图2A),较大结节位于小肠内,4 cm×3.5 cm大小,病灶边界清晰,密度均匀,平扫CT值约13~47 Hu(图2B),增强扫描动脉期CT值约75 Hu,增强扫描中度强化,局部肠管管壁增厚(图2C、图2D)。
二、内镜下检查与治疗情况
21例均在全麻下行联合治疗。本组中十二指肠水平段息肉2例和高位结肠息肉3例,其余均为小肠息肉(图3A~图3C)。所有患儿小肠镜检查经口或经肛进镜检查并行息肉切除,共切除息肉143粒。其中1例患儿单次最多切除巨大息肉13粒,直径最大为5 cm×4.5 cm,均留标本送病理检查(图4A~图B)。术中1例广基巨大息肉(5.5 cm×5 cm)无法内镜下切除转外科手术治疗。
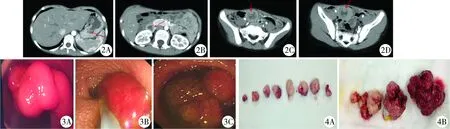
图2 小肠息肉CT下表现图3内镜下息肉图4切除的息肉图片
Fig.2 Small intestinal polyps on CTFig.3 Polyps under endoscopeFig.4 Resected polyps
三、息肉特点
21例共切除息肉143粒,平均7粒/例,其中1例最多单次内镜下切除息肉93粒,腹腔镜辅助下小肠镜下切除13粒,直径5 cm以上的巨大息肉13粒,均留标本送病理检查。息肉分布范围:十二指肠水平段2粒,空肠82粒,回肠57粒,回盲部2粒。形态:长蒂息肉34粒;亚蒂56粒;广基53粒。
四、病理检查结果
错构瘤 8例;幼年型息肉9例;腺瘤性息肉1例;增生性息肉3例,见图5。
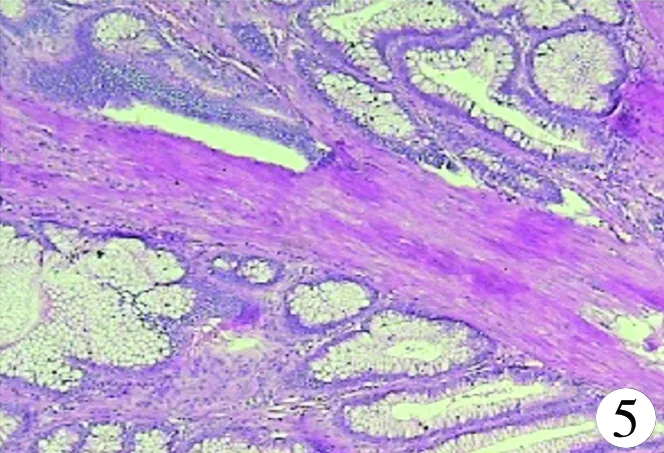
图5 增生性息肉病理图(HE,×100)
五、并发症及随访情况
术中因巨大息肉予钛铗缝合3例,钛铗止血5例,2例术中穿孔较大转腹腔镜下修补术。其余病例手术顺利,无并发症发生。
21例随访1~10年,暂无癌变发生。随访1年息肉再检出率为57.1%(12/21),随访3年息肉再检出率为81%(17/21),随访5年息肉再检出率为90.4%(19/21),其中PJS与家族多发性腺瘤样息肉再检出率为94.7%(18/19)。单纯的小肠息肉2例随访中未再发现息肉。
讨 论
儿童消化道息肉并不少见,它主要是指黏膜隆起、局限性增生并向腔内突出而形成肿物,绝大多数为良性息肉,我国尚无确切的发病率统计[5]。临床上以结肠息肉最多见,其次为胃内息肉,食管、十二指肠以及小肠息肉相对少见。大部分息肉通过胃肠镜或小肠镜可予以切除,但有极少数小肠深部息肉难以在内镜下切除。儿童消化道多发息肉常见病因有PJS、家族腺瘤性息肉等,另有部分不明原因的原发性小肠息肉易导致肠梗阻或肠套叠等,极少数还存在癌变风险[6]。由于息肉的形态、大小及部位不同,肠道深部巨大息肉仍是治疗的难点,且风险高。我们常把位于十二指肠降段以下、小肠以及高位结肠的巨大息肉定义为难治性息肉[7]。本组21例患儿中,息肉主要分布在十二指肠水平段以下,升结肠以上,直径均超过2 cm。
据报道,对于难治性消化道息肉的诊断与治疗,术前影像学检查至关重要,不仅可以指导如何选择治疗方式,而且可减少漏诊和误诊[8]。腹部彩色多普勒超声常作为诊断的首选,它对小儿肠息肉继发肠套叠的诊断准确率高达80%,能准确判断套叠部位及血液供应情况,且无禁忌证,无创伤,无辐射,患儿家长易于接受。也有报道称,经腹部超声检查能够将肠息肉的各项特征清晰呈现出来,可以记录病灶的形状、大小及回声等情况,由专业医师结合上述信息进行临床诊断,能够准确地分析患儿病情,以便尽早给予针对性治疗,将不良影响降至最低[9]。另有报道表明超声检查在实际操作过程中,为确保检查的准确性,可顺着肠管走向展开多个切面的检查,首先用凸阵探头进行检查,然后换到高频探头,并缓慢加压进行检测,可清晰地显示出患儿肠道影像,能准确将深部息肉描述给医生[10]。本组21例患儿中16例(76.1%)经过腹部彩色多普勒超声明确诊断,指导内镜联合治疗,深部息肉清除干净,无远期并发症发生。另有5例因显示不清,选择了CT三维重建观察整个消化道的影像,可发现肠道同心圆改变,多平面重建能够良好显示向肠腔内、外生长的占位性病变结构、轮廓和肿块内部实质密度、肿块对肠壁、肠外间隙的浸润及周围淋巴结转移等。该检查可显示小肠全段的病变满意,且不会给患儿带来痛苦,安全性好,是对肠道较为全面的一种诊断方法。CT检查前对肠道准备要求极高,有一定辐射,故并不作为常规检查项目,尤其对于儿童。有学者认为对于彩色多普勒显像不清晰者,可选择腹部CT来显示肠管内情况,对于肠道改变具有一定诊断价值,尤其是对于手术方式的选择能提供可靠的依据[11]。
儿童肠腔小,消化道巨大息肉更易导致肠套叠及肠梗阻。有报道显示对于巨大息肉需要尽早在内镜下切除,以减少肠套叠的风险。外科手术治疗创伤大,切除太多肠段易引起短肠综合征,多处切开肠管会增加术后肠粘连的风险[12]。而内镜治疗简便,重复性好,但儿童肠腔狭窄,耐受性差,内镜难于到达空肠、回肠更深的部位,对于深部位的巨大息肉,内镜下难以切除,且存在出血和穿孔的风险。借助腹腔镜转动肠道协助进镜,能调整肠管及息肉的方位,利于小肠镜下息肉切除。有文献报道腹腔镜辅助下深部息肉切除术的成功率可达90%以上[13]。这种治疗方法可以避免多次开腹,避免肠切开、切除手术。故腹腔镜与小肠镜的联合治疗将成为难治性消化道息肉切除的重要方式。但也有报道认为小肠镜检查导致肠腔高度充盈后,气腹不能很好形成,不利于腹腔镜操作,所以两镜联合操作需要非常熟练的内镜操作医生与外科医生的多次磨合。虽然本研究中联合手术的成功率较高,但还需要更大样本量进一步总结经验。
消化道多发息肉清除后易复发,甚至有癌变风险,尤其是PJS患儿癌变风险较正常人群高18倍,故术后的随访非常重要。有文献指出对于PJS患儿肠道息肉的监测,MRI和多探头CT检查具有重要价值,即使有息肉被漏诊,其直径大多<1 cm,通常不具有临床意义。小肠镜和视频胶囊内镜在胃肠道息肉监测中具有重要作用,而螺旋内镜和虚拟内镜作为未来的监测方法有一定的应用前景[14]。欧洲儿科胃肠病学、肝病学和营养协会息肉病协作组指出胃镜检查、结肠镜检查和视频胶囊内窥镜检查是评估整个胃肠道的最敏感和最有效的方法,而不推荐小肠镜作为监测手段, 因其在技术上具有挑战性。主要推荐小肠镜作为治疗手段,用于靶向息肉切除术[15]。美国学者建议4~5岁就应接受内镜检查[16]。我国学者建议 6岁左右开始接受内镜检查[17]。而本组患儿内镜监测频率为2~3年/次,随访1~10年暂未发现癌变,对于低龄儿童(最小发病年龄1岁8个月),巨大息肉(息肉最大径约4 cm)患儿,该如何进行内镜监测也有待进一步探讨。
综上所述,消化道难治性息肉中以PJS最为多见,好发部位为小肠,普通胃肠镜难以清除,在影像学的指导下,腹腔镜辅助下小肠镜下切除肠道深部息肉能达到较好的临床效果,安全性高,并发症少,有利于患儿更长时间处于无息肉状态及消除潜在癌变风险,是值得积极推广的联合微创技术,但该技术要求熟练度较高,需要加强基础技术的训练及配合。
