中国淡水水华甲藻一新记录种及其生态风险*
2020-05-08谭好臣王瑗媛李书印刘国祥刘本文
谭好臣,王瑗媛,李书印,张 琪,刘国祥,刘本文
(1:潍坊市峡山水库管理局,潍坊 261325) (2:中国科学院水生生物研究所,武汉 430072)
角藻属(CeratiumSchrank)隶属甲藻门(Dinoflagellates)、甲藻纲(Dinophyceae)、膝沟藻目(Gonyaulacales)、角藻科(Ceratiaceae),为真性浮游物种,广泛分布于海洋和陆表水域. 该属已描述的海洋、淡水种、亚种、变种和变型已达到225个,其中仅有13个是有效的命名[1],目前仅包含4个淡水种[1-2],常见的为飞燕角藻(Ceratiumhirundinella)和拟二叉角藻(C.furcoides). 该属种类通常为单细胞,有时连接为群体. 细胞通常不对称,强烈背腹扁平. 上壳通常具有一个稍向右侧倾斜的大顶角. 在下壳处常有2~3个底角. 横沟位于中央平面,环状或略呈螺旋状. 纵沟没有延伸至上壳. 板片格式为4′(3′), 0a (1a), 6′′, 5-6c, 6′′′, 2′′′′[3].
甲藻是海洋和淡水中重要的浮游生物类群,是形成赤潮和水华的主要类群之一[4]. 淡水甲藻水华多是由多甲藻属(Peridinium)[5-6]和拟多甲藻(Peridiniopsis)种类引起的[7-9],由角藻属种类引起的水华少见报道. 然而近年来,角藻属种类拟二叉角藻在世界各地陆续被发现,在巴西出现尤为频繁,且多在富营养化的水库、鱼塘等水体形成水华[10-18]. 据多篇文献报道,拟二叉角藻具有较高的生长速率、较大的粒径、高效的资源利用能力以及特殊的生活史策略,可抵抗浮游动物的摄食,表现出较强的入侵能力,有不断扩张的趋势[19-23].
迄今为止,该种在中国还未见报道,有关其在国内的分布以及系统发育位置尚不清楚. 本研究从中国多个淡水生境中采集到角藻属种类样本,并鉴定为拟二叉角藻. 该种在国外报道较多,但在中国属首次报道,为中国新纪录种. 本研究的主要目的是对该种进行详细的形态学描述并对其系统发育位置加以确定,以及结合该种的分布特征揭示其可能存在的生态风险.
1 材料和方法
1.1 样品的采集与保存
本研究样本采自中国的多个省市:山东省潍坊市、湖北省仙桃市、四川省成都市、吉林省辉南县.
定性样品采用25#浮游生物网捞取,所获野外新鲜样品一部分加入10%的甘油福尔马林固定保存于中国科学院水生生物研究所淡水藻类标本库中,标本标号见形态学观察部分. 另一部分静置于采样瓶中加入乙醇沉淀数分钟,吸取沉淀保存于90%乙醇中. 具体采集方法参考章宗涉等的方法[24].
1.2 形态学观察
形态学鉴定参考Taylor依据板片格式类型建立的甲藻分类系统[25]. 藻体的显微图像采用Olympus BX53光学显微镜获取,使用微分干涉(differential interference contrast, DIC)、明场(bringt field, BF)以及荧光(epifluorescence microscopy, EFM)模式进行观察. 为了观察板片,福尔马林固定的细胞先用0.1% Fluorescent Brightener 28(Sigma,UK)(紫外激发光为460~490 nm,发射光为520 nm)染色30 min[26].
1.3 单细胞DNA提取
由于甲藻难以培养,本研究参照Ki等[27]基于环境样品的单细胞PCR方法,稍加改进后提取样本的基因组,具体步骤为:吸取约20 μL样品保存液置于凹玻片上,再加入200 μL的无菌双蒸水. 在倒置显微镜(Olympus CKX41, Japan)下用拉细的毛细管挑取少数细胞,转移至滴有无菌双蒸水水滴的凹玻片上. 如此两三次,以清除乙醇和其他杂质. 最后将细胞转移至200 μL PCR管中,加入10 μL矿物油后离心,置于-20℃下保存备用. 向已挑取细胞的PCR管加入2 μL 200 μg/mL的蛋白酶K,离心后55℃温育1 h,95℃下5 min灭活蛋白酶K. 样品置于-20℃下保存备用.
1.4 PCR扩增与产物纯化
用于PCR扩增18S rDNA基因的引物为:4616f, 5′-AACCTGGTTGATCCTGCCAG-3′;4618r, 5′-TGATCCTTCTGCAGGTTCACCTAC-3′[28]. 50 μL的反应体系为:5 μL DNA模板,10×缓冲液5 μL,2 mmol/L的dNTP 5 μL,20 μmol/L的引物各1 μL,Taq酶(TaKaRa ExTaq)1.25U,最后以灭菌双蒸水补足至终体积. PCR反应条件为:94℃预变性5 min,94℃变性50 s,56℃退火50 s,72℃延伸1 min 40 s,35个循环;72℃延伸7 min. 扩增产物经1.0%琼脂糖凝胶电泳后,用平头镊子(使用前煮沸 10 min 处理)在紫外透射台(CUV30A, 上海勤翔)上切割目的条带,用Axygene凝胶回收试剂盒纯化回收纯化PCR产物. 将PCR纯化产物与pMD18-T(TaKaRa)载体连接,转化到E.coliDH5α中,以通用引物(M13)为测序引物送至擎科生物科技有限公司测序.
1.5 系统发育分析
从GenBank数据库下载拟二叉角藻的近缘18S rDNA序列用于系统发育分析. 详细的序列信息见表1,本研究的拟二叉角藻序列信息及登录号用灰色标记.

表1 本研究采用的物种名称及其GenBank登录号
序列矩阵采用Mafft7.2[29]进行比对,经MEGA6.0[30]手工剪切校正后再使用MEGA6.0[30]进行碱基组成分析、碱基转换与颠换的比率分析,采用DAMBE[31]软件进行核苷酸替代饱和分析以判断数据集是否适合条件进行下一步的系统发育分析. 矩阵的最佳核苷酸替代模型采用IQ-TREE 1.6.10[32]内置的ModelFinder软件进行评估. 采用最大似然法(ML)和贝叶斯算法(BI)构建系统发育树. ML树和贝叶斯树分别采用IQ-TREE 1.6.10[32]软件和MrBayes3.1.2[33]软件. 贝叶斯分析运行2000000代,取样频率为1000,分析达到平稳(标准误差<0.01)则运行结束,舍弃前25%的老化样本后对各进化树进行总结. 进化树的查看和编辑采用Figtree 1.4.2 (http://tree.bio.ed. ac.uk/software/figtree/).
1.6 浮游藻类生物量和理化参数测定
计数使用浮游生物计数框. 计数方法采用行格法,每个样品计数2次,每次结果与两次计数平均值之差不大于±15%. 拟二叉甲藻生物量(鲜重)估算时,每个种类测量30个细胞的大小,取平均值依据相应的几何体积公式计算体积[24, 34]. 理化参数和叶绿素a浓度的测定方法参照《水和废水监测分析方法》[35].
2 结果与分析
2.1 形态学观察
拟二叉角藻
Ceratiumfurcoides(Levander) Langhans 1925,ArchivfürProtislenkunde52: 585-602.
Ceratiumhirundinellavar.furcoidesLevander 1894, Acta Soc. Fauna Flora Fenn. 12, Nr. 2, 1-115, T. 1-3.
常见于营养丰富流动性较差的水体中,大量繁殖致使水体呈现黄褐色(图1A). 细胞为窄纺锤形,背腹强烈扁平,叶绿体多数,周生盘状,黄色至褐色,上壳渐尖形成一个大的顶角. 下壳宽、短,具有2(-3)个底角(图1B,C). 横沟轻微螺旋,纵沟不延伸至上壳、较宽(图1B,C). 板片表面具有窝孔纹(图1F). 细胞大小:122~268 μm×32~56 μm.
板片形状和排列:板片格式为3′, 1a, 6′′, 6c, 6′′′, 2′′′′(图1C, D, E). 顶板3块,向上逐渐变窄延伸至顶孔. 前间插板1a短、三角形,没有延伸至顶孔位置. 沟前板6块,四边形或五边形. 横沟板6块. 纵沟板若干块,脆弱容易脱落. 沟后板6块,板片1′′′和2′′′通常形成一根顶角,板片4′′′和5′′′形成另一根底角. 两块底板较大,通常形成一根较大的中-底角(图1C, D, E). 板片具有半保留的复制方式,细胞分裂时,两个子细胞各得到母细胞板片的一半(图1F, G).
国内分布:山东省潍坊市,2018年9月13日采集于峡山水库(标本号SD2018050/051(HBI)). 湖北省仙桃市,2008年3月30日,张琪采集于一小水坑(标本号:HB200802a (HBI);四川省成都市,2010年10月26日,张琪采集于西南财经大学内一水池(标本号SC201001 (HBI)). 吉林省辉南县,2006年8月6日,刘国祥采集于小龙湾.

图1 拟二叉角藻:(A)示生境;(B)单个细胞,示细胞形态;(C)细胞外观手绘图,示左、右两侧板片排列. (D、E)细胞外观荧光显微图,分别示左、右两侧板片排列;(F、G)细胞外观荧光显微图,分别示上、下壳的半保留复制(A=50 cm; B=20 μm; D、E、F、G=10 μm. 符号说明:X′, 顶板; X′′, 沟前板; X′′′, 沟后板, X′′′′, 底板; cX, 横沟板; Xa, 间插板; XS,纵沟板;X为序号)Fig.1 Ceratium furcoides:(A) Ecological habitat;(B) Single cell, showing the cell shape; (C) The hand-drawing of the cell, showing left and right sides view of plate pattern respectively;(D,E) The epifluorescence of the cell, showing left and right sides view of plate pattern respectively; (F,G) The epifluorescence of the cell, showing semiconservative replication of the up and down plate respectively (Scale bars: A=50 cm; B=20 μm; D, E, F, G=10 μm. The legend of symbols: X′, apical plates; X′′, precingular plates; X′′′, postcingular plates; X′′′′, antapical plates; cX, cingular plates; Xa, intercalary plates; XS, sulcal plate; X is serial number)
2.2 序列矩阵分析
该数据矩阵经比对、校正、剪切后,产生一个含有28条序列,长度为1648bp的基因序列矩阵,其中保守位点1089个,变异位点559个,简约信息位点392个,单态位点167个;矩阵中4种碱基(A、T、C和G)的平均含量分别为25.73%、28.00%、19.70%和26.57%. GC含量(46.27%)低于AT含量(53.73%). ModelFinder分析结果表明,该矩阵的最佳模型为GTR+F+R3. 饱和指数分析(Iss=0.1074 < Iss.c=0.7816)显示序列矩阵并未饱和,可用于系统发育分析.
2.3 系统发育分析
基于18S rDNA构建的膝沟藻目的贝叶斯系统发育树(图2)和最大似然树(图3)在拓扑结构有所差异,但均显示膝沟藻目为很好的单系类群,最大似然自展支持值和贝叶斯后验概率分别为98/1.00,角藻科形成两大独立的分支,分别代表新角藻属(Neoceratium)(海洋种类)和角藻属(淡水种类)类群,最大似然自展支持值和贝叶斯后验概率分别为99/1.00,本研究的两株拟二叉角藻位于角藻科的角藻属中,与飞燕角藻具有最近的亲缘关系,最大似然自展支持值和贝叶斯后验概率分别为100/1.00. 多甲藻属(Peridinium)和拟多甲藻属(Peridiniopsis)均为多系.

图2 基于18S rDNA构建的膝沟藻目的贝叶斯系统发育树(节点处显示高于0.5的贝叶斯后验概率. 本研究新加入的序列用灰色标记)Fig.2 Bayesian phylogenetic tree of the order Gonyaulacales constructed by the 18S rDNA sequences (The numbers on the nodes represent the posterior probabilities above 0.50. The newly added sequences in this study were shaded in grey)
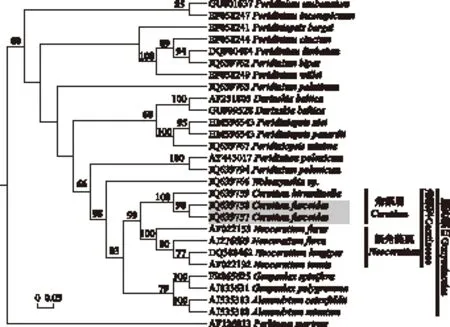
图3 基于18S rDNA构建的膝沟藻目的最大似然系统发育树(节点处显示高于50的最大似然自展支持值. 本研究新加入的序列用灰色标记)Fig.3 ML phylogenetic tree of the order Gonyaulacales constructed by the 18S rDNA sequences (The numbers on the nodes represent the bootstrap support values above 50. The newly added sequences in this study were shaded in grey)
2.4 浮游藻类组成及理化参数
本次采样共监测到峡山水库B位点的浮游藻类41属69种,分属7门,其中蓝藻门10属18种,绿藻门21属30种,硅藻门3属13种,隐藻门1属2种,金藻门1属1种,甲藻门3属3种,裸藻门2属2种. 各种类细胞密度变化范围为0.03×106~30.45×106cells/L,生物量变化范围为0.01~86.31 mg/L. 拟二叉角藻在该位点的密度达1.23×106cells/L,生物量最高值为86.31 mg/L. 各门类藻类细胞密度及生物量所占比例见图4. 此外,该点具有最高的叶绿素a浓度,达125.77 μg/L,氨氮浓度为0.426 mg/L,总氮浓度为4.10 mg/L,总磷浓度为0.05 mg/L,水温为28℃,透明度为0.3 m,电导率为847 μS/cm,pH为 7.9,溶解氧浓度为8.8 mg/L,化学需氧量为14.9 mg/L.

图4 峡山水库B位点浮游藻类种类密度(a)和生物量(b)组成Fig.4 Density (a) and biomass (b) composition of phytoplankton species at site B in Xiashan Reservoir
3 讨论
广义角藻属包括淡水和海洋种类,仅有极少数种类发现于淡水[2]. 借助光学和电子显微镜对淡水和海洋角藻的板片结构进行细致研究后发现,广义角藻属板片格式为 4′, 6′′, 5-6c, 6′′′, 2′′′′,再加上2块或更多块纵沟板片[36]. 海洋角藻种类具有5块横沟板而淡水种类具有6块横沟板[37].
本研究的样本在生境和形态学特征上均与Langhans[38]和Levander[39]描述的飞燕角藻二叉变种(C.hirundinellavar.furcoides)极其相似. Langhans[38]建议将飞燕角藻二叉变种提升到种的地位. 飞燕角藻是全球分布的常见种,该物种显示出相当大的形态差异,因而许多学者常划分出许多变型或变种. 基于种群的研究分析,拟二叉角藻与飞燕角藻非常相似,其最大的区别在于前者仅有3块顶板延伸至顶端,第4块板片没有延伸至顶端成为1块间插板,板片格式为3′, 1a, 6′′, 6c, 6′′′, 2′′′′,而后者具有4块延伸至顶部的顶板,板片格式为4′, 6′′, 6c, 6′′′, 2′′′′[40]. 基于形态学观察结果,本研究将采集的角藻属样本鉴定为拟二叉角藻. 该种在国内属首次报道,为中国新纪录种. 该种为世界性广布种类,文献记载常生活于许多寡-中营养的小型水体中[2]. 我国发现的生境多为中富营养化甚至富营养化的水体,而且均在水温较高的夏、秋季节,与常见的飞燕角藻多见于冬、春低温季节不同. 事实上国外文献也多报道拟二叉角藻更偏向生活在水温较高的季节[41].
基于18S rDNA构建的膝沟藻目的贝叶斯树和最大似然系统发育树显示海洋和淡水角藻种类分别聚在单独的分支中,强烈支持将海洋和淡水角藻种类分成两个不同类群. Logares等认为海洋和淡水种类通常没有紧密的亲缘关系,且多数海洋淡水转变似乎都不是最近发生的[28]. 基于横沟板数目的差异,Gómez等建议将海洋角藻属种类置于单独的新属——新角藻属中且认为横沟板数目是区分新角藻属和狭义角藻属最显著的形态特征[3]. 系统发育研究进一步确认了拟二叉角藻的系统位置,即拟二叉角藻位于膝沟藻目角藻科的角藻属中,与飞燕角藻具有最近的关系. 基于18S rDNA构建的贝叶斯系统发育树和最大似然树尽管在拓扑结构有所差异,这是由于多甲藻属、拟多甲藻属多系性的存在以及甲藻类群有限的分子数据导致的,但在膝沟藻目以及目以下水平的系统发育关系上是稳定且高度一致的.
根据中国环境检测总站2018年发布的全国地表水水质监测报告显示(http://www.cnemc.cn/jcbg/qgdbsszyb/),峡山水库局部时段为Ⅴ类水质,呈现中富营养化状态. 而峡山水库管理局2019年6月的监测数据(理化参数、叶绿素a浓度、藻细胞密度及生物量)显示该水库的水华位点在本次采样中呈现出明显的富营养化状态. 尽管在细胞密度上尖头藻和浮丝藻等一些丝状蓝藻占主要优势,但因拟二叉角藻个体细胞体积较大,在生物量上占绝对优势. 本研究还在中国的东北、华中、西南地区等多个不同程度富营养化位点均采集到拟二叉角藻,说明其分布范围较广,偏好于温度较高的季节、流动性较差的富营养化水体,暴发面积较水华蓝藻小,通常只在水体局部位置形成. 这与国外文献报道的拟二叉角藻更偏向生活在较高水温季节的结论一致[41]. 拟二叉角藻与众多水华蓝藻一样偏好于高温的富营养化水体,该位点的藻类物种组成也证实了这一点,但不同的是,前者偏好于吸收蓝光[41],而常见的水华蓝藻如微囊藻(Microcystis)能利用更多的绿光和黄光[42]. 之前的文献报道拟二叉角藻常生活于寡-中营养的小型水体中[2],进一步研究显示拟二叉角藻扩大了其分布范围. 鉴于拟二叉角藻具较高的生长速率、较大的粒径抵抗浮游动物的摄食以及高效的资源利用能力、特殊的生活史策略和极强的扩张能力[19-23,43-45],加之国内众多浅水湖泊、水库呈现不同程度的富营养化状态,未来拟二叉角藻极有可能持续扩张在不同水体中出现甚至形成水华,应给予高度关注. 本研究给出了详细的形态学特征和分子特征序列,有助于将来对该物种开展进一步深入研究.
