甲状腺未分化癌临床病理观察
2020-05-08王泳超李宁宁郭振英
王泳超,李宁宁,郭振英
(浙江省肿瘤医院,浙江 杭州 310022)
甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)是一种好发于老年患者的罕见肿瘤,迅速生长,多数病例在首诊时即出现甲状腺外侵犯,因压迫或牵扯周围组织脏器出现声音嘶哑、吞咽及呼吸困难等症状[1]。ATC恶性程度高,预后极差,死亡率超过90%[2]。由于ATC部分或完全失去甲状腺分化而呈去分化状态,故形态表现多样,明确的病理诊断对其治疗和预后意义深远。现结合8例甲状腺未分化癌病例并复习文献,将其病理特征作如下报道。
1 资料与方法
1.1 一般资料 回顾性分析本院2010年1月-2018年7月经病理确诊的8例甲状腺未分化癌患者的临床资料,其中男5例,女3例;年龄48-79岁,中位年龄71岁。8例中3例行甲状腺癌根治术,4例行甲状腺癌扩大根治术,1例行姑息性切除术。8例(100%)均有被膜侵犯,7例(87.5%)有甲状腺外侵犯。5例中3例(60%)有淋巴结转移(部分标本未送检或巨检未见明确淋巴组织),转移淋巴结数分别为6/20、2/55、6/27个。血管侵犯及远处转移均1例。其中瘤体最大径≥5cm有4例。3例可见残存甲状腺乳头状癌(PTC)成分,2例对侧见甲状腺微小乳头状癌。电话随访从确诊至2018年7月,其中死亡5例,失访3例,总生存期(overall survival,OS)2~10个月,中位生存时间7个月。本组8例临床资料详见表1。

表1 8例甲状腺未分化癌的临床资料
1.2 方法 采用10%中性甲醛固定标本,常规石蜡包埋后切片,厚度5μm,采用HE染色后观察。免疫组化采用SP法,选用抗体有上皮源性标记角蛋白(CK),稀释比 1:100;甲状腺球蛋白(TG),稀释比 1:400;均购自北京中杉金桥生物技术有限公司;上皮膜抗原(EMA)即用型、Vimentin(即用型)、Ki67(即用型)购自丹麦DAKO公司;PAX8(稀释比1:300)、TTF1(稀释比 1:200)、P53(稀释比 1:200)购自广州安必平医药科技股份有限公司。按说明书进行操作。
2 结果
2.1 大体表现 肿瘤呈灰白实性或鱼肉状,部分区域见出血坏死呈灰红或灰褐色。
2.2 镜下表现 镜下肿瘤呈浸润性生长,侵犯周围组织,边界不清(图1A-1C)。本组以梭形细胞形态为主,其余混杂上皮样细胞或巨细胞一种或两种成分。梭形细胞区域可排列成束状或席纹状,似软组织肉瘤,肿瘤细胞异型性大,可见病理性核分裂像,部分区域见坏死;上皮样区域组织可排列成腺样或巢团样,胞浆丰富,部分病例可见鳞状分化;巨细胞区域肿瘤细胞具有明显多形性,可见奇异型核或多核细胞(图1D-1F)。部分肿瘤中可见骨、软骨等异源性成分。3例可见残存PTC成分,乳头状癌成分与未分化癌成分之间存在过渡区域,提示肿瘤出现间变分化。

图1 ATC镜下表现(HE×200)。1A:浸润周围甲状腺组织;1B:浸润周围纤维脂肪组织;1C:坏死;1D:梭形细胞区域;1E:上皮样区域;1F:巨细胞区域核分裂多见。
2.3 免疫组化 8例中有6例行免疫组化检测,结果显示,全部病例均表达CK(图2A)和 EMA(图2B),表明肿瘤为上皮性癌;5例不表达TG(图2C),仅1例TG见散在阳性,表明ATC虽为上皮性癌,但已没有产生甲状腺球蛋白的功能,提示ATC为一种去分化肿瘤。2例有残存甲状腺乳头状癌成分者表达转录因子配对核基因(PAX8)和甲状腺转录因子(TTF1)。梭形细胞区域6例均表达Vimentin(图 2D)。Ki67增殖指数较高,4例>50%,1例 35%,1例2%。
3 讨论
ATC是一种高度侵袭性的肿瘤,常浸润周围软组织和邻近器官[3]。本文8例均侵犯甲状腺被膜,7例出现甲状腺外侵犯。ATC预后较差,本组8例死亡5例,患者OS为2~10个月,中位生存时间7个月,与文献报道中位生存期仅半年左右[4-5]相符。
研究认为,大部分ATC是先前存在的高分化肿瘤间变(去分化)而来,这种分化较好的肿瘤通常为乳头状癌(或其亚型之一),也可以是滤泡癌[6],本组有3例可见残存PTC成分,有2例在对侧甲状腺内见微小乳头状癌成分,有1例在肿瘤边缘见残留滤泡结构,滤泡与梭形细胞区域存在移行过渡。鉴于ATC形态的多样性,建议多点取材或在甲状腺组织与肿瘤交界处取材,进一步寻找形态学间变的证据来支持诊断。免疫组化对ATC的诊断及鉴别诊断至关重要,肿瘤通常表达CK、EMA(图2A-2B),提示其为上皮源性肿瘤,但是部分分化差或巨细胞区域阴性。部分肿瘤表达PAX8,提示其甲状腺来源,通常不表达TG、TTF1(图2C)。梭形细胞区域强表达Vimentin(图2D),各类型ATC的Ki67增殖指数均较高,这与其侵袭性的生物学行为一致[7]。分子研究显示,在ATC与分化好的甲状腺癌之间存在某些相同的基因突变,如 Braf、RAS[2,8],但是突变频率较低,这也从分子层面提示“ATC由分化好的肿瘤去分化形成”这一假设。在BRAF或RAS基因突变中,TERT启动子的突变率明显提高(33%~50%)[9],提示TERT启动子在肿瘤去分化过程中起重要作用;同时,在ATC中存在高频率 PIK3CA(突变频率 23%),但在 PTC 中则较为罕见(<5%)[8],提示可能不是所有ATC均由高分化肿瘤间变而来。
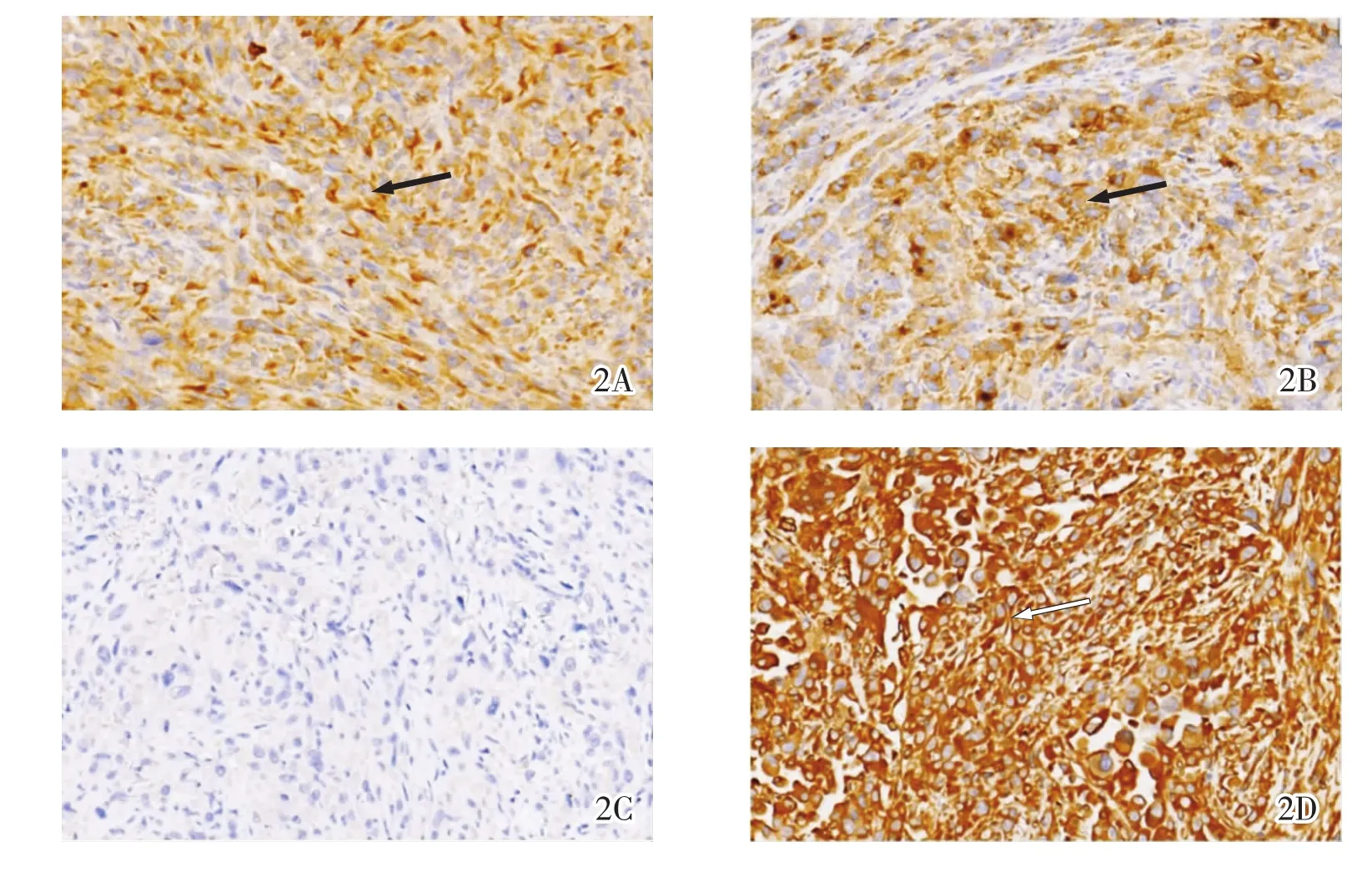
图 2 ATC 免疫组化表现(×200)。 2A:上皮源性标记角蛋白 CK(+)(黑箭);2B:上皮膜抗原EMA(+)(黑箭);2C:甲状腺球蛋白 TG(-);2D:梭形细胞区域 Vimentin(+)(白箭)。
ATC鉴别诊断包括:(1)ATC梭形细胞癌。为PTC伴有5%~95%梭形细胞化生者,梭形细胞排列成束状,但是具有典型的PTC核特征,细胞温和,异型性较小。 免疫组化:CK(+)、TTF1(+)、TG(+)。(2)甲状腺鳞状细胞癌:须与ATC伴鳞状分化相鉴别,原发性甲状腺鳞状细胞恶性程度高、预后差,肿瘤细胞呈明显异型性。免疫组化:P63(+)、P40(+)、Vimentin(-)。(3)孤立性纤维瘤: 肿瘤体积一般较大,界限尚清,主要由纤维母样细胞构成,围绕分支状血管排列,周围间质胶原纤维数量不等,免疫组化:CD34(+)、STAT6(+)、CK(-)、BCL2(+)。(4)伴胸腺样分化的甲状腺癌。罕见,起源于异位胸腺或残留的腮囊组织且保留胸腺分化能力,组织学及免疫表型均与胸腺上皮性肿瘤类似,免疫组化:CD5(+)、CD117(+)[2-3]。
ATC多采用手术+术后放化疗的综合治疗方式。由于ATC不具有正常甲状腺滤泡的摄取碘及受促甲状腺激素(TSH)调控等功能,所以对放射性碘治疗及内分泌治疗均无效。靶向治疗联合免疫治疗有望使某些局部晚期的ATC病例重获手术切除的机会[9]。20%左右的ATC患者表达PD-L1,远高于其他类型的甲状腺癌[10],PD-1/PD-L1在ATC中的治疗前景可观,但尚处于起步阶段。
