氧化苦参碱对骨癌痛大鼠的镇痛作用及对TLR4/NF-κB信号通路的影响
2020-05-08马成龙陈建平孙倩倩孙宇睿冯晓月
马成龙,陈建平,李 航,罗 伟,孙倩倩,孙宇睿,冯晓月,苏 睿
(1山西医科大学麻醉教研室,太原 030001;2山西白求恩医院,山西医学科学院疼痛科;*通讯作者,E-mail:sxcjp2011@163.com)
骨癌是某些原发于骨组织以外的恶性肿瘤(如乳癌、肺癌、肾癌、直肠癌等)经血行转移至骨组织引起的疾病,以骨损害、疼痛为主要临床表现。骨癌引起的疼痛是癌症最可怕的后果,极大地降低了患者的生活质量[1]。目前药物干预仍是治疗骨癌痛的首选治疗方案,阿片类药物被广泛应用于骨癌痛治疗,虽然其镇痛效果较好,但是持续治疗导致的药物耐受,以及长期使用产生的严重不良反应限制了其临床的应用[2]。由于中药或天然药物具有毒副作用小、机体不易残留且镇痛效果好等优点引起了临床医生及科研人员的广泛关注,因此寻求一种安全有效易得的天然药物用于缓解骨癌痛患者的疼痛是目前该领域的研究重点。
氧化苦参碱(oxymatrine,OMT)是从豆科槐属植物苦参(SophoraflavescensAit)中提取的具有四环喹嗪啶类结构的生物碱类成分。现代药理学研究表明,氧化苦参碱具有镇痛、抗炎、抗纤维化及抗肿瘤等作用[3]。有研究表明氧化苦参碱可通过减轻炎症反应改善慢性神经性疼痛小鼠的坐骨神经功能[4]。但是氧化苦参碱对转移性骨肿瘤引起的骨癌痛是否具有抑制作用,目前尚未见报道。Toll样受体4(TLR4)是机体免疫细胞中大量表达的受体,TLR4可激活其下游靶点NF-κB,诱导NF-κB的磷酸化并促进IL-1β、IL-6和TNF-α等促炎因子的释放,从而导致炎症反应的发生。有研究表明,催产素可通过抑制大鼠脊髓中的TLR4和促炎因子来缓解骨癌疼痛[5]。说明TLR4/NF-κB信号通路在骨癌痛发生发展过程中具有重要作用。因此,本研究构建骨癌痛大鼠模型,观察氧化苦参碱对骨癌痛大鼠模型的镇痛作用并从TLR4/NF-κB信号通路角度探讨其可能的作用机制。
1 材料与方法
1.1 实验动物
从辽宁长生生物技术有限公司购进SPF级SD雌性大鼠(体质量80-85 g)24只及同周龄同批次的SD雄性大鼠(体质量180-220 g)50只,合格证号:SCXK(辽)2010-001。购进的大鼠被饲养在符合SPF级的大鼠独立送风隔离笼(Individually Ventilated Cages,IVC)中,温度(22±2)℃,相对湿度(60±5)%,亮 ∶暗循环比为12 h ∶12 h,每笼4只大鼠,可自由取用饲料和水。所有本研究中使用的实验方案得到了实验动物福利伦理委员会的批准。
1.2 主要试剂和仪器
氧化苦参碱购自成都普菲德生物技术有限公司;盐酸曲马多购自北京四环医药科技股份有限公司;大鼠TNF-α、IL-1β和IL-6 ELISA试剂盒购自上海酶联生物科技有限公司;RPMI Medium 1640培养基和胎牛血清(FBS)购自Gibco公司;青-链霉素(penicillin-strepotomycin,P/S)购自Thermo公司;小鼠抗GFAP、兔抗TLR4、IκB、p-IκB、NF-κB、p-NF-κB及GAPDH抗体购自美国Cell Signaling Technology公司;辣根过氧化物酶标记驴抗兔IgG购自北京鼎国昌盛生物技术有限责任公司;蛋白提取试剂盒购自江苏凯基生物技术股份有限公司;BCA蛋白浓度测定试剂盒和SDS-PAGE蛋白上样缓冲液(5X)购自碧云天生物技术研究所。大鼠IVC独立送风隔离笼具(北京佳源兴业科技有限公司);von Frey hairs(上海玉研科学仪器有限公司);恒温细胞培养箱和超低温高速离心机(美国Thermo公司);X光机(Siemens AG Medical Solutions Group);倒置荧光生物显微镜(德国Leica公司);电动匀浆器(上海季诺公司);Western blot电泳仪和转膜仪(Bio-Rad公司);全自动酶标仪(南京德铁公司)。
1.3 Walker256大鼠乳腺癌细胞培养
Walker256大鼠乳腺癌细胞(上海中乔新舟生物有限公司)培养于含有10%FBS、1% P/S的RPMI1640培养基中,置于37 ℃、5%CO2细胞培养箱中培养。细胞生长到90%以上时进行传代培养。取对数生长期的细胞制成单细胞悬液,计数并以2×107个/ml的密度保存于冻存管中备用。
1.4 骨癌痛大鼠模型的制备、分组及给药
参照文献[6]所述方法建立大鼠骨癌痛模型。取1.3中1 ml Walker256细胞,注射到体质量为80-85 g的SD雌性大鼠腹腔中,注射后放回鼠笼中培养。7-9 d后观察到SD雌鼠腹部明显肿大,脱颈处死大鼠并抽取腹水于5 ml离心管中,以1 000 r/min离心5 min,弃去上清液,沉淀物用RPMI 1640培养基清洗3次,重新计数并调整细胞密度至1×108个/ml,置于冰盒内备用。将50只SD雄性大鼠腹腔注射4%水合氯醛(0.7 ml/kg)麻醉后,左侧膝关节部位去毛,暴露胫骨骨面,用牙科钻头在膝关节髌韧带内侧缘沿胫骨纵轴往胫骨远端钻孔,用微量移液器抽取肿瘤细胞20 μl,缓缓注射于钻孔中,另取10只注射20 μl无菌生理盐水作为假手术对照组(sham)。注射完成后固定15-20 s,然后缓慢拔出,最后用医用骨蜡封好钻孔。使用酒精棉球消毒并擦去溢出的Walker256细胞液,逐层缝合,并肌注青霉素钠防止感染。术后7 d将Walker256细胞液注射大鼠分为骨癌痛模型组、盐酸曲马多阳性药组(Tramadol,腹腔注射10 μg/kg,连续7 d)、氧化苦参碱低、高剂量组(腹腔注射50,100 mg/kg,连续7 d),每组10只。
1.5 X摄片观测各组大鼠胫骨病理学改变
术后第7天取假手术组和模型组大鼠4%水合氯醛麻醉后以仰卧位固定,用X光机拍摄每只大鼠股骨X线片,观察胫骨病理学改变确认模型构建成功。
1.6 机械性缩足反射阈值的测定
将各组大鼠置于透明的金属网格笼中,测定前使之适应15-30 min,直至探觅行为停止后开始测量。机械痛阈的行为学测定指标为100%爪缩阈值(paw withdrawal threshold,PWT),采用Up and Down法对各组大鼠术前1 d及术后7,9,11,14 d的机械缩足反射阈值进行测定,测试工具为纤毛机械刺激针(von Frey hairs)。Up and Down法操作方法为测定力度先从2 g开始,当该力度的刺激不能引起大鼠缩足反应时,则给予相邻大一级力度的刺激;若出现缩足反应则给予相邻小一级力度的刺激,如此连续进行,直至出现第一次阳性和阴性反应的骑跨,再连续测定4次取平均值。最大力度为15 g,大于此值时记为15 g。每次刺激间隔30 s。
1.7 组织取材与处理
行为学测定后处死各组大鼠,冰上快速取每只大鼠左侧L4-6背根神经节(DRG)标本。将每组一半的DRG标本保存于4%多聚甲醛中室温固定过夜,进行免疫荧光染色。另一半大鼠DRG组织快速放入液氮后,提取各组大鼠脊髓背根神经节DRG组织的总RNA和蛋白。
1.8 免疫荧光检测各组大鼠DRG中星形胶质细胞的活化
将放入4%多聚甲醛中固定过夜的DRG组织包埋在组织包埋盒中置于-80 ℃冰箱中冻实,后置于-20 ℃冰冻切片机中做连续冠状切片,片厚5 μm,隔10取1用于免疫荧光染色。4%多聚甲醛固定30 min,1%PBS洗涤3次,每次5 min;0.5% Triton X-100透化30 min,1×PBS洗涤3次,每次5 min;滴加适量5% BSA溶液封闭30 min;滴加小鼠抗GFAP一抗稀释液(1 ∶300比例稀释),4 ℃孵育过夜;1×PBS洗涤3次,每次5 min;滴加Cy3荧光标记的山羊抗小鼠二抗稀释液(1 ∶500)室温避光孵育1 h,1×PBS洗涤3次,每次5 min;加入DAPI染色液(1 ∶500)避光反应10 min,1×PBS洗涤3次,每次5 min;加适量抗荧光淬灭剂封片,倒置荧光显微镜下观察并拍照。
1.9 ELISA法检测各组大鼠DRG中TNF-α、IL-1β和IL-6水平
称取各组大鼠DRG组织0.02 mg,用9倍体积(0.18 ml)的生理盐水用电动匀浆器匀浆成匀浆液,并置于1.5 ml离心管收集起来。采用ELISA试剂盒检测各组大鼠DRG匀浆液中TNF-α、IL-1β和IL-6含量。
1.10 Western blot法检测各组大鼠DRG中TLR4/NF-κB信号通路中TLR4、IκB、p-IκB、NF-κB、p-NF-κB蛋白的表达
各组大鼠DRG中加入蛋白裂解液和终浓度为1 mmol/L的PMSF并置于电动匀浆器中匀浆,在冰上裂解30 min。随后将液体转移至新的1.5 ml离心管中,4 ℃条件下离心,吸取上清,BCA试剂盒进行蛋白定量检测。以最低浓度为标准,加入一定量裂解液将各组蛋白调整至等浓度后,用等体积的蛋白上样缓冲液稀释,SDS-PAGE电泳分离。320 mA转膜1.5 h将胶上的蛋白转移至PVDF膜上,用5%脱脂奶粉室温封闭1 h,加入稀释比例均为1 ∶1 000的TLR4、IκB、p-IκB、NF-κB、p-NF-κB及GAPDH一抗稀释液于4 ℃孵育过夜,TBST洗膜3次后,加入辣根过氧化物酶(HRP)标记二抗置摇床上室温孵育1 h,采用ECL发光后胶片暗室曝光显影。用Image J软件对图像进行分析,结果以目的蛋白与内参蛋白GAPDH的光密度比值表示。
1.11 统计学分析
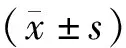
2 结果
2.1 两组大鼠胫骨的X线影像比较
假手术组骨组织影响表现正常,骨质密度均匀,骨皮质连续,无缺失现象;而模型组大鼠的胫骨可见骨结构发生明显的改变和破坏,骨质密度明显不均匀,并伴有缺失现象,骨皮质缺损,周围组织明显肿胀(见图1)。说明骨癌痛大鼠模型成功建立,为后期药效学研究奠定基础。
2.2 OMT改善骨癌痛大鼠的机械痛行为
对于同一时间点不同组间来说,各组大鼠在术前1 d的机械痛阈值比较差异无统计学意义(P>0.05,见表1),说明实验大鼠的均一性较好;术后7 d,与假手术组相比,模型组大鼠机械缩足反射阈值明显降低,说明骨癌痛大鼠出现机械痛敏。而给予7 d低高剂量OMT和盐酸曲马多治疗后的大鼠与模型组大鼠比较,机械缩足反射阈值随着治疗时间的延长而升高,差异有统计学意义(P<0.01或P<0.05),且呈剂量依赖性。而对于同组间不同时间点来说,假手术组不同时间点之间差异无统计学意义;与术前1 d相比,模型组和各给药组其余时间点机械缩足反射阈值明显降低,差异具有统计学意义(P<0.01);与术后7 d相比,模型组剩余其他时间点的机械缩足反射阈值无显著性差异,说明模型的稳定,而各给药组在术后11 d和14 d的机械缩足反射阈值明显升高,差异有统计学意义(P<0.01)。
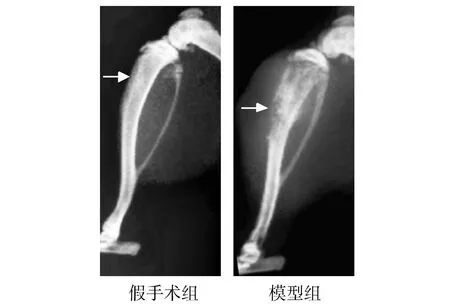
图1 骨癌痛模型组和假手术组大鼠胫骨X线影像对比
表1 每组大鼠机械缩足反射阈值的比较 (g,n=10)
Table 1 Comparison of pawmechanicalwithdrawal threshold of rats among five groups (g,n=10)
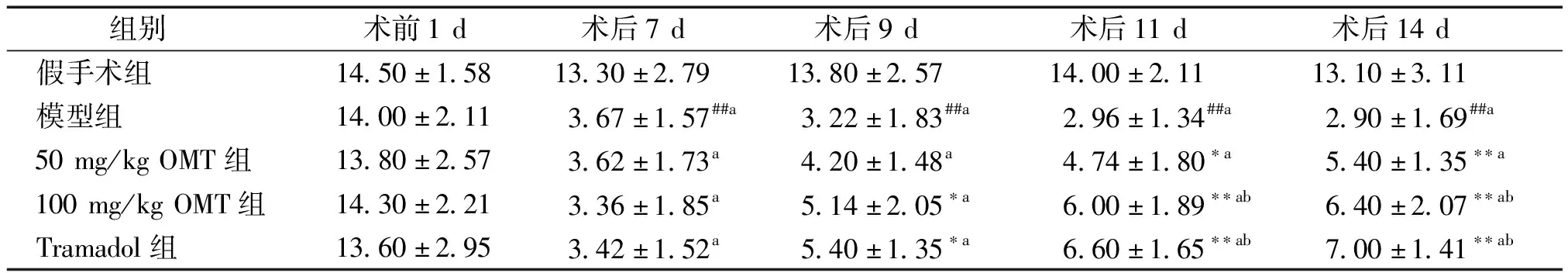
组别 术前1d术后7d术后9d术后11d术后14d 假手术组14.50±1.5813.30±2.7913.80±2.5714.00±2.1113.10±3.11 模型组14.00±2.113.67±1.57##a3.22±1.83##a2.96±1.34##a2.90±1.69##a 50mg/kgOMT组13.80±2.573.62±1.73a4.20±1.48a4.74±1.80∗a5.40±1.35∗∗a 100mg/kgOMT组14.30±2.213.36±1.85a5.14±2.05∗a6.00±1.89∗∗ab6.40±2.07∗∗ab Tramadol组13.60±2.953.42±1.52a5.40±1.35∗a6.60±1.65∗∗ab7.00±1.41∗∗ab
与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与术前1 d比较,aP<0.01;与术后7 d比较,bP<0.01
2.3 OMT对骨癌痛大鼠DRG处星形胶质细胞活化的影响
模型组DRG处星形胶质细胞百分比较假手术组相比显著升高(28.17%±3.06%vs3.19%±1.71%,P<0.01,见图2);而50 mg/kg OMT组和Tramadol组大鼠的DRG处星形胶质细胞数目百分比明显降低至19.65%±2.55%,15.49%±1.58%和13.68%±2.62%,差异有统计学意义(P<0.01)。
2.4 OMT对骨癌痛大鼠DRG中炎症因子释放的影响
与假手术组相比,模型组IL-1β、IL-6和TNF-α浓度明显升高,差异有统计学意义(P<0.01);与模型组相比,OMT不同剂量组及盐酸曲马多组DRG组织中IL-1β、IL-6和TNF-α释放量显著降低,差异有统计学意义(P<0.01,见表2)。
GFAP(红色)染色星形胶质细胞,DAPI(蓝色)染色细胞核
A.各组大鼠DRG处星形胶质细胞活化情况 (bar=25 μm) B.定量分析各组大鼠DRG处GFAP阳性细胞占所有细胞的百分比 (n=5)
图2 比较各组大鼠DRG处星形胶质细胞的活化情况
Figure 2 Comparison of activation of astrocyte in DRG in rats among five groups
表2 各组大鼠中相关炎症因子的表达 (ng/L,n=5)
Table 2 Comparison of related inflammatory factors in rats among five groups (ng/L,n=5)
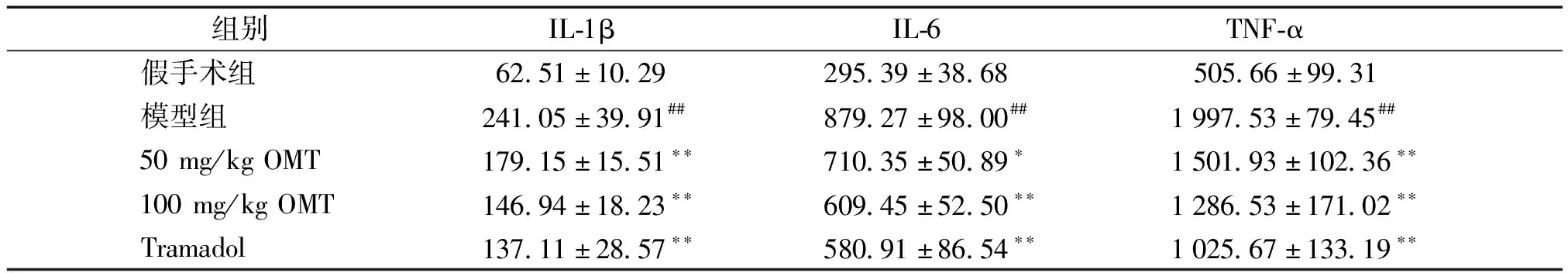
组别 IL-1βIL-6TNF-α 假手术组62.51±10.29295.39±38.68 505.66±99.31模型组241.05±39.91##879.27±98.00##1997.53±79.45##50mg/kgOMT179.15±15.51∗∗710.35±50.89∗1501.93±102.36∗∗100mg/kgOMT146.94±18.23∗∗609.45±52.50∗∗1286.53±171.02∗∗Tramadol137.11±28.57∗∗580.91±86.54∗∗1025.67±133.19∗∗
与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
2.5 OMT对骨癌痛大鼠脊髓中TLR-4/NF-κB信号通路相关蛋白表达的影响
与假手术组相比,模型组TLR-4、p-IκB和p-NF-κB蛋白表达量明显升高,差异有统计学意义(P<0.01);与模型组相比,不同剂量OMT组和盐酸曲马组TLR-4、p-IκB和p-NF-κB表达均能降低,差异有统计学意义(P<0.05或P<0.01),而各组DRG内IκB和NF-κB蛋白表达量无明显变化(P>0.05,见图3)。
3 讨论
肿瘤骨转移引起的骨癌痛是临床常见的慢性疾病,发病机制复杂,且无有效治愈药物。脊髓背根神经节(DRG)是痛觉的初级传入神经元,在疼痛传导及发生过程中具有重要作用。因此,DRG始终是疼痛机制和疼痛治疗研究中的重点对象[7]。有研究表明,DRG的致敏作用能够促进肿瘤诱导痛觉过敏和产生疼痛,并且以DRG为靶点进行治疗缓解疼痛的效果良好[8]。因此,本研究通过左后肢胫骨注射walker256乳腺癌细胞悬液的方法制备大鼠骨癌痛模型,旨在探讨氧化苦参碱对骨癌痛大鼠的镇痛作用及其作用机制。揭示了氧化苦参碱可通过调节大鼠DRG内炎症免疫反应,抑制TLR-4/NF-κB信号通路发挥镇痛作用。
在骨组织中生长的肿瘤细胞刺激破骨细胞导致骨破坏和骨膜牵拉,引起局部缺血和周围神经受压,并诱导胶质细胞活化。有研究发现在骨癌痛大鼠模型中,脊髓、DRG和癌旁处星形胶质细胞大量活化增生,能够释放包括IL-1β、IL-6和TNF-α等在内的各种促炎因子[9]。IL-1β、IL-6和TNF-α是产生持续性疼痛的重要介质,具有改变细胞膜通透性,促进Na+内流,降低兴奋性阈值,从而产生疼痛[10]。此外,胶质细胞激活后除参与炎症反应外,还与吗啡耐受形成有关。Pan等[11]报道称鞘内注射Nav1.7 shRNA慢病毒载体可抑制DRG内星形胶质细胞和小胶质细胞的活化,从而改善疼痛,并且在吗啡耐受型骨癌疼痛模型大鼠中也具有相同的效果。本研究结果也证实,氧化苦参碱显著降低了DRG处星形胶质细胞数目百分比,抑制星形胶质细胞活化;同时,氧化苦参碱还降低了DRG内促炎因子IL-1β、IL-6和TNF-α的水平,提示氧化苦参碱的镇痛作用与调控大鼠DRG内免疫炎症反应有关。
TLR4是首先被报道的人类Toll样受体,是炎症信号传递过程中的“门户蛋白”,在免疫炎症反应中发挥关键作用,其在中枢神经系统中的胶质细胞内大量表达[12]。有研究表明,特异性阻断TLR4可显著提高骨癌痛大鼠的机械缩足反射阈值,起到镇痛作用[13]。NF-κB是普遍存在于细胞质中的一种重要的核转录因子,位于TLR4下游信号通路的枢纽位置,可调控TNF-α、NO等多种疼痛相关因子的表达[14]。NF-κB通常以p50/p65二聚体形式存在于细胞内。生理状态下,NF-κB蛋白p50/p65二聚体在胞浆中与抑制蛋白κB(inhibitor kappa B, IκB)结合,使其不能进入细胞核内,处于非活化状态。而当细胞受到外界炎症刺激后(比如LPS、IL家族成员等),使IκB的激酶IKK被激活,使IκB被磷酸化,磷酸化的IκB会发生泛素化并快速降解,导致NF-κB蛋白被释放,并进入细胞核内发挥生物活性,并与靶基因结合,诱导靶基因转录,促进靶蛋白合成,从而发挥生物效应[15,16]。TLR-4/NF-κB信号通路被激活后,可调控IL-1β、IL-6和TNF-α等多种炎症因子的表达,并且IL-1β、IL-6和TNF-α等炎症因子也对TLR-4/NF-κB信号通路有激活的反馈调节作用,从而形成反馈环路,共同参与骨癌痛的病理进程[17]。Tian等[18]证实沙利度胺可通过抑制骨癌痛大鼠中枢系统内星形胶质细胞活化及NF-κB活性,起到减轻疼痛的目的。Song等[19]报道了米诺环素可通过抑制大鼠中枢系统中星形胶质细胞内的NF-κB活性来减轻大鼠骨癌痛。为了证明氧化苦参碱抑制免疫炎症反应,减轻疼痛与TLR-4/NF-κB信号通路的相关性,我们利用Western blot检测了大鼠DRG内TLR4、IκB、p-IκB、NF-κB和p-NF-κB蛋白表达情况,结果发现给予氧化苦参碱治疗后骨癌痛大鼠DRG内TLR4、p-IκB和p-NF-κB蛋白表达量显著降低,说明氧化苦参碱调控大鼠DRG内免疫炎症反应、缓解骨转移诱导的疼痛与抑制TLR-4/NF-κB信号通路活性有关。
综上所述,本研究证明了氧化苦参碱可提高骨癌痛大鼠的机械痛阈值,抑制DRG处星形胶质细胞活化及促炎因子释放;并且证明了其上述作用与抑制TLR-4/NF-κB信号通路活性有关,但是其具体分子生物学机制,尚需进一步研究。
