TPM4在胃癌细胞中的表达及其对胃癌细胞侵袭与迁移能力的影响
2020-05-08郑文英陆细红陈嘉乐
郑文英,陆细红,陈嘉乐,邓 敏*
(1广州医科大学附属肿瘤医院肿瘤研究所,广州 510030;2广州市第八人民医院;*通讯作者,E-mail:dengmin510095@163.com)
胃癌的转移途径有直接浸润、血行转移、淋巴转移与种植转移,其主要以淋巴转移为主,胃癌侵袭转移能力强,它的发病机制和侵袭转移机制虽然已经有很多研究,但还有很多未知值得探索[1,2]。肌球蛋白4(TPM4)是肌动蛋白结合蛋白家族中的一员,原肌球蛋白可为微丝提供稳定性,调节其他肌动蛋白结合蛋白。TPM4在多种癌症中均有异常表达,被认为是卵巢癌、乳腺癌、结肠癌、角化棘皮瘤和食管鳞癌的潜在检测标志物。根据蛋白表达谱,TPM4被认为是卵巢癌和乳腺癌的一种潜在致癌因子[3]。有研究表明,TPM4在乳腺癌、肺癌、结直肠癌、胶质瘤、膀胱癌等多种癌症中都高表达[4],并且TPM4 siRNA能够抑制肺癌细胞的增殖,促进肺癌细胞的凋亡[5]。本研究通过Transwell小室分离法培养SGC7901-invasion细胞、SGC7901-noninvasion细胞亚系并测序,旨在观察胃癌细胞SGC7901-invasion TPM4的表达水平及敲低TPM4对SGC7901-invasion细胞侵袭迁移能力的影响。
1 材料与方法
1.1 细胞株和主要试剂
人胃癌细胞系SGC7901购于美国ATCC细胞库。DMEM高糖培基、胰酶及胎牛血清均购于美国Gibcol公司。蛋白酶抑制剂(PMSF)购于美国Sigma-Aldrich公司,蛋白裂解液(RIPA)购于碧云天生物科技有限公司。预染蛋白质标记物与转染试剂均购于美国Thermo Fisher Scientific公司。TPM4抗体购于美国Abcam公司。HRP标记山羊抗兔IgG、山羊抗鼠IgG购于美国Cell Signaing Technology公司。ECL化学发光底物试剂盒购于北京安诺伦生物科技有限公司。
1.2 细胞培养与分离
培养GC7901胃癌细胞,培养液用含有10%胎牛血清的DMEM细胞培养液,Transwell小室培养SGC7901-noninvasion细胞上层细胞,下层培养SGC7901-invasion细胞,放置于37 ℃,饱和湿度,5% CO2培养箱中,当细胞密度长至80%-90%时,PBS洗涤,用0.25%胰酶(含EDTA)消化并进行传代,重复10代。
1.3 qRT-PCR检测相关RNA的表达水平
总RNA的提取用TRIzol法,在SGC7901-invasion细胞、SGC7901-noninvasion细胞生长处于对数期时加入TRIzol,静置10 min,将其分别移入无核酶的EP管中,将TRIzol与氯仿按照5 ∶1的比例震荡混匀,静置5 min,4 ℃ 12 000 r/min离心10 min,吸取上清至无核酶的EP管中,再加入同等体积的异丙醇,混匀,静置5 min,4 ℃ 12 000 r/min离心10 min。去上清,在沉淀中加入75%酒精,4 ℃ 7 500 r/min离心10 min,弃上清,加入适量无核酶水,溶解沉淀,NANO Drop中测浓度,存于-80 ℃冰箱。总RNA的逆转录使用Thermo Fisher Scientific逆转录试剂盒,共20 μl体系,反应体系如下:Oligo(dT)1 μl,5×Reaction Buffer 4 μl,RiboLock RNase Inhibitor(20 U/μl)1 μl,10 mmol/L dNTP Mix 2 μl,RevertAid M-MuLV RT(200 U/μl)1 μl,RNA逆转录质量为3 μg,加水补齐至20 μl,逆转录程序为42 ℃ 60 min,70 ℃ 5 min。实时qRT-PCR反应体系为20 μl:SYBR Premix Ex TaqTM 10 μl,PCR Forward Primer(10 μmol/L) 1 μl,PCR Reverse Primer(10 μmol/L) 1 μl,cDNA 2 μl,加水补齐至20 μl,每个样品设置3个复孔。反应程序为预变性95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环。
1.4 Western blot检测TPM4蛋白的表达水平
单层贴壁细胞总蛋白的提取,取对数生长期的细胞,先将培养基倒掉,PBS洗3次,用蛋白裂解液(RIPA)+蛋白酶抑制剂(PMSF)冰上裂解30 min,将蛋白刮下,采用BILON-R1500D超声波信号发生器,超声1.5 s,间隔4 s,每个样品超声6次,超声时需将样品置于冰中。超声后将样品4 ℃ 12 000 r/min离心15 min,收取上清,BCA法测定总蛋白浓度。上样量为30 μg,使用SDS-PAGE凝胶电泳,电泳为80 V,当marker分开时改用120 V电泳,当溴酚蓝指示剂跑至SDS-PAGE凝胶底部1 cm处停止电泳,开始湿转转膜,转膜条件为200 mA恒流90 min,转膜结束后,脱脂牛奶封闭液封闭2 h,在目的条带处孵育TPM4抗体与β-actin抗体(抗体浓度均为1 ∶1 000),4 ℃过夜。TBST洗膜3次,每次10 min。孵育HRP标记的特异性二抗2 h(二抗使用TBST按1 ∶5 000稀释),TBST洗膜3次,每次10 min,之后用ECL化学发光试剂对X光片显影,扫描照片。
1.5 细胞转染
取对数生长期的SGC7901-invasion细胞,待细胞生长至70%-80%时,使用3 μg siCTR质粒或3 μg siTPM4质粒分别对SGC7901-invasion细胞进行转染,未处理组为对照。转染时为无血清DMEM培基,6-8 h换为10%FBS的DMEM培基。转染进行48 h,使用Western blot法检测TPM4的水平,以验证沉默效果。
1.6 Transwell实验
选择铺有基质胶的Transwell小室,将其从-20 ℃拿出,加入无血清的DMEM培基200 μl进行活化,放入37 ℃,5% CO2培养箱中孵育30 min。消化SGC7901-invasion-siCTR细胞与SGC7901-invasion-siTPM4细胞,1 000 r/min离心5 min,用无血清DMEM培基重悬后用计数板计数,取5×104个细胞,Transwell小室中为细胞与无血清DMEM培基,共200 μl,下室为600 μl的10% FBS的DMEM培基,37 ℃,5% CO2的培养箱中培养24 h。甲醇固定30 min,结晶紫染色15 min。清水洗涤后用棉签擦拭小室内部,晾干后用倒置显微镜拍照。
1.7 划痕实验
取生长对数期的SGC7901-invasion-siCTR细胞与SGC7901-invasion-siTPM4,待细胞长至90%后用10 μl规格的枪头划痕,0,24,48 h用倒置显微镜拍照。
1.8 统计学分析
采用软件GraphPad Prism 6.0进行统计学分析,结果均表示为均数±标准差,两组间比较用独立样本t检验,多组间比较使用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 TPM4在SGC7901-invasion细胞中的表达高于SGC7901-noninvasion细胞
Western blot及qRT-PCR检测结果显示,TPM4在SGC7901-invasion细胞中的表达高于SGC7901-noninvasion细胞(见图1)。qRT-PCR的结果显示,TPM4在SGC7901-noninvasion细胞的表达为1,在SGC7901-invasion细胞中为3.16±0.33,与SGC7901-noninvasion细胞比较,TPM4表达差异有统计学意义(P=0.000 3),表明TPM4在SGC7901-invasion细胞表达量远高于SGC7901-noninvasion细胞。
2.2 转染TPM4-siRNA沉默TPM4的表达
使用siRNA沉默TPM4后,48 h后收取总蛋白,Western blot法检测TPM4的表达水平,结果显示,转染TPM4-siRNA于SGC7901-invasion细胞,TPM4的表达量大大降低(见图2)。
2.3 TPM4促进SGC7901-invasion细胞的侵袭
使用siRNA在SGC7901-invasion细胞中沉默TPM4,Transwell基质胶侵袭实验检测TPM4对SGC7901-invasion细胞侵袭能力的影响,结果见图3。SGC7901-invasion-siTPM4组与SGC7901-invasion-siCTR组比较,细胞侵袭能力显著降低,差异有统计学意义(P=0.009),表明沉默TPM4对SGC7901-invasion细胞的侵袭能力具有抑制作用。

图1 Western blot及qRT-PCR检测TPM4的表达

图2 Western blot检测沉默TPM4后的表达
2.4 TPM4促进SGC7901-invasion细胞的迁移
使用siRNA在SGC7901-invasion细胞沉默TPM4,检测对迁移能力的影响,结果见图4。SGC7901-invasion-siTPM4和SGC7901-invasion-siCTR细胞24 h迁移率为0.343 3±0.050和0.693 3±0.032,两组间比较差异有统计学意义(P=0.004 2),表明沉默TPM4对SGC7901-invasion细胞的迁移能力具有抑制作用。

图3 沉默TPM4后对SGC7901-invasion细胞侵袭的影响
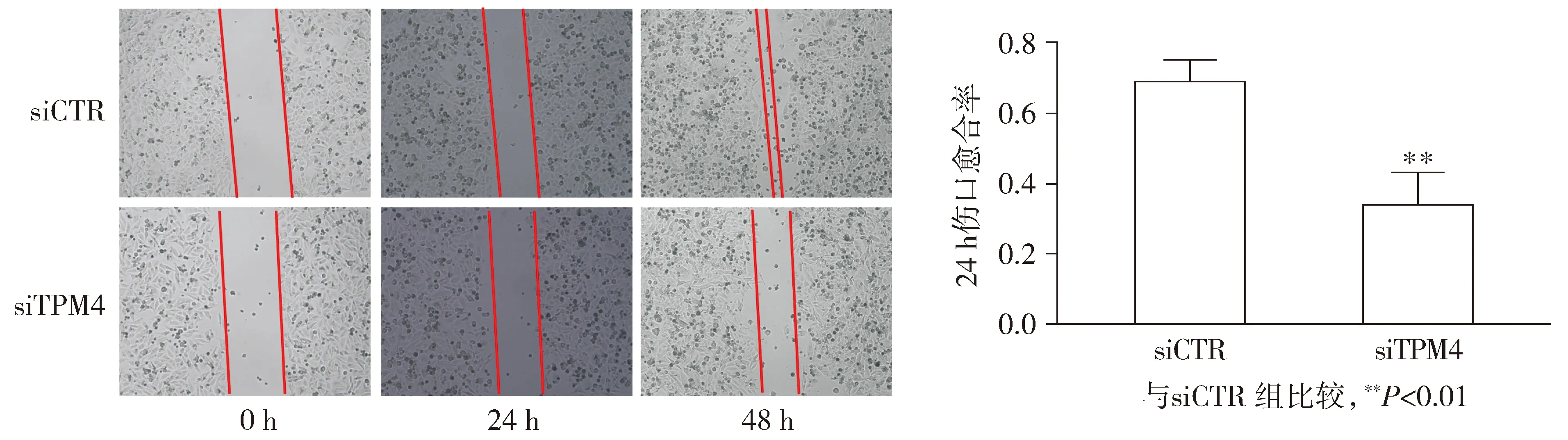
图4 沉默TPM4后对SGC7901-invasion细胞迁移的影响
3 讨论
胃癌仍然是全世界最常见的肿瘤之一,发病率在肿瘤中排名高居第五,死亡率为第三[6,7]。尽管早期胃癌治疗可通过手术治疗且预后良好,但是进展期胃癌易复发,容易因为复发、转移、耐药等因素而预后不好[8]。近年来虽然对胃癌的致癌因子、肿瘤抑制因子有了大致的研究,但对于胃癌的发生发展机制尚未明确[9]。本实验室对胃癌细胞SGC7901采用Transwell小室分离法培养出SGC7901-noninvasion细胞与SGC7901-invasion细胞,提取RNA测序发现TPM4在SGC7901-invasion细胞中高表达。原肌球蛋白(TPM)是细肌丝中与肌动蛋白的结合蛋白,每条TPM4都是由首尾相连而连接形成的一条连续不间断的链同肌动蛋白在细肌丝结合。原肌球蛋白在肌肉运动中起着肌肉收缩的作用,发挥调节作用,在真核细胞中以异构体的形式存在。哺乳动物中已经发现了4种TPM,即TPM1、TPM2、TPM3、TPM4。目前对TPM1、TPM2、TPM3的研究已经有很多,例如在膀胱移行细胞癌中,TPM1在肿瘤组织中的表达明显降低,有可能成为早期诊断膀胱癌的一个新标志物[10];在乳腺癌中,与正常乳腺细胞相比,乳腺癌细胞中TPM2表达下调,下调TPM4可显著降低细胞对紫杉醇的敏感性[11],在胰腺癌中,敲除PANC-1细胞中TPM3基因表达后,细胞发生EMT,细胞表型呈恶性转化,细胞的体外生物学行为(如增殖和侵袭)均有不同程度的增强,TPM3基因有望成为胰腺癌治疗的靶点[12]。近年来发现TPM4异常表达于各种肿瘤中,如乳腺癌、肝癌、肺癌、膀胱癌、前列腺癌,但TPM4在不同的肿瘤中起着不同的致癌或抑癌作用。在乳腺癌中,TPM4通过Rac1-肌球蛋白ⅡB信号通路在阻断其侵袭性行为中扮演重要角色[13];同样的,低表达TPM4是结肠癌患者不良的独立预后因素,有体外实验提示TPM4表达上调可抑制结肠癌细胞迁移、侵袭和转移相关基因MMP-2、MMP-9和MT1-MMP的表达[14]。而在石棉肺中,TPM4的高水平与石棉暴露或石棉肺诊断相关[15]。肺癌细胞中TPM4也高度表达[3]。有研究在口腔鳞状细胞癌(OSCC)患者的唾液蛋白质组通过二维聚丙烯酰胺凝胶电泳和质谱进一步鉴定了上调蛋白为TPM4,并通过生物信息学证明了其与scFV-D09的结合,它在稳定细胞骨架肌动蛋白丝(可能与肿瘤组织重塑有关)中起着核心作用,并且已经有长期研究证实TPM4是恶性过程的潜在标志物[16],在肝硬化型胃癌中也上调[17]。本实验也验证了TPM4在SGC7901-invasion细胞高表达。
为了进一步验证TPM4是否参与调节胃癌细胞的侵袭与迁移的过程,在体外试验中选择了高表达TPM4的SGC7901-invasion细胞作为研究模型。我们应用siRNA技术特异性地下调TPM4的表达,观察其对SGC7901-invasion细胞生物学功能的影响,结果显示,沉默TPM4的表达能显著抑制SGC7901-invasion细胞的体外侵袭、迁移能力(P<0.05)。以上结果说明,TPM4具有调控胃癌细胞侵袭与迁移的能力,可能是促进胃癌的侵袭转移的致癌基因。提示TPM4可能成为胃癌诊断的标志物且可能与复发、转移有关。
