柚木的植物化学与药理学研究进展*
2020-05-07王西洋黄桂华梁坤南周再知
王西洋 黄桂华 杨 光 梁坤南 周再知
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
柚木Tectona grandis L.属马鞭草科柚木属高大乔木,柚木属有3 个种,即柚木T. grandis、汉密尔顿柚木T. hamiltoniana 和菲律宾柚木T. philippinensis[1]。柚木为热带落叶树种,植株高可达40~50 m,原产缅甸、印度、老挝和泰国北部,人工林现已广泛分布于东南亚、拉美和非洲近70 余个热带国家和地区[2]。柚木因其材性优良、纹理优美、防腐耐朽,是举世公认的珍贵树种[3]。
我国柚木引种始于1820 年,主要作为庭院观赏与四旁绿化树种,在云南省南部与西南部边境的寺庙或遗址,尚存有柚木大树[4]。1960 年前后在云南西南部建立了畹町、瑞丽、陇川和盈江4 个柚木林场,营造柚木人工林约780 hm2。1900 年台湾高雄等地引种,1913 年大面积种植,至1965 年柚木人工林面积达5 700 hm2。1960—1967 年在海南尖峰岭种植柚木人工林面积达300 hm2。1999—2010 年,由于国外对天然林进行封禁和国内市场对珍贵用材的需求激增,广东省、云南省、福建省、广西自治区和海南省等地区的柚木造林主要是以个人或私营企业为主,造林面积超过1.5 万hm2。西部及东南沿海实施的退耕还林、天保工程以及速生丰产用材林基地建设,使海南省、云南省等地区把柚木列入主要造林树种,柚木成为国内重要珍贵用材树种[5]。
自古以来,植物就是不可或缺的药物来源。通过对植物天然产物相关知识的探索、传统医药科学知识的总结来研发新的具有药用价值的制剂[6]。植物体存在的天然化学物质被用作制药工业优化的模板,来制造安全有效的药物。在发达国家,25%的药物是以植物及其衍生物为基础开发上市的。在印度、缅甸、西非、中国云南省等地区,柚木在传统医学中具有重要地位[7]。文章综述了柚木的植物化学和药理活性,并探讨了其进一步研究、开发和利用的潜力。
1 柚木在传统医药中的用途
柚木具有多种药用特性和用途,其多个部分均具有药用价值,柚木树皮煎剂用于治疗支气管炎、胃酸过多、痢疾、寄生虫病、灼热感、糖尿病、难产、麻风病和皮肤病[8]。柚木叶片具止血功能,可以挤压揉碎并涂抹在割破皮肤上来止血[9-10]。柚木叶片对发炎、麻风病、皮肤病、瘙痒、口腔溃疡等症具有疗效[11-12]。敷用或口服叶片提取物可促进伤口收缩和愈合[13],还具有抗弓形虫的疗效[7]。柚木锯末粉调糊能够缓解头痛,治疗胆汁病、肝脏灼痛[14]。柚木炭粉与罂粟汁调糊能够减轻眼睑肿胀[15]。柚木根煎剂可用于治疗泌尿系统相关疾病,如无尿症。柚木花中提取的油可用于治疗疥疮,能够促进毛发生长[16]。柚木花和种子是利尿剂,促进尿液流动。柚木种子在印度传统医学体系中被誉为生发药[15-17]。柚木在傣语中又名“埋沙”,据《中国傣药志》记载,柚木具有“祛风通血,消肿止痛,解毒止痒”等功效[18]。
2 柚木分离出的化合物种类
探明柚木不同部位存在哪些次生代谢产物对其在传统医药学中的应用具有重要意义。对柚木化学成分的深入研究已超过100 年,在不同部位检测到了15 类92 种化合物,主要有萘醌类11 种、蒽醌类25种、单萜类1 种、倍半萜类2 种、二萜类8 种、三萜类11 种、多萜类1 种、苯丙酯类8 种、苯乙醇苷类1 种、脂肪酸类5 种。其分子式和分离部位见表1。

表1 柚木植株不同器官分离的化合物Tab. 1 Compounds isolated from different parts of Tectona grandis L.

编号类别Category 化学名称Compound 分离部位Plant parts Tectoquinone(C15H10O2) 心材、边材13 2-Hydroxymethyl-anthraquinone (C15H10O3) 心材14 2-Acetoxymethyl-anthraquinone (C15H12O4) 心材15 Anthraquinone-2-carbaldehyde (C15H8O3) 心材16 Anthraquinone-2-carboxylic acid (C15H8O4) 心材17 3-Hydroxy-2-methyl-anthraquinone (C15H10O3) 心材18 Pachybasin (C15H10O3) 心材、根部19 Rubiadin (C15H10O4) 心材20 Munjistin (C15H8O6) 心材21 2-Methylquinizarin (C15H10O4) 心材、根部22 Quinizarine (C14H8O4) 叶片23 1-Hydroxy-2-methyl anthraquinone (C15H10O3) 根部、树干24 5,8-dihydroxy-2-methylanthraquinone (C15H10O4) 叶片25 Obtusifolin (C16H12O5) 根部、锯末26 9,10-Dimethoxy-2-methyl-1,4-anthraquinone(C17H14O4) 心材27 5-Hydroxy-2-methyl anthraquinone (C15H10O3) 心材28 1-Hydroxy-5-methoxy-2-methylanthraquinone(C16H12O4) 心材29 1,5-Dihydroxy-2methylanthraquinone (C15H10O4) 心材30 5-Hydroxydigitolutein (C16H12O5) 组培31 Barleriaquinone-I (C15H10O3) 心材32 Tectoleafquinone (C19H14O6) 叶片33 Grandiquinone A (C17H12O5) 叶片34 Tectograndone (C30H20O10) 叶片35 Anthratectone (C27H18O9) 叶片36 Naphthotectone (C17H16O7) 叶片37 单萜类(MONOTERPENE) 6RS) -(E)-2,6-Dimethyl-2,7-octadiene-1,6-diol (C10H18O2) 叶片、树皮38 倍半萜类(SESQUITERPENES)12蒽醌类(ANTHRAQUINONES)lβ-6α-Dihydroxy-4(15)-eudesmene (C15 H26O2) 叶片、树皮39 7-Epieudesm-4(15)-ene-1α,6α-diol (C15 H26O2) 叶片、树皮40Abeograndinoic Acid (C20H32O4) 叶片、树皮41 Phytol (C20H40O) 叶片、树皮42 7,11,15-Trimethyl-3-methylene-hexadecan-1,2-diol (C20H40O2) 叶片、树皮43 Rhinocerotinoic acid (C20H30O3) 叶片、树皮44 2-Oxokovalenic acid (C20H30O3) 叶片、树皮45 19-Hydroxyferruginol (C20H30O2) 叶片、树皮46 Tectograndinol (C20H34O3) 叶片47 Solidagonal acid (C20H30O3) 叶片、树皮二萜类(DITERPENES)

编号类别Category 化学名称Compound 分离部位Plant parts Lupeol (C30H50O) 树皮49 Betulin (C30H50O2) 树皮50 Betulinaldehyde (C30H48O2) 树皮51 Betulinic acid (C30H48O3) 心材、树皮、根部、叶片48 52 Ursolic acid (C30H48O3) 叶片、树皮53 Corosolic acid (C30H48O4) 叶片54 Oleanolic acid (C30H48O3) 叶片、树皮55 Maslinic acid (C30H48O4) 叶片、树皮56 Methyl-2α,3α-dihydroxyurs-l2-en-28-oate (C30H48O4) 叶片、树皮57 Euscaphic acid (C30H48O5) 叶片、树皮58 Squalene (C30H50) 根部59 多萜类(POLYTERPENE) Caoutchouc or Indian rubber Polymer 木材60三萜类(TRITERPENES)Tectoionol A (C13H23O3) 叶片61 Tectoionol B (C13H24O2) 叶片62 Annuionone D (C13H20O3) 叶片63 3β-Hydroxy-7,8-dihydro-β-ionol (C13H24O2) 叶片64 9(S)-4-Oxo-7,8-dihydro-β-ionol (C13H22O2) 叶片65 3β-Hydroxy-7,8-dihydro-β-ionone (C13H22O2) 叶片66脱辅基类胡萝卜素类(APOCAROTENOIDS)Gallic acid (C7H6O5) 叶片67 Ellagic acid (C14H6O8) 叶片68 Acetovanillone (C9H10O3) 叶片69 E-Isofuraldehyde (C10H10O3) 叶片70 3-Hydroxy-1-(4-hydroxy-3,5-dimethoxyphenyl)-propan-1-one (C11H14O5) 叶片71 Evofolin A (C17H18O6) 叶片72 黄酮类化合物(FLAVONOIDS)酚类化合物(PHENOLIC COMPOUNDS)Rutin (C27H30O16) 叶片73 Quercitin (C15H10O7) 叶片74β-Sitosterol (C29H50O) 根部75 Hydroxyenone (C29H48O2) 叶片、树皮76 β-Sitosterol-β-d-[4′linolenyl-6′-(tridecan-4′″-one-1′″-oxy)]Glucuranopyranoside (C66H110O8) 树皮甾类化合物(STEROIDS)77 Stigmast-5-en-3-O-β-d-glucopyranoside (C35H60O6) 树皮78 Sitosterol 3-O-β-d-glucopyranoside (C60H100O7) 叶片

编号类别Category 化学名称Compound 分离部位Plant parts Syringaresinol (C22H26O8) 叶片80 Medioresinol (C21H24O7) 叶片81 1-Hydroxypinoresinol (C20H22O7) 叶片82 Lariciresinol (C20H24O6) 叶片83 Balaphonin (C20H20O6) 叶片84 Zhebeiresinol (C14H16O6) 叶片85 苯丙酯类:非木脂素类(PHENYLPROPANOIDS : NORLIGNANS)79苯丙酯类:木脂素类(PHENYLPROPANOIDS :LIGNANS)Tectonoelin A (C18H16O6) 叶片86 Tectonoelin B (C19H18O7) 叶片87苯乙醇苷类(PHENYLETHANOID GLYCOSIDE)Verbascoside or acteoside (C29H36O15) 叶片7′-Hydroxy-n-octacosanoyl n-decanoate(C28H56O3 树皮89 20′-Hydroxyeicosanyl linolenate (C38H72O3) 树皮90 18′-Hydroxy-n-hexacosanyl-n-decanoate (C36H72O3) 树皮91 n-Docosane (C22H46) 树皮92 O-Tolylmethylether (C8H10O) 木材88脂肪酯类(FATTY ESTERS)
醌类是柚木的主要次生代谢物,以萘醌类(图1)和蒽醌类(图2)的形式存在。此外,柚木还含有其他几种植物化学物质,如萜类化合物(图3)、脱辅基类胡萝卜素类(图4)、酚类化合物和黄酮类化合物(图5)、类固醇/皂苷类化合物(图6)、苯丙素类化合物(木脂素和非木脂素)和苯乙醇苷类化合物(图7)、一些脂肪酯和其它化合物。这些次级代谢产物的多样性表明,进一步研究柚木的药用化学成分将提供关于该物种化学的重要信息。
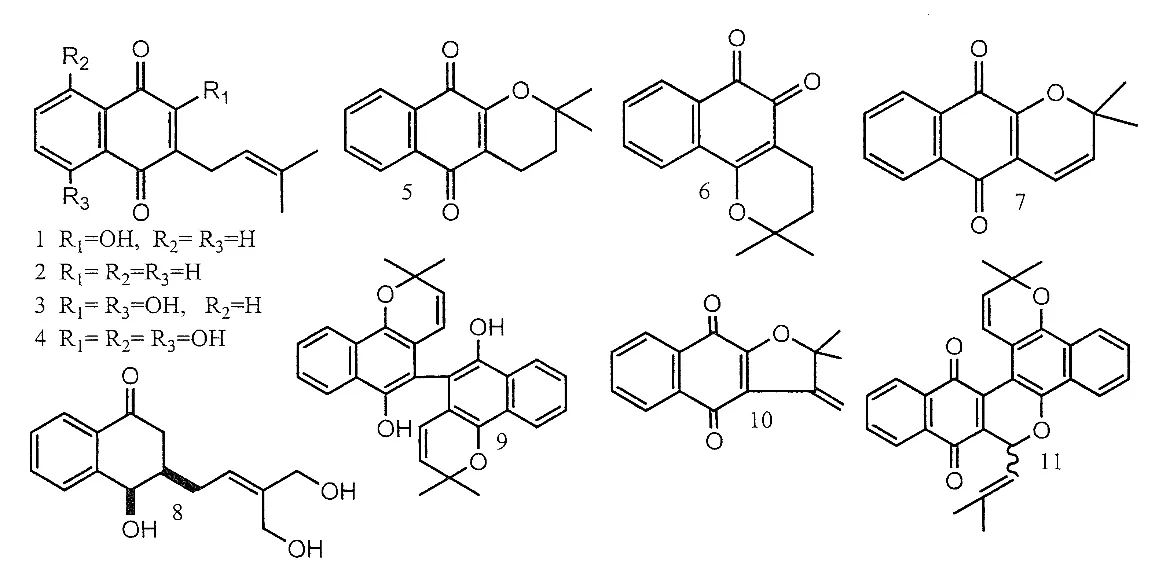
图1 萘醌类化合物的化学结构Fig. 1 Chemical structures of naphthoquinones

图2 蒽醌类化合物的化学结构Fig. 2 Chemical structures of anthraquinones

图3 萜类化合物的化学结构Fig. 3 Chemical structures of terpenoids

图4 脱辅基类胡萝卜素类化合物的化学结构Fig. 4 Chemical structures of apocarotenoids
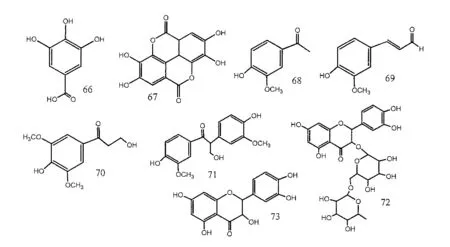
图5 酚类(66-71)和黄酮类化合物(72-73)的化学结构Fig. 5 Chemical structures of phenolic compounds (66-71) and flavonoids (72-73)

图6 类固醇、皂苷类化合物的化学结构Fig. 6 Chemical structures of steroids & saponins
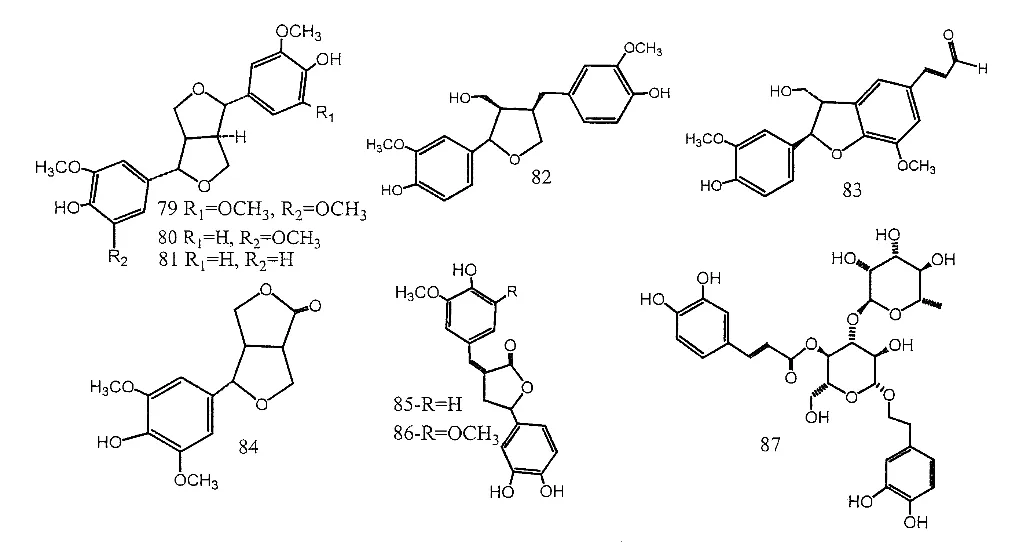
图7 苯丙素类化合物和苯乙醇苷类化合物Fig. 7 Chemical structures of phenylpropanoids (79-86) & phenylethanoid glycoside (87)
3 柚木植物化学与药理特性
100 多年来,人们发现柚木木材,特别是心材,对植物和动物寄生虫的天然抵抗力很高。Romanis在1887 年首次发表了关于柚木化学性质的论文,从提取液中分离出甲基蒽醌[19]。甲基蒽醌对白蚁Termitidae 有“拒避作用”[20],不同柚木样品的抗性随着甲基蒽醌浓度的升高而增强[21]。柚木中还检测到3-羟基-2-甲基蒽醌、1-羟基-2-甲基蒽醌、2-羟甲基镧醌[22],和1,4-二羟基-2-甲基蒽醌或2-甲基喹唑啉[23]、蒽醌-2-甲醛和蒽醌-羧酸也对白蚁具有“拒避”和毒性作用。虽然这些物质在木材中的平均含量较低,但柚木木材的耐腐朽特性也起到一定的辅助作用。Sandermann 和Dietrichs 进一步分离出和对白蚁有“拒避”和毒性作用的萘醌和脱氧拉帕醇[21]。脱氧拉帕醇和拉帕醇均可引起白蚁的接触性过敏,但后者的作用比前者低100~200 倍[24]。柚木中另外两种有趣的提取物是柚木醇和脱氢柚木醇[25]。Khanna 建议改称脱氢柚木醇为柚木醌I 型[26]。柚木心材内含有一种碳氢化合物天然橡胶[27],这是柚木耐水侵蚀和化学攻击的原因,木材干缩率低[28-29]。柚木另一个重要发现是从叶子中分离出具有植物毒性化合物[30-31]。Lacret 等评估了从柚木叶中分离出的萘醌的化感作用[32]。
在过去的几十年里,关于不同柚木植株器官的药理作用已有很多研究。通过活体动物试验,柚木叶片、木材、心材、根部、树皮等不同介质提取液具有广泛药用效果,包括促进伤口愈合、降血糖、消炎抗菌、镇痛退热、生发以及抗肿瘤等作用。
3.1 伤口愈合
柚皮叶片广泛用于治疗伤口,尤其是烧伤[9]。通过柚木叶片的盐酸提取物对白鼠Rattus norregicus 实验性的切除伤口、切口伤口、烧伤伤口和坏死伤口4 种处理的恢复进行评价。在切除伤口和烧伤伤口处理中,叶片提取物处理后,上皮形成和伤口收缩时间显著减少50%。在切口伤口处理中,观察到断裂强度显著增加,坏死伤口处肉芽组织的断裂强度、干重和羟脯氨酸含量显著增加。柚皮叶提取物局部施用(5%和10%凝胶制剂)或口服施用(250、500 mg/kg)具有显著的伤口愈合活性[33]。
3.2 降血糖
柚木在印度被作为降血糖药的胰岛素草药。活体动物实验表明柚木花朵、树皮等提取液具有潜在的抗高血糖活性[34-36]。对大鼠(Rattus norvegicus)进行柚木急性毒性研究,施用柚木花朵甲醇提取液100和200 mg/kg 显著降低了OGTT 和STZ 诱导的糖尿病大鼠的血糖水平(P<0.001)。两种剂量柚木处理均显著增加糖尿病大鼠的体重、血清胰岛素、血红蛋白和总蛋白水平。柚木花朵甲醇提取液处理显著降低了糖尿病大鼠糖化血红蛋白(HbA1c)和其他生化参数水平 (P<0.001)。用柚木治疗糖尿病大鼠,它们的脂质分布和抗氧化剂水平被逆转至接近正常[34]。
3.3 消炎抗菌
Bitchagno,等[37]采用质谱(MS)与核磁共振(NMR)技术,并与已知数据对比,分离鉴定了柚木果实含有的3 种抗菌化合物化合物,包括2 种醌和1 种三萜,分别被鉴定为鸢尾酮、6-甲基-1,4-二羟基蒽醌和2β-羟基熊果酸。使用微稀释法对分离的化合物以及粗乙醇提取物对4 种革兰氏阴性细菌菌株进行了抗菌活性测试,结果表明粗乙醇提取物最低抑菌浓度为64~256 mg/mL 时,对测试的细菌菌株表现出良好活性。在分离的代谢产物中,6-甲基-14-二羟基蒽醌对产气杆菌有很强的活性,最低抑菌浓度为16 mg/mL,而鸢尾酮对大肠杆菌的最低抑菌浓度为32 mg/mL。
3.4 镇痛退热
采用活体白鼠实验表明柚木具有潜在的镇痛活性。在辐射加热法中,柚木木材提取液(100、200、400 mg/kg)和标准药物(丁丙诺啡)的反应时间呈剂量依赖性增加。在扭体试验中,柚木木材提取液(200、400 mg/kg)和阿司匹林减少了扭体次数,与对照组相比有显著性差异(P<0.01,P<0.001)。在大鼠足跖水肿试验中,柚木木材提取液(200、400 mg/kg)和阿司匹林显示出对水肿的20%、40%、54%的抑制率,与4 小时后的对照组相比,差异显著(P<0.05、P<0.01、P<0.001)。在肉芽肿袋法中,不同柚木木材提取液(100、200、400 mg/kg)和阿司匹林对水肿的抑制率分别达到13.33%、22.22%、33.33%和66.66%[38]。
3.5 细胞毒性
柚木中分离的5-羟基-拉帕醇和拉帕醇对盐水虾Artemia salina 具有高致死率,50%的致死率剂量为5 ppm[39]。这两种化合物都被发现具有细胞毒性。其他研究指出柚木还存在其他有细胞毒性的化合物如脱氢-α-拉帕醌、白桦酸等[23],对研制抗癌细胞的植物源新药具有启发性意义[40]。
3.6 生发
柚木的种子在印度传统医学体系中被誉为生发药,然而缺乏可靠的科学研究限制了它们的使用。Jaybhaye,等[17]评估了柚皮种子的石油醚提取液对白鼠毛发生长的影响。将5%和10%提取物加入到简单软膏基质中,施用到白化小鼠剃光的裸露皮肤上。记录开始毛发生长和完成毛发生长周期所需的时间。米诺地尔(Minoxidil)2%溶液局部使用,作为阳性对照。2%的米诺地尔溶液促进49%头发生长。与对照相比,使用提取液处理后毛发生长起始时间显著缩短50%。与标准米诺地尔相比,该治疗成功地使更多的毛囊(64%、51%)近入生长期。
3.7 抗肿瘤
从柚木中分离的拉帕醇对活体白鼠的癌症肿瘤具有高度显著活性[41]。利用6~8 周龄的携带肿瘤细胞的瑞士雌性白鼠,评估了拉帕醇单独的抗肿瘤效果和与辐射的结合的效果。对雌性小鼠进行肿瘤细胞腹腔注射,设置不同浓度拉帕醇(50、100 mg/kg)单独治疗处理、γ 射线3 个、6 个剂量的辐射处理、拉帕醇结合辐射处理共3 种处理。将治愈率和体重变化百分比作为抗肿瘤活性评估的参数。结果表明,用拉帕醇或γ 射线照射的白鼠治愈率均有所增加,但拉帕醇和辐射联合治疗的动物组中,治愈率显著增加,与拉帕醇浓度和辐射剂量呈正相关。体重变化百分比也发生了显著变化(P<0.05)[42]。
癌细胞转移是癌症患者死亡的主要原因[43]。通过体内试验评估了柚木提取液中分离出的萘醌对人体癌细胞的影响以及作为抗转移药物的潜力。结果表明,萘醌对Hela 细胞的最大无毒浓度为400 μg/mL,萘醌可诱导蛋白质谱的改变并抑制细胞侵袭性,表明其具有重要的抗转移活性[44]。
4 研究展望
柚木作为全球范围重要的造林树种,以其木材价值和耐腐朽特性而闻名。柚木具有广泛的药理学特性,如促进伤口愈合、抗菌、抗氧化、消炎、细胞毒性和促进毛发生长等。除此之外,由于柚木的植物毒性活性,其种植也已成为可持续农业害虫控制的有效工具。需要注意的是,药理学和植物化学研究是独立进行的,缺乏活性分子分离的鉴定。因此,将来要进行更多的研究来将它的药理活性与化学成分联系起来,以便开发有希望的潜在候选药物。基于这一批判性综述,可以得出结论,有足够的科学证据表明,柚木是一种重要的生物活性化合物来源。因此,国内特别是柚木种植区利用叶片、树皮、树根等材料开发抑菌剂、消炎药、生发洗发水等药品和日用化学品有巨大潜力,在传统医药学上的应用也许更加重视。根据植物间的拮抗效应开发生态型杀虫剂和除草剂也是柚木非木材产品研发的一个重要方向。
