卵泡液中细胞外囊泡及其携带的microRNA对卵泡发育的作用
2020-05-07王亨琴王晓梅孟凯公绪同王莹张涌权富生
王亨琴,王晓梅,孟凯,公绪同,王莹,张涌,权富生
·综 述·
卵泡液中细胞外囊泡及其携带的microRNA对卵泡发育的作用
王亨琴,王晓梅,孟凯,公绪同,王莹,张涌,权富生
西北农林科技大学 动物医学院 农业部动物生物技术重点实验室,陕西 杨凌 712100
细胞外囊泡(Extracellular vesicles,EVs) 是指细胞分泌的双层膜转运囊泡。EVs能从细胞中摄取大分子物质,并将其转移至受体细胞。在这些大分子物质中,研究最多的就是microRNA (miRNA)。miRNA是一种参与基因表达调控的非编码RNA,已证实在哺乳动物卵泡液EVs中有不同的非编码RNA存在,EVs携带miRNA可以作为自分泌和旁分泌的替代机制,影响卵泡发育。文中系统介绍了EVs的种类、特征和分离鉴定方法,重点综述了EVs及携带的miRNA对卵泡发育的作用,包括早期卵泡发育、卵母细胞成熟、卵泡优势化以及对颗粒细胞功能的影响。同时对卵泡液中EVs及其携带的miRNA的未来研究进行了展望,为卵泡液中EVs及携带的miRNA功能的研究及应用提供了思路和方向。
卵泡液,细胞外囊泡,microRNA,卵泡发育
细胞外囊泡(EVs) 是指细胞内携带的大分子物质转运至细胞外发挥生物学功能的双层膜囊泡。EVs的释放和摄取是细胞间通讯的新机制,其分离纯化及内容物(主要组成物质) 功能的研究已成为现代生物技术领域研究的一个热点。
卵巢是雌性哺乳动物的生殖器官,其一个重要功能是产生卵泡和维持卵泡发育,卵泡发育到足够大小排出成熟卵子,进行后代繁殖。卵泡发生的过程涉及体细胞与卵母细胞之间广泛的细胞间通讯,卵泡膜细胞、颗粒细胞和卵母细胞在整个卵泡生长和成熟过程中分泌多种因子,这些因子对卵泡发育至关重要。卵泡液中存在EVs,并对卵巢功能产生深远影响。EVs中含有一些重要的miRNA,它可以在卵母细胞和周围的体细胞之间穿梭。目前对EVs中的miRNA在卵泡发育和卵母细胞成熟中的具体作用机制还知之甚少,但最近的研究清楚地表明,EVs及其内miRNA可以影响卵泡的发育和卵母细胞的成熟。文中对卵泡液中EVs和miRNAs进行了总结,重点介绍了其调控卵泡发育及相关生物学功能的最新发现,以期为相关领域研究的同行提供参考。
1 细胞外囊泡概述
1.1 细胞外囊泡的种类和特征
EVs是由原核生物和真核生物释放的膜结构囊泡[1-3],包含多种生物活性分子——蛋白质、脂质和RNA[4-5]。EVs已被证明含有蛋白质、脂质(特别是高水平的鞘磷脂)、DNA和各种RNA,包括mRNA和非编码RNA (miRNA、circRNA和lncRNA等)[6]。EVs膜上存在多种蛋白质,包括四跨膜蛋白(CD63、CD9、CD81等)、热休克蛋白(Hsp70) 和糖磷脂酰肌醇锚定蛋白等[7-10]。研究者已经分别从精液、附睾、输卵管、子宫液和卵泡液中分离出了EVs[11-14]。EVs在大小、分子含量、生物遗传起源、性质和生物活性方面均具有高度异质性。
EVs是细胞外生物流体中发现的所有类型的囊泡的统称[15]。EVs的种类主要包括微泡(Microvesicle)、外泌体(Exosome,EXO) 和凋亡小体。微泡也被称为脱落囊泡,是细胞激活、损伤或凋亡后从细胞膜脱落的小囊泡。微囊泡生物发生涉及大分子运输到质膜、膜脂质的重新分布,以及表面的机械收缩以允许囊泡释放。由于微泡是通过从质膜出芽形成的,分子直径可达100– 1 000 nm[16-18]。外泌体与微泡相似,也是膜包围的小泡,但外泌体储存在多泡体(Multivesicular body,MVB) 中,当MVB与质膜融合时,这些外泌体又释放到细胞外环境中[19](图1)。外泌体直径为50–150 nm,尺寸分布较均匀,在电子显微镜下呈现出均一的、茶托状结构[16](图2)。凋亡小体是细胞凋亡后期释放至胞外微环境的微粒,富含死细胞碎片特有的凝聚DNA。凋亡小体尺寸分布不均匀,直径为800–5 000 nm[6,20-22]。由于微泡、外泌体和凋亡小体存在尺寸范围的重叠,提取到的囊泡通常尺寸不均匀且难以区分其不同亚型,因此将所分离得到的囊泡统称为EVs。
EVs对受体细胞的作用方式包括表面上的分子通过粘附到受体细胞表面的脂质和配体上,使整个囊泡内化到受体细胞中,或EVs的膜与受体质膜融合,从而将内容物释放入受体细胞,实现与受体细胞的信息传递[6,23]。通过上述方式,EVs中的mRNA和miRNA可以转移到靶细胞[24],说明这些囊泡能够远距离运输并与靶细胞之间进行信息交换。
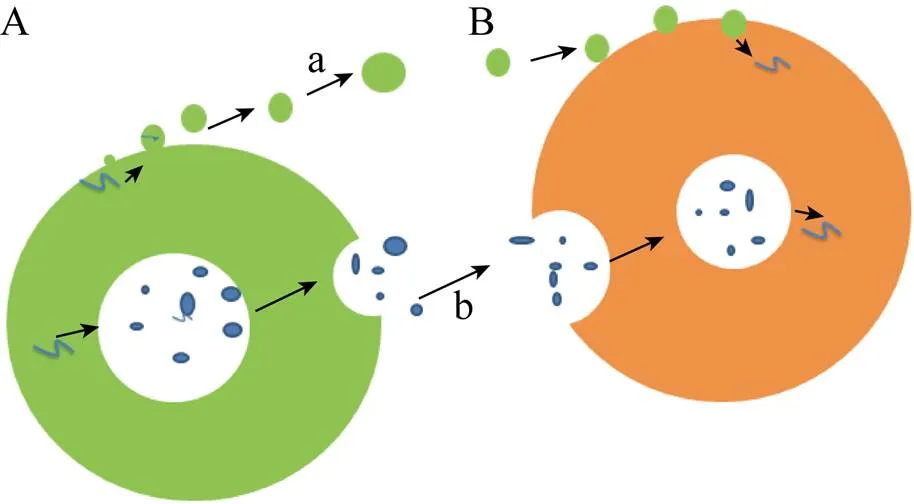
图1 细胞外囊泡的释放

图2 外泌体的典型特征[25]
1.2 细胞外囊泡的分离纯化与鉴定
1.2.1 细胞外囊泡的分离纯化
EVs存在于不同器官或者组织的体液中,这些生物液体含有多种非囊泡性大分子结构,可能会对EVs的分析结果产生影响。因此,EVs分离纯化非常重要。现有的分离纯化方法主要包括传统的高通量方法(如超速离心、密度梯度离心、沉淀法、分子排阻法、场流分级法) 和新方法(如微流控法、非接触法、免疫吸附法)。
超速离心是分离EVs最常用的传统方法[26]。先用细胞碎片在低离心力(300×) 去除细胞和细胞碎片,再用高离心力(100 000×) 对EVs进行沉淀和浓缩[27]。超速离心法是现在最广泛使用的“金标准”,适用于从大量样品中纯化EVs。密度梯度离心是基于超速离心的、更严格的形式,密度梯度离心根据EVs的密度(1.15–1.19 g/mL) 将其进一步纯化[28]。在该方法中,含有不同尺寸的囊泡和大分子的样品层叠在梯度的表面上,其密度从顶部到底部逐渐增加。在离心过程中,不同的分子以不同的速率沉淀在梯度中,该方法被认为产生更高纯度的EVs。Li等改良了密度梯度离心法实现了EVs与非囊泡颗粒分离,回收率更高、纯度更高,并且结构和功能保持更好[29]。
除超速离心和密度梯度离心之外,沉淀法(商业试剂盒) 和尺寸排阻色谱法也较为常用。商业试剂盒会降低EV的水合作用从而引起沉淀,沉淀的EVs产品可以通过低离心力分离[30]。但这种试剂盒还会产生非均相聚合物颗粒,对于EVs而言缺乏特异性。尺寸排阻色谱法通过凝胶过滤不同大小的分子,从而根据分子尺寸将EVs和其他分子分离[31]。该分离方法最近已应用于囊泡分离,从而从复杂的生物介质中产生纯化的EV。具体应用时,应考虑若干因素,包括介质类型、孔径和EVs与介质之间的相互作用等,以提高分离的效率和分辨率。
新的分离纯化方法主要有微流体过滤法、非接触法和免疫亲和富集法等。与传统方法相比,这些新方法所需样本量较少,且所需时间较短[25]。
1.2.2 细胞外囊泡的纯度鉴定
在EVs的纯度鉴定方面,其常用的检测方法主要包括透射电镜法、纳米粒径分析法(Nanosight)、Western blotting、流式细胞术法等。
其中,透射电子显微镜分辨率较高,能够观察到EVs典型的结构(均一的、茶托状结构)[28]。此外,扫描电子显微镜、低温电子显微镜原子力显微镜[28]等均可显示出典型的EVs的形态。Nanosight可反映EVs的粒径分布,用于确定粒子的浓度和粒度分布。光束用于照射样品中的颗粒,当粒子散射光并经历布朗运动时,摄像机记录 每个粒子的路径以确定平均速度和扩散率,从而得出其浓度和粒径分布[32]。EVs蛋白评估(如Western blotting) 用于证明样品中EVs相关的靶蛋白(如CD63和TSG101等) 的存在[33]。虽然该方法耗时较长,但可以对样品中靶蛋白定性,从而鉴定EVs纯度。流式技术能够实现高通量、单颗粒,同时检测多个参数[28],是目前最有潜力应用于临床的外泌体分析技术。
1.3 细胞外囊泡内容物及其对卵泡发育的作用
来自供体细胞的携带有生物活性分子的EVs可利用体液到达靶细胞并递送其内容物。EVs可以作为蛋白质和脂质传递的载体,是细胞间运输和通讯的一种重要机制。尽管如此,目前对EVs介导的细胞间通讯的了解仍然有限,许多问题尚未解决。在其他细胞模型中,已经证明EVs能够转移miRNA、mRNA、线粒体DNA和蛋白质[34–36]。
研究表明,EVs可以分泌多种细胞因子[37]。而细胞因子是卵巢生理学的关键调节因子,特别是与卵泡发生和排卵有关,细胞因子发挥多种生物学功能,从而建造支持卵泡发育的环境。某些细胞因子如TGF-β超家族成员,能够参与卵泡发生的所有阶段[38]。但是,细胞因子及其相互作用的研究仍不完整,细胞因子调控卵泡发育的研究还比较匮乏,EVs中细胞因子对卵泡发育的作用研究仍存在很大挑战。
对于miRNA调控卵泡发育的研究则较为丰富,miRNA对人类和其他物种卵泡发育的调控作用至关重要。牛动情周期第7天从属卵泡和优势卵泡的颗粒细胞miRNA表达模式显示颗粒细胞miRNA的表达可能与牛动情周期早期卵泡期的卵泡募集、选择和优势化相关[39]。对牛大卵泡和小卵泡中颗粒细胞miRNA的表达比较,显示大卵泡中富含的miRNA参与卵泡细胞增殖、类固醇生成,从而预防因黄体退化引起的早产[40]。因此,miRNA可随卵泡发育阶段的不同而表现出差异表达,从而参与卵泡发育调控。
EVs和miRNA代表了一种细胞间通讯的新机制,即细胞可以通过EVs传递miRNA。有研究者分别收集了人血浆与卵泡液中的EVs,并统计了两者之间差异表达的miRNA,该研究结果显示,人类卵泡液中与血浆相比上调的37种miRNA在卵泡液中上调,且其中32个miRNA由外泌体携带[41]。da Silveira及其同事在马卵泡液中对EVs进行了鉴定[42]。Sohel等从牛卵泡液中分离出EVs,并证明EVs能够转运miRNA,且生长卵母细胞和成熟卵母细胞的卵泡液EVs miRNA差异表达[43]。另有研究者证明了EVs存在于牛卵泡液中,且随着卵泡大小的变化,卵泡液所含的EVs miRNA存在动态变化,即随着卵泡直径的增加,5种miRNA (miR-204、miR-92b、miR-328a-3p、miR-424-3p和miR-450a) 的表达显著增加;2种miRNA (miR-19a-3p和miR-335) 表达显著减 少[44]。除此之外,牛卵泡液中的外泌体和非外泌体转运均对卵母细胞发育产生重要影响,这些影响是通过一系列miRNA起作用的[43]。
2 细胞外囊泡中的miRNA在卵泡发育中的作用
细胞外囊泡中含有miRNA,其中某些miRNA参与卵泡发育过程[44-45]。文中对已经公开发表的、已证实存在于EVs的miRNA及其对卵泡发育的作用进行了总结(表1),并对其作用机制进行了概述(表2)。以下将进行详细探讨。
表1 细胞外囊泡中的miRNA在卵泡发育中的作用

Table 1 Role of miRNAs in extracellular vesicles in follicular development

表2 细胞外囊泡中miRNA的作用机制
2.1 细胞外囊泡中的miRNA影响原始卵泡的形成和发育
牛卵泡液EVs中含有多种miRNA,并且miRNA的种类和数目随着卵泡直径的增加有着显著差异。研究分析大、中、小卵泡(大卵泡直径>9mm,中卵泡直径6–9 mm,小卵泡3–5 mm) miRNA含量的不同,发现在小卵泡中miR-143的表达量是大卵泡中表达量的2倍以上[44]。在此之前,研究者探究了miR-143在小鼠卵巢原始卵泡形成期间的表达和功能。从受精后15.5 d到产后4 d,miR-143表达在原始卵泡形成期间持续增加。进一步的研究表明,miR-143通过抑制前颗粒细胞的增殖和下调与细胞周期相关的基因(、、) 和蛋白激酶基因(、) 的表达来抑制原始卵泡的形成[46]。
Andade及其同事研究了牛卵泡中miRNA的来源,主要涉及细胞和EVs这两种来源,其中,miR-145主要存在于卵丘-卵母细胞复合物分泌的EVs中,而未在颗粒细胞分泌的EVs中发现[47]。有研究者分析了新生小鼠卵巢中miRNA的表达模式,鉴定了在3日龄和5日龄小鼠的卵巢之间丰度差异显著的24种miRNA,结果显示48个信号转导途径受上调的miRNA调节,29个途径受下调的miRNA调节,并建立了TGF-β信号通路相关基因的miRNA-mRNA调节网络,在参与该途径的miRNA中,选择miR-145用于进一步分析。使用RNA拮抗剂(AT) 组中原始卵泡的平均卵母细胞直径显著高于AT阴性对照(AN) 组,而AT组中生长卵泡的平均卵母细胞直径小于AN组。同时,研究显示miR-145 AT显著降低卵泡发育相关基因(、和) 的mRNA表达水平,表明miR-145的下调降低了卵母细胞生长的能力。miR-145的增加会导致靶基因的表达降低和下游Smad信号传导途径的抑制,以抑制原始卵泡发育的起始并维持原始卵泡池的休眠[48]。小鼠上miR-145的下调使原始卵泡数量显著减少和卵泡生长增加,在有腔卵泡的卵泡液EVs中的miR-145是否也有相似的作用,从而调控原始卵泡的形成和发育以及有腔卵泡的发育,目前还不得而知。
2.2 细胞外囊泡中的miRNA影响卵母细胞发育和卵泡优势化
在早期卵泡发育中,存在于卵丘-卵母细胞复合物分泌的EVs中的miR-145除了表现出对原始卵泡池的抑制之外,还在牛的优势卵泡和从属卵泡中表现出差异表达,在从属卵泡中含量更高。miR-145在卵母细胞的生长期表现出较大的转录活性,这就暗示其与卵泡发育和优势化有关[43]。而在分子水平上,使用miR-145 RNA拮抗剂(AT) 组显著降低了小鼠卵泡发育相关基因(、和) 的mRNA表达水平[48],表明miR-145的下调降低了卵母细胞生长的能力,miR-145与卵泡的发育和优势化密切相关。
除了miR-145以外,miR-212、miR-132、miR-224、miR-378和miR-21均在马优势卵泡和从属卵泡中差异表达,且在从属卵泡中,miR-145、miR-132和miR-378的水平更高[43,49-50]。其中,miR-132能在牛颗粒细胞分泌的EVs中检测到[47]。MiR-132在牛大卵泡(直径>9 mm) 细胞外囊泡的含量是小卵泡(直径3–5 mm) 的17倍[44]。
在牛卵泡液EVs中,miR-378随着卵泡增大含量降低,小卵泡(直径3–5 mm) 中的含量是大卵泡(直径>9 mm) 的2倍以上[44],且从属卵泡的含量显著高于健康生长的优势卵泡[43]。未排卵卵泡的miR-378水平较高,而IGF1水平较低[49]。在卵丘卵母细胞成熟期间,卵丘细胞中miR-378的过度表达削弱了与卵丘扩张相关基因(、) 和卵母细胞成熟相关基因(、、) 的表达[51]。上述结果表明,在卵丘细胞中,miR-378的表达能够抑制卵丘卵母细胞复合体的扩张和卵母细胞成熟。
与miR-378类似,随着卵泡的增大,牛卵泡液EVs中miR-21的含量也逐渐降低[44],且同样地,在牛从属卵泡与未排卵卵泡中miR-21含量居高,优势卵泡中含量较低[43]。
综上所述,卵泡液EVs中存在miR-145、miR-21、miR-132和miR-378,与优势卵泡相比这4种miRNA均在马的从属卵泡中含量较高。但用排卵剂量的hCG处理优势卵泡得到黄体化卵泡后,miR-132和miR-21含量均大幅上升,更有趣的是,和等基因在黄体化卵泡中含量与优势化卵泡相比则大幅降低[49]。这几种基因与上述miRNA是否存在靶向关系从而调控马卵泡发育和优势化还不清楚。
2.3 细胞外囊泡中的miRNA影响颗粒细胞功能
2.3.1 细胞外囊泡中的miRNA影响颗粒细胞增殖和凋亡
颗粒细胞的增殖与凋亡对卵泡发育至关重要,EVs及其内部的miRNA对颗粒细胞增殖与凋亡有重要影响。miR-145存在于牛卵泡液EVs中[47]。对小鼠的研究表明,miRNA-145靶向,通过调节Tgf-β信号通路,抑制颗粒细胞增殖[52]。除此之外,miR-145还可保护小鼠颗粒细胞免受氧化应激诱导的细胞凋亡。体外实验证明,H2O2处理KGN细胞和小鼠颗粒细胞显著下调了miR-145表达,而miR-145过表达可以减弱H2O2诱导的颗粒细胞凋亡[52]。此外,小鼠上的研究也证明,miR-145通过靶向保护颗粒细胞免受H2O2诱导的细胞凋亡[53]。总之,miR-145在小鼠上通过靶向调控Tgf-β信号通路,抑制颗粒细胞增殖,通过靶向保护颗粒细胞免受氧化应激诱导的细胞凋亡从而防止卵泡闭锁异常,并可改善卵巢功能。
牛卵泡液细胞外囊泡中已证明含有miR-21[43]。在小鼠上也证明,miR-21被确定为增殖性颗粒细胞向终末分化的黄体细胞转变所需的重要因子,小鼠miR-21的敲除导致排卵率下降,颗粒细胞中miR-21的缺失促进了细胞凋亡,而miR-21的表达增加则对细胞凋亡具有保护作 用[54]。在大鼠中,去甲肾上腺素(NE) 以剂量依赖性方式调节初级颗粒细胞中miR-21的表达,miR-21参与NE介导的大鼠颗粒细胞凋亡,并通过靶向阻断颗粒细胞凋亡[55]。上述研究均证明了miR-21在小鼠和大鼠颗粒细胞中有抗细胞凋亡作用。
牛卵泡液细胞外囊泡中也证明同时表达miR-26b[43]。透明质酸合成酶2 (HAS2)-透明质酸(HA)-CD44-Caspase-3途径参与哺乳动物的颗粒细胞功能的调节,miR-26b靶向基因调控HAS2-HA-CD44-Caspase-3信号通路进而促进猪颗粒细胞凋亡[56]。同样地,miR-26b调节猪颗粒细胞凋亡还有其他途径。Smad4是转化生长因子β1 (Tgf-β1) 信号通路的中枢介质,与哺乳动物的生殖能力和卵巢卵泡的发育密切相关,的敲低增加了GCs的凋亡[57]。有研究发现miRNA-26b靶向基因的3′非翻译区,抑制了mRNA和蛋白质水平,促进颗粒细胞凋亡[58]。以上研究表明了miR-26b可通过调控Tgf-β信号传导途径中Smad4的表达而在颗粒细胞中具有促凋亡作用。另外研究者针对健康卵泡,早期闭锁和已经闭锁的猪卵泡构建miRNA表达谱,并选择和分析差异表达的miRNA,发现在猪卵泡闭锁期间上调的miR-26b通过靶向(Ataxia telangiectasia-mutated gene) 增加了DNA断裂的数量并促进了颗粒细胞的凋亡[59]。但是这些miRNA是否来源于猪卵泡液EVs,还有待于进一步证实。
2.3.2 细胞外囊泡中的miRNA影响颗粒细胞类固醇生成
颗粒细胞类固醇生成对卵泡发育至关重要。有研究表明,miR-378在小卵泡EVs中的含量是大卵泡的2.4倍,且随着卵泡增大而逐渐减少[44]。体外过表达和抑制实验表明,猪miR-378通过靶向的3′ UTR内的特定位点,降低猪颗粒细胞中Cyp19a1蛋白表达和雌二醇产生,卵丘细胞中的Cyp19a1表达也被miR-378抑制,导致雌二醇产生显著降低[60]。3′ UTR中的2个结合位点被鉴定并确认为猪miR-378的结合位点[51,60]。
MiR-132存在于牛颗粒细胞分泌的EVs 中[43-44],可以对颗粒细胞类固醇生成产生重要影响。Nurr1是一种抑制Cyp19a1表达的孤核受 体[61]。对小鼠的研究证明,是miR-132的直接靶标,miR-132通过抑制,显著促进Cyp19a1的表达和雌二醇的分泌[62]。
3 EVs未来研究展望
EVs及其携带的miRNA已证明在卵泡发育过程中发挥了重要作用,其调控关系较为复杂。但是,对于卵泡液中EVs及携带的miRNA的功能研究还较为匮乏。现根据国内外研究现状和本实验室开展的工作,对卵泡液EVs及携带的miRNA的相关研究提出以下研究内容和研究方向:(1) 卵泡液中的EVs如何有选择性地随着卵泡发育摄取有利于卵泡发育的miRNA和其他内含物,影响卵母细胞发育进程和质量。(2) 不同物种卵泡液EVs特异性miRNA的筛选和鉴定以及作用途径的研究。(3) 卵泡液中EVs特异性miRNA在卵泡发育、卵泡优势化以及卵母细胞成熟过程中是否是通过进入卵泡不同受体细胞发挥多种生物学功能?(4) 卵泡液EVs及携带的miRNA的作用调控机制以及涉及的相关信号通路的研究。(5) 卵泡液EVs其他内容物对卵泡发育的作用研究。卵泡液EVs是否可以通过携带的其他内容物,如蛋白质、脂质体、lncRNA、circRNA等影响卵泡发育以及卵母细胞成熟等功能。(6) 卵泡液EVs其他内容物与卵泡液中EVs miRNA的互作研究。卵泡液中存在EVs还有特异性的蛋白质和其他成分,这些成分与miRNA如何互作、如何协同发挥作用也是未来需要研究的内容和关注的重点。(7) 动物体激素、抗原、细胞因子以及其他外源性的物质是否对卵泡液EVs的成分和功能产生影响?如何发挥作用和调控?
由于miRNA与靶基因间相互作用的复杂性以及不同物种间miRNA作用途径的差异性,卵泡液EVs及携带miRNA的功能研究任重而道远。但充分认识卵泡液EVs及携带的内容物对卵泡发育的作用、提高卵母细胞质量、充分利用家畜卵巢资源以及提高人类辅助生殖水平将有重要意义。
[1] Liu SL, Zhan YT, Luo JD, et al. Roles of exosomes in the carcinogenesis and clinical therapy of non-small cell lung cancer. Biomed Pharmacother, 2019, 111: 338–346.
[2] Oliveira DL, Nakayasu ES, Joffe LS, et al. Characterization of yeast extracellular vesicles: evidence for the participation of different pathways of cellular traffic in vesicle biogenesis. PLoS ONE, 2010, 5(6): e11113.
[3] Mantel PY, Marti M. The role of extracellular vesicles inand other protozoan parasites. Cell Microbiol, 2014, 16(3): 344–354.
[4] Willms E, Cabañas C, Mäger I, et al. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Front Immunol, 2018, 9: 738.
[5] Camussi G, Deregibus MC, Tetta C. Paracrine/endocrine mechanism of stem cells on kidney repair: role of microvesicle-mediated transfer of genetic information. Curr Opin Nephrol Hypertens, 2010, 19(1): 7–12.
[6] Théry C, Ostrowski M, Segura E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol, 2009, 9(8): 581–593.
[7] Wubbolts R, Leckie RS, Veenhuizen PTM, et al. Proteomic and biochemical analyses of human B cell-derived exosomes: potential implications for their function and multivesicular body formation. J Biol Chem, 2003, 278(13): 10963–10972.
[8] Laulagnier K, Motta C, Hamdi S, et al. Mast cell- and dendritic cell-derived exosomes display a specific lipid composition and an unusual membrane organization. Biochem J, 2004, 380(1): 161–171.
[9] Subra C, Laulagnier K, Perret B, et al. Exosome lipidomics unravels lipid sorting at the level of multivesicular bodies. Biochimie, 2007, 89(2): 205–212.
[10] Harding CV, Heuser JE, Stahl PD. Exosomes: looking back three decades and into the future. J Cell Biol, 2013, 201(3): 485.
[11] Hung WT, Navakanitworakul R, Khan T, et al. Stage-specific follicular extracellular vesicle uptake and regulation of bovine granulosa cell proliferation. Biol Reprod, 2017, 97(4): 644–655.
[12] Hung WT, Hong X, Christenson LK, et al. Extracellular vesicles from bovine follicular fluid support cumulus expansion. Biol Reprod, 2015, 93(5): 117.
[13] Saez F, Frenette G, Sullivan R. Epididymosomes and prostasomes: their roles in posttesticular maturation of the sperm cells. J Androl, 2003, 24(2): 149–154.
[14] Al-Dossary AA, Strehler EE, Martin-DeLeon P. Expression and secretion of plasma membrane Ca2+-ATPase 4a (PMCA4a) during murine estrus: association with oviductal exosomes and uptake in sperm. PLoS ONE, 2013, 8(11): e80181.
[15] Lötvall J, Hill AF, Hochberg F, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. J Extracell Vesicles, 2014, 3(1): 26913.
[16] O’Brien J, Hayder H, Zayed Y, et al. Overview of MicroRNA biogenesis, mechanisms of actions, and circulation. Front Endocrinol (Lausanne), 2018, 9: 402.
[17] Yin PB, Lv HC, Li Y, et al. Exosome-mediated genetic information transfer, a missing piece of osteoblast-osteoclast communication puzzle. Front Endocrinol (Lausanne), 2017, 8: 336.
[18] van Niel G, D’Angelo G, Raposo G. Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol, 2018, 19(4): 213–228.
[19] Navarro-Tableros V, Gomez Y, Camussi G, et al. Extracellular vesicles: new players in lymphomas. Int J Mol Sci, 2019, 20(1): 41.
[20] Crescitelli R, Lässer C, Szabó TG, et al. Distinct RNA profiles in subpopulations of extracellular vesicles: apoptotic bodies, microvesicles and exosomes. J Extracell Vesicles, 2013, 2(1): 20677.
[21] El Andaloussi S, Mäger I, Breakefield XO, et al. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov, 2013, 12(5): 347–357.
[22] Traver S, Assou S, Scalici E, et al. Cell-free nucleic acids as non-invasive biomarkers of gynecological cancers, ovarian, endometrial and obstetric disorders and fetal aneuploidy. Hum Reprod Update, 2014, 20(6): 905–923.
[23] Record M, Subra C, Silvente-Poirot S, et al. Exosomes as intercellular signalosomes and pharmacological effectors. Biochem Pharmacol, 2011, 81(10): 1171–1182.
[24] Lv MM, Zhu XY, Chen WX, et al. Exosomes mediate drug resistance transfer in MCF-7 breast cancer cells and a probable mechanism is delivery of P-glycoprotein. Tumour Biol, 2014, 35(11): 10773–10779.
[25] Shao HL, Im H, Castro CM, et al. New technologies for analysis of extracellular vesicles. Chem Rev, 2018, 118(4): 1917–1950.
[26] Gardiner C, di Vizio D, Sahoo S, et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. J Extracell Vesicles, 2016, 5(1): 32945.
[27] Hoffman RM. Stromal-cell and cancer-cell exosomes leading the metastatic exodus for the promised niche. Breast Cancer Res, 2013, 15(3): 310.
[28] Théry C, Amigorena S, Raposo G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol, 2006, 30(1): 3.22.1–3.22.29.
[29] Li K, Wong DK, Hong KY, et al. Cushioned-density gradient ultracentrifugation (C-DGUC): a refined and high performance method for thesolation, characterization, and use of exosomes//Patel T, Ed. Extracellular RNA: Methods and Protocols. New York, NY: Humana Press, 2018: 69–83.
[30] Vogel R, Coumans FAW, Maltesen RG, et al. A standardized method to determine the concentration of extracellular vesicles using tunable resistive pulse sensing. J Extracell Vesicles, 2016, 5(1): 31242.
[31] Nordin JZ, Lee Y, Vader P, et al. Ultrafiltration with size-exclusion liquid chromatography for high yield isolation of extracellular vesicles preserving intact biophysical and functional properties. Nanomedicine, 2015, 11(4): 879–883.
[32] Shao HL, Chung J, Balaj L, et al. Protein typing of circulating microvesicles allows real-time monitoring of glioblastoma therapy. Nat Med, 2012, 18(12): 1835–1840.
[33] Lobb RJ, Becker M, Wen SW, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma. J Extracell Vesicles, 2015, 4(1): 27031.
[34] Yáñez-Mó M, Siljander PRM, Andreu Z, et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles, 2015, 4(1): 27066.
[35] Lo Cicero A, Stahl PD, Raposo G . Extracellular vesicles shuffling intercellular messages: for good or for bad. Curr Opin Cell Biol, 2015, 35: 69–77.
[36] Urbanelli L, Magini A, Buratta S, et al. Signaling pathways in exosomes biogenesis, secretion and fate. Genes (Basel), 2013, 4(2): 152–170.
[37] Kandere-Grzybowska K, Letourneau R, Kempuraj D, et al. IL-1 induces vesicular secretion of IL-6 without degranulation from human mast cells. J Immunol, 2003, 171(9): 4830–4836.
[38] Field SL, Dasgupta T, Cummings M, et al. Cytokines in ovarian folliculogenesis, oocyte maturation and luteinisation. Mol Reprod Dev, 2014, 81(4): 284–314.
[39] Salilew-Wondim D, Ahmad I, Gebremedhn S, et al. The expression pattern of microRNAs in granulosa cells of subordinate and dominant follicles during the early luteal phase of the bovine estrous cycle. PLoS ONE, 2014, 9(9): e106795.
[40] Zhang BY, Chen L, Feng GD, et al. MicroRNA mediating networks in granulosa cells associated with ovarian follicular development. BioMed Res Int, 2017, 2017: 4585213.
[41] Santonocito M, Vento M, Guglielmino MR, et al. Molecular characterization of exosomes and their microRNA cargo in human follicular fluid: bioinformatic analysis reveals that exosomal microRNAs control pathways involved in follicular maturation. Fertil Steril, 2014, 102(6): 1751–1761.e1.
[42] da Silveira JC, de Andrade GM, Nogueira MFG, et al. Involvement of miRNAs and cell-secreted vesicles in mammalian ovarian antral follicle development. Reprod Sci, 2015, 22(12): 1474–1483.
[43] Sohel MH, Hoelker M, Noferesti SS, et al. Exosomal and non-exosomal transport of extra-cellular microRNAs in follicular fluid: implications for bovine oocyte developmental competence. PLoS ONE, 2013, 8(11): e78505.
[44] Navakanitworakul R, Hung WT, Gunewardena S, et al. Characterization and small RNA content of extracellular vesicles in follicular fluid of developing bovine antral follicles. Sci Rep, 2016, 6: 25486.
[45] Machtinger R, Laurent LC, Baccarelli AA. Extracellular vesicles: roles in gamete maturation, fertilization and embryo implantation. Hum Reprod Update, 2016, 22(2): 182–193.
[46] Zhang JF, Ji XW, Zhou DD, et al. miR-143 is critical for the formation of primordial follicles in mice. Front Biosci (Landmark Ed), 2013, 18: 588–597.
[47] Andrade GM, Meirelles FV, Perecin F, et al. Cellular and extracellular vesicular origins of miRNAs within the bovine ovarian follicle. Reprod Domest Anim, 2017, 52(6): 1036–1045.
[48] Yang SH, Wang S, Luo AY, et al. Expression patterns and regulatory functions of MicroRNAs during the initiation of primordial follicle development in the neonatal mouse ovary. Biol Reprod, 2013, 89(5): 126.
[49] Donadeu FX, Schauer SN. Differential miRNA expression between equine ovulatory and anovulatory follicles. Domest Anim Endocrinol, 2013, 45(3): 122–125.
[50] Schauer SN, Sontakke SD, Watson ED, et al. Involvement of miRNAs in equine follicle development. Reproduction, 2013, 146(3): 273–282.
[51] Pan B, Toms D, Shen W, et al. MicroRNA-378 regulates oocyte maturationthe suppression of aromatase in porcine cumulus cells. Am J Physiol Endocrinol Metab, 2015, 308(6): E525–E534.
[52] Yan GJ, Zhang LX, Fang T, et al. MicroRNA-145 suppresses mouse granulosa cell proliferation by targeting activin receptor IB. FEBS Lett, 2012, 586(19): 3263–3270.
[53] Xu L, Sun HX, Zhang M, et al. MicroRNA-145 protects follicular granulosa cells against oxidative stress-induced apoptosis by targeting Krüppel-like factor 4. Mol Cell Endocrinol, 2017, 452: 138–147.
[54] Carletti MZ, Fiedler SD, Christenson LK. MicroRNA 21 blocks apoptosis in mouse periovulatory granulosa cells. Biol Reprod, 2010, 83(2): 286–295.
[55] Zhang L, Gao J, Cui S. miR-21 is involved in norepinephrine-mediated rat granulosa cell apoptosis by targeting. J Mol Endocrinol, 2017, 58(4): 199–210.
[56] Liu JY, Tu F, Yao W, et al. Conserved miR-26b enhances ovarian granulosa cell apoptosis through HAS2-HA-CD44-Caspase-3 pathway by targeting HAS2. Sci Rep, 2016, 6: 21197.
[57] Li QL, Graff JM, O’Connor A E, et al. SMAD3 regulates gonadal tumorigenesis. Mol Endocrinol, 2007, 21(10): 2472–2486.
[58] Liu JY, Du X, Zhou JL, et al. MicroRNA-26b functions as a proapoptotic factor in porcine follicular Granulosa cells by targeting Sma-and Mad-related protein 4. Biol Reprod, 2014, 91(6): 146.
[59] Lin F, Li R, Pan ZX, et al. miR-26b promotes granulosa cell apoptosis by targetingduring follicular atresia in porcine ovary. PLoS ONE, 2012, 7(6): e38640.
[60] Xu SY, Linher-Melville K, Yang BB, et al. Micro-RNA378 (miR-378) regulates ovarian estradiol production by targeting aromatase. Endocrinology, 2011, 152(10): 3941–3951.
[61] Wu YM, Ghosh S, Nishi Y, et al. The orphan nuclear receptors NURR1 and NGFI-B modulate aromatase gene expression in ovarian granulosa cells: a possible mechanism for repression of aromatase expression upon luteinizing hormone surge. Endocrinology, 2005, 146(1): 237–246.
[62] Wu SG, Sun HX, Zhang Q, et al. MicroRNA-132 promotes estradiol synthesis in ovarian granulosa cellstranslational repression of. Reprod Biol Endocrinol, 2015, 13: 94.
[63] Naji M, Nekoonam S, Aleyasin A, et al. Expression of miR-15a, miR-145, and miR-182 in granulosa-lutein cells, follicular fluid, and serum of women with polycystic ovary syndrome (PCOS). Arch Gynecol Obstet, 2018, 297(1): 221–231.
Effect of extracellular vesicles and microRNAs in follicular fluid on follicular development
Hengqin Wang, Xiaomei Wang, Kai Meng, Xutong Gong, Ying Wang, Yong Zhang, and Fusheng Quan
Key Laboratory of Animal Biotechnology, Ministry of Agriculture, College of Veterinary Medicine, Northwest Agriculture and Forestry University, Yangling 712100, Shaanxi, China
Extracellular vesicles (EVs) refer to bilayer membrane transport vesicles secreted by cells. EVs can take macromolecules from cells and transfer them to receptor cells. Among these macromolecular substances, the most studied are microRNAs (miRNAs). miRNA is non-coding RNA involved in the regulation of gene expression. It has been confirmed that there are different non-coding RNAs in mammalian follicular fluid EVs. EVs carrying miRNA can act as an alternative mechanism for autocrine and paracrine, affecting follicular development. This paper systematically introduced the kinds, characteristics and methods of isolation and identification of EVs, focusing on the effects of EVs and miRNAs on follicular development, including early follicular development, oocyte maturation, follicular dominance and effects on granulosa cell function. At the same time, the authors prospected the future research of EVs and microRNAs in follicular fluid, and provided ideas and directions for the research and application of EVs and miRNA functions in follicular fluid.
follicular fluid, extracellular vesicle, microRNA, follicular development
June12, 2019;
July25, 2019
Supported by: National Major Project (Nos. 2016ZX08007002, 2016ZX08007003).
Yong Zhang. Tel: +86-29-87080085; E-mail: zhangyong1956@nwsuaf.edu.cn
Fusheng Quan. Tel: +86-29-87080092; E-mail: quanfusheng@nwsuaf.edu.cn
10.13345/j.cjb.190250
国家科技重大专项 (Nos. 2016ZX08007002, 2016ZX08007003) 资助。
2019-08-06
http://kns.cnki.net/kcms/detail/11.1998.Q.20190805.1059.003.html
王亨琴, 王晓梅, 孟凯, 等.卵泡液中细胞外囊泡及其携带的microRNA对卵泡发育的作用. 生物工程学报, 2020, 36(4): 632–642.
Wang HQ, Wang XM, Meng K, et al. Effect of extracellular vesicles and microRNAs in follicular fluid on follicular development. Chin J Biotech, 2020, 36(4): 632–642.
(本文责编 郝丽芳)
