不同雾化吸入方案对稳定期COPD患者血清NLRP3水平改变的临床研究
2020-05-06黄志贞许惠卿赵洁敏刘凌云黄超文
黄志贞 许惠卿 赵洁敏 刘凌云 黄超文


【摘要】 目的:分析不同霧化吸入方法治疗稳定期慢性阻塞性肺疾病(COPD)的效果及对血清NLRP3水平的影响。方法:回顾性分析2018年5-10月于本院门诊就诊的50例稳定期COPD患者的临床资料。根据治疗方法不同将其分为LAMA+LABA组和ICS+LABA组,每组25例。另选取同期入院健康体检者40例为对照组。LAMA+LABA组接受格隆溴铵/富马酸福莫特罗治疗,ICS+LABA组接受布地奈德福莫特罗吸入治疗,分别于治疗前后检测两组患者的生化指标以及肺功能指标,并进行对比分析。结果:治疗前后,LAMA+LABA组及ICS+LABA组的NLRP3、IL-1β均高于对照组,FEV1%、PEF%均低于对照组,差异均有统计学意义(P<0.05);LAMA+LABA组和ICS+LABA组的NLRP3、IL-1β、FEV1%、PEF%比较,差异均无统计学意义(P>0.05);各组CRP、PCT、WBC比较,差异均无统计学意义(P>0.05)。治疗后,LAMA+LABA组及ICS+LABA组的NLRP3及IL-1β均低于治疗前,差异均有统计学意义(P<0.05)。NLRP3与IL-1β呈正相关(P<0.05),与FEV1%、PEF%呈负相关(P<0.05)。结论:COPD患者采用格隆溴铵/富马酸福莫特罗、布地奈德福莫特罗吸入雾化吸入治疗效果更为显著,临床可根据NLRP3水平评估疾病预后,指导临床治疗。
【关键词】 Nod样受体蛋白-3 慢性阻塞性肺疾病 雾化吸入 肺功能
[Abstract] Objective: To analyze the effect of different atomization inhalation methods on stable chronic obstructive pulmonary disease (COPD) and the effect on serum NLRP3 level. Method: A retrospective analysis was performed on the clinical data of 50 patients with stable COPD who visited our outpatient clinic from May to October 2018. Depending on the treatment, they were divided into LAMA + LABA group and ICS + LABA group, 25 cases in each group. A total of 40 healthy patients admitted to hospital during the same period were selected as the control group. The LAMA + LABA group was treated with Grononium Bromide/Formoterol Fumarate, the ICS + LABA group received Budesonide Formoterol inhalation. Biochemical indexes and pulmonary function indexes of the two groups of patients were detected before and after treatment, and were compared and analyzed. Result: Before and after treatment, NLRP3 and IL-1 in LAMA + LABA group and ICS + LABA group were higher than those in control group, FEV1% and PEF% were lower than those of control group, the differences were statistically significant (P<0.05). Compared the levels of NLRP3, IL-1, FEV1%, PEF% in LAMA + LABA group and ICS + LABA group, the differences were not statistically significant (P>0.05). Compared the levels of CRP, PCT and WBC in each group, the differences were not statistically significant (P>0.05). After treatment, NLRP3 and IL-1 in LAMA + LABA and ICS + LABA were lower than those before treatment, the differences were statistically significant (P<0.05). NLRP3 was positively correlated with IL-1β (P<0.05), while FEV1% and PEF% were negatively correlated (P<0.05). Conclusion: Patients with COPD were treated with Grononium Bromide/Formoterol Fumarate and Budesonide Formoterol inhalation atomization inhalation with more significant therapeutic effect, which can clinically evaluate the prognosis of the disease according to NLRP3 level and guide clinical treatment.[Key words] Nod-like receptor protein-3 Chronic obstructive pulmonary disease Aerosol inhalation Pulmonary functionFirst-authors address: Jiangmen Central Hospital, Jiangmen 529000, Chinadoi:10.3969/j.issn.1674-4985.2020.07.001
尽管我国目前的医疗水平和人均医疗投入逐年增加,但慢性阻塞性肺疾病(COPD)的发病率和死亡率仍居高不下,并呈逐年增长的趋势,与吸烟人数及环境污染(雾霾、PM2.5)呈正相关,虽然目前COPD可经规范吸入治疗达到良好控制,但目前COPD的具体发病机制仍不完全清楚[1],并尚无明确血清学标志评价其控制是否良好。固有免疫中核苷酸结合寡聚化结构域样受体蛋白3(Nod样受体蛋白-3,NLRP3)炎症小体是炎症体的一种,是NALPs蛋白家族中的一员,主要表达于炎症细胞中,参与多种宿主免疫和炎性反应[2]。NLRP3激活半胱氨酸蛋白酶-1(Caspase-1)后,参与病原体诱导的坏死性细胞死亡,并诱导炎症小体生成,促使Caspase-1自身激活,而活化后的Caspase-1可促进IL-1β和IL-18的成熟及分泌[3]。COPD是以中性粒细胞炎症为主的气道慢性炎症,病原体感染及IL-1β在其发病中发挥极其重要的作用,因此NLRP3炎症小体的激活可能参与到COPD的发生发展中,而治疗COPD的重要吸入性药物可能干预NLRP3的表达[4]。本研究拟入选健康体检者和稳定期COPD患者并进行吸入治疗,检测患者NLRP3、IL-1β、CRP、PCT、WBC及肺功能,探讨NLRP3在评价COPD患者稳定期控制效果方面的作用以及吸入用药对NLRP3表达的影响,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018年5-10月于本院门诊就诊的50例稳定期COPD患者的临床资料。(1)纳入标准:①符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》标准[1];②年龄>40岁;③近1月内未接受糖皮质激素等药物治疗,入组后研究开始前1周停用所有吸入、口服药物;④意识清楚,无认知障碍。(2)排除标准:①妊娠或哮喘;②合并严重心脏、肝、肾、神经系统、内分泌系统等功能障碍或自身免疫性疾病、肿瘤等;③过敏体质或对治疗药物过敏者;④语言功能障碍或合并精神病史;⑤近1个月内出现呼吸道感染史,或目前合并真菌、结核感染。根据治疗方法不同将其分为LAMA+LABA组和ICS+LABA组,每组25例。另选取同期入院健康体检者40例为对照组。本研究经医院伦理学委员会批准。
1.2 方法 治疗前三组均采用ELISA法检测血清NLRP3、IL-1β,生化检测CRP、PCT、WBC及进行肺功能检查,LAMA+LABA组患者接受格隆溴铵/富马酸福莫特罗(生产厂家:AstraZeneca,美国FDA批准文号:NDC0310-4600-12)吸入治疗,期间不接受其他口服药物或吸入药物治疗,吸入剂量为13.8 μg/次,1次/d。ICS+LABA组接受布地奈德福莫特罗粉吸入剂(生产厂家:瑞典AstraZeneca AB,批准文号:注册证号H20140458)治疗,期间不接受其他口服药物或吸入药物治疗,吸入剂量为200 μg/次,1次/d。两组均接受8周吸入治疗,健康体检者不接受任何治疗。
1.3 观察指标及判定标准 (1)比较各组治疗前后各项检验/检查结果,包括NLRP3、IL-1β、CRP、PCT、WBC及肺功能检查;(2)比较LAMA+LABA组及ICS+LABA组治疗前后的NLRP3、IL-1β、FEV1%、PEF%;(3)NLRP3与IL-1β、FEV1%、PEF%的相关分析结果。
1.4 统计学处理 采用SPSS 19.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用完全随机的方差分析,组间的两两比较,方差齐者用LSD法分析,方差不齐用Games-Howell法,构成比使用方差分析。计量资料间的相关性采用Pearson相关检验。计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组一般资料比较 LAMA+LABA组25例,男15例,女10例;年龄60~78岁,平均(69.50±3.80)岁;病程1~10年,平均(5.20±1.22)年。ICS+LABA组25例,男17例,女8例;年龄61~76岁,平均(67.52±4.61)岁;病程1~12年,平均(5.12±1.05)年。对照组40例,男27例,女13例;年龄60~80岁,平均(67.44±4.52)岁。各组间一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 各组治疗前各项检测结果比较 治疗前,LAMA+LABA组及ICS+LABA组的NLRP3、IL-1β均高于对照组,FEV1%、PEF%均低于对照组,差异均有统计学意义(P<0.05);LAMA+LABA组和ICS+LABA组的NLRP3、IL-1β、FEV1%、PEF%比较,差异均无统计学意义(P>0.05);各组CRP、PCT、WBC比较,差异均无统计学意义(P>0.05)。见图1及表1。
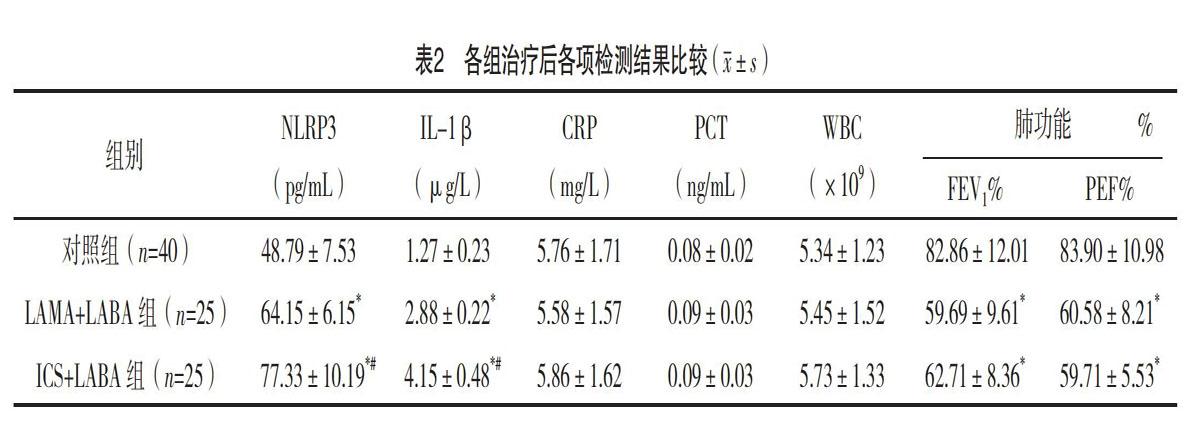
2.3 各组治疗后各项检测结果比较 治疗后,LAMA+LABA组及ICS+LABA组的NLRP3、IL-1β均高于对照组,FEV1%、PEF%均低于对照组,差异均有统计学意义(P<0.05);ICS+LABA组的NLRP3、IL-1β均高于LAMA+LABA组,差异均有统计学意义(P<0.05);ICS+LABA组和LAMA+LABA组的FEV1%、PEF%比較,差异均无统计学意义(P>0.05);各组CRP、PCT、WBC比较,差异均无统计学意义(P>0.05)。见图2及表2。
2.4 LAMA+LABA组及ICS+LABA组治疗前后的NLRP3、IL-1β、FEV1%、PEF%比较 治疗后,LAMA+LABA组及ICS+LABA组的NLRP3及IL-1β均低于治疗前,差异均有统计学意义(P<0.05);两组FEV1%、PEF%治疗前后比较,差异均无统计学意义(P>0.05)。见图3。
3 討论
COPD的患病率、死亡率逐年增高,已成为全球重要的医疗卫生问题,在我国COPD已成为除肿瘤外医疗费用最高的呼吸系统疾病[1-5]。目前虽已有指南规范诊疗,但该疾病发病机制尚未完全明了。而在一线临床工作中,常把COPD患者区分为稳定期及急性加重期,并针对分期做出不同治疗。但目前尚无统一规范指标判定为稳定期COPD,仅通过主观症状判断[6]。本研究首次探讨健康体检者及稳定期COPD患者规范吸入治疗后血清中NLRP3的改变,拟揭示其在稳定期COPD的预防作用。NLRP3炎症体参与多种宿主免疫和炎性反应,各种内、外源性多种信号激活NLRP3炎症体,引起局部及全身炎症反应及下游信号通路激活[7]。而NLRP3信号通路在呼吸系统疾病如急性肺损伤、肺间质纤维化、机械通气损伤等方面已有报道[8-11]。本研究中纳入稳定期COPD患者,发现稳定期(非急性加重期)COPD患者血清NLRP3水平较健康体检者明显增高,提示血清NLRP3水平可能作为提示或筛选COPD患者的指标。本研究发现,除了NLRP3以外,IL-1β也同样增高,此结果与目前研究发现COPD患者血清IL-1β增高结果相一致,IL-1β作为下游信号通路,主要由NLRP3活化后形成的多蛋白复合体并激活半胱天冬酶(Caspase-1),并加工IL-1β前体成为成熟体IL-1β,介导一系列炎症反应[12-14],而研究结果显示二者有明显的相关性,同样揭示NLRP3可能为COPD发病中的启动因素。
此外,本研究通过不同的吸入药物治疗,评价吸入规范治疗对NLRP3的影响,规范吸入治疗可降低血清中NLRP3和IL-1β水平,提示规范治疗可降低肺部炎症及下游信号通路的激活。而目前主要的COPD治疗以规律吸入LAMA(长效抗胆碱能药物)、LABA(长效β2受体激动剂)、ICS(吸入用表面激素)为主,因此本研究分别使用格隆溴铵/福莫特罗或布地奈德/福莫特罗,而研究结果显示:规律吸入LAMA+LABA或ICS+LABA均可降低其肺部炎症水平,可促使患者FEV1%、PEF%轻度改善,但差异均无统计学意义(P>0.05)。同时FEV1%、PEF%与血清NLRP3呈明显负相关,可能提示更严重的肺部炎症引起肺功能的下降,而经吸入治疗后NLRP3和IL-1β水平下降,FEV1%、PEF%轻度改善。这与国内研究肺部感染、炎症水平越高,其mRNA表达水平越高的结果是一致的[15]。同时不管如何降低肺部炎症水平,患者的肺功能损害也无法逆转[1]。由于NLRP3主要存在于细胞膜和细胞间质中,各种感染、烟尘暴露、过敏原及气体污染等危险因素可通过模式识别受体途径活化NLRP3炎症小体,进一步促进下游IL-1β、IL-18等炎症介质的成熟与释放,共同参与慢阻肺病情的进展[16-18],因此探讨肺泡灌洗液中NLRP3与IL-1β水平评价肺部炎症及COPD炎症程度可能更准确。同时本研究亦未纳入急性加重期COPD患者,纳入后比较临床意义更大,但急性加重的COPD除吸入治疗外同时还需各种其余治疗,因此混杂因素太多,难以分析及讨论[19-20]。
综上所述,本研究提示血清NLRP3水平可能作为评价COPD稳定期控制水平的良好指标并预测肺部炎症反应情况,同时NLRP3可能参与到COPD炎症反应的发生发展过程中,深入研究NLRP3可能为COPD的防治提供新的依据。
参考文献
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4):255-264.
[2] Jiang Y,Yang W,Gui S.Procyanidin B2 protects rats from paraquat-induced acute lung injury by inhibiting NLRP3 inflammasome activation[J].Immunobiology,2018,223(10):555-561.
[3] Lasithiotaki I,Tsitoura E,Samara K D,et al.NLRP3/Caspase-1 inflammasome activation is decreased in alveolar macrophages in patients with lung cancer[J].PLoS One,2018,13(10):205-212.
[4] Wang H,Lv C E,Wang S,et al.NLRP3 Inflammasome Involves in the Acute Exacerbation of Patients with Chronic Obstructive Pulmonary Disease[J].Inflammation,2018,41(4):1321-1333.
[5] Vieira F C O S,Pereira D S,Costa T B,et al.Effects of a Long-term Pulmonary Rehabilitation Program on Functional Capacity and Inflammatory Profile of Older Patients with COPD[J].Journal of Cardiopulmonary Rehabilitation and Prevention,2018,38(5):12-15.
[6] Hammad D R,Elgazzar A G,Essawy T S,et al.Evaluation of serum interleukin-1 beta as an inflammatory marker in COPD patients[J].Egyptian Journal of Chest Diseases and Tuberculosis,2015,64(2):347-352.
[7] Sugiyama M,Saeki A,Hasebe A,et al.Activation of inflammasomes in dendritic cells and macrophages by Mycoplasma salivarium[J].Mol Oral Microbiol,2016,31(3):259-269.
[8] Zheng R,Tao L,Jian H,et al.NLRP3 inflammasome activation and lung fibrosis caused by airborne fine particulate matter[J].Ecotoxicology and Environmental Safety,2018,163:612-619.
[9] Xiao Y,Xu W,Su W.NLRP3 inflammasome: A likely target for the treatment of allergic diseases[J].Clin Exp Allergy,2018,48(9):1080-1091.
[10] Gong Z,Zhao S,Zhou J,et al.Curcumin alleviates DSS-induced colitis via inhibiting NLRP3 inflammsome activation and IL-1β production[J].Molecular Immunology,2018,104:11-19.
[11] Wang L,Zha B,Shen Q,et al.Sevoflurane Inhibits the Th2 Response and NLRP3 Expression in Murine Allergic Airway Inflammation[J].J Immunol Res,2018:9021037.
[12] Tong J,Chen F,Li G,et al.Electroacupuncture Intervention Improved Pulmonary Function via Promoting Immunoregulation in Chronic Obstructive Pulmonary Disease Rats[J].Acupuncture research,2018,43(4):236.
[13] Yi G,Liang M,Li M,et al.A large lung gene expression study identifying IL1B as a novel player in airway inflammation in COPD airway epithelial cells[J].Inflamm Res,2018,67(6):539-551.
[14] Riestra A M,Valderrama J A,Patras K A,et al.Trichomonas vaginalis Induces NLRP3 Inflammasome Activation and Pyroptotic Cell Death in Human Macrophages[J].J Innate Immun,2019,11(1):86-98.
[15]毛建,宋珊,贾钦尧,等.慢性阻塞性肺疾病患者外周血淋巴细胞NLRP3 mRNA的表达及血清IL-1β、IL-18检测的意义[J].临床肺科杂志,2017,22(6):1060-1063.
[16] Kim R Y,Pinkerton J W,Essilfie A T,et al.Role for NLRP3 Inflammasome-mediated, IL-1β-Dependent Responses in Severe, Steroid-Resistant Asthma[J].Am J Respir Crit Care Med,2017,196(3):283-297.
[17] Damera G,Pham T,Zhang J,et al.A Sputum Proteomic Signature That Associates with Increased IL-1β Levels and Bacterial Exacerbations of COPD[J].Lung,2016,194(3):363-369.
[18] Fu J J,McDonald V M,Baines K J,et al.Airway IL-1β and Systemic Inflammation as Predictors of Future Exacerbation Risk in Asthma and COPD[J].Chest,2015,148(3):618-629.
[19]夏武,門莉,刘红萍.糖皮质激素类联合长效β2-受体激动剂对56例稳定期COPD患者的疗效影响[J].上海医药,2016,37(15):19-21,25.
[20]李洪晓,江兴玉,徐立新.噻托溴铵、布地奈德福莫特罗吸入治疗慢性阻塞性肺疾病的疗效观察[J].当代医学,2018,24(14):159-160.
(收稿日期:2019-09-10) (本文编辑:姬思雨)
