渥曼青霉素抑制脉络膜黑色素瘤细胞生物学行为的分子机制研究
2020-05-06王英豪
宋 慧,王英豪,李 霞
(恩施土家族苗族自治州中心医院 眼科中心, 湖北 恩施 445000 )
脉络膜黑色素瘤(Choroid melanoma,CM)主要发生于成人眼部的原发性、恶性肿瘤,该肿瘤细胞易发生转移导致患者死亡。流行病学调查发现,约90%患者出现肝转移,且平均生存时间为半年[1]。CM患者接受治疗后,其中50%会出现转移,且10年的生存率也只有50%[2-4]。CM患者经常会导致视力丧失,其中33%患者会进行眼球摘除术[5]。CM的早期诊断和治疗是改善患者生存质量的关键,对其发病机制进行深入研究及寻找有效的药物治疗是迫在眉睫。
磷脂醇3激酶(PI3K)/AKT/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路异常激活与多种肿瘤的发生发展密切相关[6-7]。在黑色素瘤细胞也发现PI3K/AKT/mTOR信号传导异常活化[8],该信号与肿瘤细胞的多种生物学行为密切相关,包括细胞增殖、迁移、侵袭及凋亡等[6-7]。因此,阻断PI3K/AKT/mTOR信号传导可能成为治疗脉络膜黑色素瘤的新策略[9]。目前,已研发出PI3K/AKT/mTOR信号通道抑制剂用于临床前治疗各种类型肿瘤[6-7]。
近年来,一种新型的PI3K抑制剂渥曼青霉素(Wortmannin)已得到广泛研究,它可以特异性抑制PI3K信号传导,对其上游信号没有干扰[10-11]。因此,本文探讨了渥曼青霉素对脉络膜黑色素瘤MuM-2C细胞增殖、克隆、迁移、侵袭及凋亡的影响,以期为临床应用渥曼青霉素提供实验依据。
1 材料与方法
1.1 主要药品与试剂 渥曼青霉素购买于北京AdooQ Bioscience公司;其它PI3K-AKT-mTOR信号通路抑制剂(LY3023414、纳巴霉素、OSI-027和MK-2206)购买于上海Selleck公司;Annexin V-FITC/PI和CCK8试剂盒购自江苏碧云天生物技术研究所;兔anti-Cleaved-caspase-3、兔anti-Cleaved PARP、兔anti-p-P85 (Y458)、兔anti-P85、兔anti-p-AKT (S473 and T308)、兔anti-AKT、兔anti-p-S6K (T389)、兔anti-S6K和兔anti-β-actin购自英国Abcam公司;Caspase-glot-3/-9活性测定试剂盒购买于美国Promega公司;ELISA ss DNA试剂盒购买于武汉华美生物有限公司。
1.2 主要仪器 单人超净台(苏州华新空调净化有限公司);细胞培养箱(上海医用分析仪器厂);Victor3 1420 Multilable Counter酶标仪(DX540,美国);SDS-PAGE凝胶电泳仪(型号DYCZ-24DN,北京六一仪器厂);成像系统(BIO-RAD,美国),FACS-Calibur流式细胞仪(BD公司,美国)。
1.3 实验设计 在研究渥曼青霉素对MuM-2C细胞增殖、克隆、迁移及侵袭能力影响的实验时,将细胞分为对照组、1 μM的渥曼青霉素组、2 μM的渥曼青霉素组和4 μM的渥曼青霉素组。研究渥曼青霉素对MuM-2C细胞凋亡和PI3K-AKT-mTOR信号通路影响的实验时,将细胞分为对照组和4 μM的渥曼青霉素组。在研究不同抑制剂对MuM-2C细胞增殖和凋亡影响实验时,将细胞分为对照组、LY3023414(LY)组、纳巴霉素(Rap)组、mTOR激酶抑制剂OSI-027(OSI)组、AKT特异性抑制剂MK-2206(MK)组和渥曼青霉素组(WT),实验重复3次。
1.4 MuM-2C细胞培养与药物处理 MuM-2C细胞购买于上海康朗生物科技有限公司,采用含10%胎牛血清的DMEM培养基培养,培养箱条件设置为5%CO2、4 ℃恒温,显微镜观察细胞生长至90%左右时,便可开始传代培养。待细胞处于对数生长期时,将细胞分为对照组和1、2、4 μM的渥曼青霉素组;采用不同浓度渥曼青霉素及PI3K-AKT-mTOR抑制剂(4 μM)处理细胞48 h后,进行后续实验。
1.5 CCK8实验 将对数期MuM-2C细胞接种于96孔板,每孔1×104个细胞,培养过夜,然后加入0、1、2、4、6 μM的渥曼青霉素处理细胞24、48、72 h后,弃去旧培养液,每孔加入100 μL含10 μL的CCK8试剂的DMEM培养液,放入培养箱中继续孵育1.5 h,在酶标仪450 nm波长处检测细胞吸光度OD值,并计算MuM-2C细胞相对存活率,实验重复3次。计算公式如下:细胞相对存活率(%)=OD实验组/OD对照组×100%。
1.6 细胞克隆实验 将对数期MuM-2C细胞接种于96孔板,每孔1×104个细胞,培养过夜,然后加入1、2、4 μM的渥曼青霉素处理细胞48 h后,显微镜下观察细胞数,实验重复3次。
1.7 细胞迁移侵袭实验 将对数期MuM-2C细胞接种于24孔Transwell板中。在进行侵袭实验时,将Transwell小室底部均匀涂抹Matrigel胶(迁移实验不需要此步骤)。在下室加入600 μL培养液,上室加入200 μL细胞悬液培养过夜,然后上室加入1、2、4 μM的渥曼青霉素的培养液处理细胞48 h。然后将其下表面浸泡在70%甲醇溶液中,固定30 min,用结晶紫染色,镜下观察细胞数,实验重复3次。
1.8 Caspase活性试验 收集各组细胞,Caspase-glot-3/-9活性测定试剂盒检测Caspase-3/9活性,采用酶标仪在405 nm处测定其吸光度值,实验重复3次。
1.9 ss DNA凋亡ELISA实验 收集各组细胞裂解,取上清液,ss DNA ELISA试剂盒分析裂解液中ss DNA水平,采用酶标仪在405 nm处测定其吸光度值,实验重复3次。
1.10 流式细胞实验 待药物处理完成后,弃去旧培养液,PBS清洗各组细胞2次,消化收集细胞,PBS重悬后,分别加入Annexin-V FITC和PI处理细胞(按照试剂盒操作说明书进行),最后用流式细胞仪检测细胞凋亡情况,实验重复3次。
1.11 Western blot实验 待药物处理完成后,PBS清洗细胞2次,每孔加入200 μL的裂解液,置于冰上充分裂解30 min,收集细胞裂解液,4 ℃条件下离心12 000 rpm,收集上清。BCA法检测了上清中总蛋白浓度,每孔上样40 μg进行电泳分离,恒压70 V,电泳3 h。然后在恒流275 mA条件下电转70 min,5%脱脂牛奶封闭1 h后,将目的条带放入对应的一抗溶液(稀释比1∶1 000)中,4 ℃摇床孵育过夜。TBST洗膜3次,每次10 min,再把条带放入盛二抗(稀释比1∶3 000)的平皿中室温孵育1 h,TBST洗膜3次,每次10 min。加入4 mL的ECL显影液显色3 min,凝胶成像系统曝光。实验重复3次。
1.12 统计学分析 采用SPSS 19.0统计软件进行统计分析,组间两两比较采用t检验,组间比较采用单因素方差分析检验,P<0.05为差异具有统计学意义。
2 结果
2.1 渥曼青霉素抑制MuM-2C细胞增殖、克隆、迁移及侵袭能力 为了观察渥曼青霉素对MuM-2C细胞生物学行为的影响,采用不同浓度渥曼青霉素处理细胞,检测了细胞增殖、克隆、迁移及侵袭能力。图1A表示,逐步增加浓度(0.5~6 μM)的渥曼青霉素处理MuM-2C细胞24、48和72 h后,发现药物干预48 h后具有明显抗MuM-2C细胞增殖的活性,且表现出浓度和时间依赖性。另外,渥曼青霉素呈浓度依赖性的抑制MuM-2C细胞克隆、迁移及侵袭能力,与对照组细胞相比差异均有统计学意义(P<0.05,图1B-D),并且低、中、高浓度渥曼青霉素组间的细胞克隆(t=6.321,P<0.05)、迁移(t=9.047,P<0.05)及侵袭能力(t=5.872,P<0.05)差异也有显著性。

*:与0 μM渥曼青霉素组或对照组比较,P<0.05;#:与24 h比较,P<0.05;+:与48 h比较,P<0.05。 图1 渥曼青霉素对MuM-2C细胞增殖、克隆、迁移及侵袭能力的影响
2.2 渥曼青霉素诱导MuM-2C细胞凋亡 进一步分析渥曼青霉素对MuM-2C细胞凋亡的影响,发现渥曼青霉素呈剂量依赖性的诱导MuM-2C细胞中凋亡相关蛋白Caspase-9和Caspase-3的活性(见图2A);同时,图2B提示渥曼青霉素呈剂量依赖性的诱导MuM-2C细胞中促凋亡蛋白Cleaved caspase-3(t=10.065,P<0.01)和Cleaved PARP(t=16.046,P<0.001)的表达。进一步对细胞凋亡标志物单链DNA(ss DAN)的水平检测,如图2C,提示渥曼青霉素呈剂量依赖性的增高ss DAN的含量(t=6.073,P<0.01)。实验还采用流式细胞术实验分析了渥曼青霉素对MuM-2C细胞早期和晚期凋亡的影响,发现4 μM的渥曼青霉素处理细胞48 h后,能明显诱导MuM-2C细胞早期和晚期凋亡的发生,见图2D/E。

*:与0 μM的渥曼青霉素组或对照组比较,P<0.05。图2 曼青霉素对MuM-2C细胞凋亡的影响
2.3 渥曼青霉素通过PI3K-AKT-mTOR信号通路下游靶蛋白的影响 4 μM的渥曼青霉素处理MuM-2C细胞48 h后,PI3K-AKT-mTOR信号通路靶蛋白P85(Y458)、AKT(S473和T308)和S6K1(T389)的磷酸化水平均明显降低,与对照组细胞相比差异有统计学意义(P<0.05);然而,P85、AKT1/2和S6K1表达水平与对照组相比没有发生明显变化(P>0.05,见图3)。
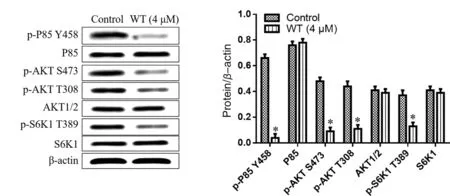
*:与对照组比较,P<0.05。图3 渥曼青霉素对P85、AKT和S6K1磷酸化的影响
2.4 PI3K-AKT-mTOR信号通路抑制剂对MuM-2C细胞增殖和凋亡的影响 实验进一步比较了渥曼青霉素(WT)和其它PI3K-AKT-mTOR信号通路抑制剂,包括LY3023414(LY)、纳巴霉素(Rap)组、mTOR激酶抑制剂OSI-027(OSI)组、AKT特异性抑制剂MK-2206(MK),抗MuM-2C细胞增殖的活性,结果见图4A,渥曼青霉素相比于同浓度的其它抑制剂更能明显抑制MuM-2C细胞的增殖活性。同样的,渥曼青霉素相比于同浓度的其它抑制剂更能明显增高MuM-2C细胞凋亡标志物ss DNA的水平,见图4B。

*:与对照组比较,P<0.05;#:与WT组比较,P<0.05。图4 PI3K-AKT-mTOR信号通路抑制剂降低MuM-2C细胞增殖
3 讨论
黑色素瘤是最常见的眼内恶性肿瘤,由虹膜、睫状体或脉络膜内的黑色素细胞引起。早期诊断和局部治疗至关重要,并且患者生存率与原发性肿瘤大小相关密切。对黑色素瘤进行基因组学研究发现,MAPK、PI3K/Akt及Hippo信号通路可能成为治疗该种疾病的新方法[12]。PI3K在脉络膜黑色素细胞瘤组织中表达明显增高,且与癌细胞的侵袭和迁移密切相关[13]。在脉络膜黑色素细胞瘤动物模型中也发现,对PI3K/MMP信号途径进行抑制,可以显著减少肿瘤细胞生长及血管生长[14]。于是,对PI3K/Akt信号通路进行抑制可能成为治疗脉络膜黑色素细胞瘤的潜在药物靶点。早期也有研究报道渥曼青霉素可以通过降低PI3K/Akt信号通路传导,进而抑制结肠癌及非小细胞肺癌细胞增殖,并诱导它们凋亡[15-16]。本研究发现,PI3K-AKT-mTOR信号通路抑制剂渥曼青霉素对脉络膜黑色素细胞瘤MuM-2C细胞表现出明显的药物毒性作用,抑制MuM-2C细胞增殖、克隆、迁移及侵袭,同时通过诱导Caspase-3/9活化促使MuM-2C细胞凋亡。
mTOR在PI3K-AKT-mTOR信号传导过程中发挥着重要的作用,其包括mTORC1和mTORC2两种复合体[17]。实验发现渥曼青霉素对MuM-2C细胞中PI3K-AKT-mTOR信号通路靶蛋白P85(Y458)、AKT(S473和T308)和S6K1(T389)的磷酸化水平表现出抑制作用,还上调促凋亡蛋白Cleaved casapase-3和Cleaved PARP的表达,并且呈浓度依赖性的诱导凋亡标志物ss DNA水平升高,进而诱导细胞发生凋亡。本实验结果还提示,PI3K抑制剂渥曼青霉素对MuM-2C细胞的药物毒性作用相比于mTORC1抑制剂纳巴霉素和mTOR激酶抑制剂OSI-027更显著。可能的原因是抑制剂纳巴霉素和OSI-027仅仅抑制mTOR介导的信号传导,而渥曼青霉素能阻断整个PI3K-AKT-mTOR信号传导。更有趣的是,渥曼青霉素对MuM-2C细胞增殖的抑制作用也明显优于PI3K抑制剂LY3023414,可能是由于渥曼青霉素同时干扰了其它致癌信号传导的活化,比如GSK-3β/CREB信号通路[18]。
总之,渥曼青霉素通过靶向抑制PI3K-AKT-mTOR信号传导,抑制MuM-2C细胞的增殖、克隆、迁移及侵袭,并诱导细胞凋亡。研究结果为渥曼青霉素临床上治疗脉络膜黑色素细胞瘤提供实验依据。
