膜联蛋白A1拟肽Ac2-26对体外循环大鼠肺损伤及中性粒细胞凋亡的影响
2020-05-06张元杰吴汉华罗俊丽郭宇含
张元杰,吴汉华,罗俊丽,郭宇含,程 翅,张 红
(1.遵义医科大学 研究生院,贵州 遵义 563099;2.遵义医科大学 麻醉医学院,贵州 遵义 563099)
体外循环(Cardiopulmonary bypass CPB)是心脏外科手术成功开展的良好保障,但急性肺损伤(Acute lung injury ALI)仍然是CPB术后的主要并发症之一[1]。严重者可发展为急性呼吸窘迫综合征(Acute respiratory distress syndrome ARDS),甚至多器官衰竭,死亡率高达40%~70%[2]。引起体外循环肺损伤的因素很多,目前多数学者认为体外循环引起的肺缺血再灌注损伤与全身性炎症反应是导致肺损伤的主要原因[3]。膜联蛋白A1(Annexin A1、AnxA1)是一类钙依赖的磷脂结合蛋白,其相对分子量为37kD,具有抗炎作用[4]。在炎症性肺部疾病中,AnxA1可由37kDa降解为33kDa小分子产物[5]。大量研究显示,AnxA1参与多种病理生理过程,如细胞增殖与分化、中性粒细胞趋化及凋亡等[6-7]。Ac2-26是AnxA1 N端模拟肽,具有与AnxA1相似的生物学效应[8]。研究发现[9],在LPS诱导的肺内毒素血症模型中,膜联蛋白A1拟肽Ac2-26预处理,可减少白细胞向结缔组织和肺泡腔的渗出,通过减少TNF-α、IL-6和IL-1的释放,对肺有保护作用。本研究拟通过观察膜联蛋白A1拟肽Ac2-26对CPB大鼠肺损伤及中性粒细胞凋亡的影响,探讨其减轻CPB大鼠肺损伤的作用机制。
1 材料与方法
1.1 主要试剂与仪器 膜联蛋白A1拟肽Ac2-26(Tocris公司),10%中性甲醛(西陇科学),DAPI染色液(碧云天),BCA蛋白浓度测定试剂盒(MDL公司),TUNEL试剂盒(南京凯基生物),冰冻切片机(LEICA),荧光显微镜(日本尼康),成像系统(日本尼康),BT100-2J蠕动泵(Longer Pump有限公司),大鼠膜式氧合器(东莞科威医疗器械有限公司),酶标仪(美国BIO-TEK公司),GEM Premier 3000血气分析仪(美国实验仪器公司)。
1.2 实验动物与分组 24只SD雄性大鼠,清洁级,由长沙市天勤生物技术有限公司提供,许可证号:SCXK(湘)2019-0015。实验和饲养严格遵守遵义医科大学实验动物伦理与管理准则。按随机数字表法分为假手术组(S组)、缺血再灌注组(IR组)和Ac2-26组(A组),每组8只。缺血再灌注组和Ac2-26组分别于阻断左肺门前30 min静脉给予等容量0.9%NaCl、AnxA1拟肽Ac2-26(1 mg/kg)[10]。
1.3 实验方法
1.3.1 动物模型的建立 大鼠用1%戊巴比妥钠50 mg/kg腹腔内注射麻醉,麻药充分起效后,行尾静脉穿刺置管,仰卧位固定。行右股动静脉、左股静脉穿刺置管,明视下行气管插管,右颈总动脉穿刺置管,连接呼吸机,机械通气,参数设置:潮气量12 mL/kg,频率60次/min,I∶E=1∶2.5,FiO2=99%。建模的两组大鼠右侧股动脉连接生物信号采集处理系统,右颈总动脉连接BT100-2J蠕动泵,股静脉连接大鼠膜式氧合器。行CPB管道预冲并给予肝素3 mg/k肝素化后,以双侧股静脉作为静脉端引流,右侧颈总动脉作为动脉端回流,当ACT>480 s后,开始转机(维持灌注流量在40 mL/(kg·min))。并循10 min后经左侧第四肋间开胸,用无创血管夹夹闭左肺门(包括左主支气管、左肺动脉和肺静脉),并行循环45 min后松开血管夹,开放肺门,并循30 min后,给予鱼精蛋白2~6 mg/kg中和多余肝素后停止体外循环,停机观察90 min实验结束。CPB期间维持平均动脉压在50~80 mmHg,灌注流量在40 mL/(kg·min),监测直肠温度(维持在32~34℃)。实验过程中留置导尿管用于尿液引流并监测大鼠生命体征,维持麻醉深度,根据生命体征选择性应用血管活性药物,并根据血气分析纠正酸碱平衡及电解质紊乱。分别在CPB开始前即刻(T1)、开放左肺门即刻(T2)、CPB结束后1.5 h时(T3)采集动脉血约0.5 mL,T3时点取左肺支气管肺泡灌洗液(BALF)离心后置于-80℃冰箱中保存待检,采集的肺组织置于甲醛溶液中固定和-80℃冰箱中保存。
1.3.2 支气管肺泡灌洗液(BALF)的采集 实验结束时,剥离气管及肺脏,阻断右主支气管,经气管注入0.9%氯化钠注射液5 mL至左主支气管及左肺,重复灌洗左肺3次,回收至少3 mL灌洗液,3 000 rpm离心10 min,取上清液,置于-80℃中保存,用于检测BALF中IL-6和总蛋白的含量。
1.3.3 肺功能的检测 采集的动脉血测动脉血气分析,并计算氧合指数(OI)、呼吸指数(RI)、肺泡动脉氧分压差(P(A-a)O2)。(OI = PaO2/FiO2RI = P(A-a)O2/PaO2)
1.3.4 病理形态学观察 肺组织用甲醛溶液固定,石蜡包埋后切成3~5 μm薄片,经脱水、脱蜡后H&E染色封片,使用光镜观察肺组织形态。随机选择三个高倍镜视野观察肺组织形态,拍摄并保存图片。采用Li等[11]评分标准取平均值,该评分可反映肺损伤程度。
1.3.5 肺组织中TNF-α、IL-10和BALF中IL-6、总蛋白含量的检测 ELISA检测肺组织中TNF-α、IL-10和BALF中IL-6、总蛋白的含量。准备试剂样品和标准品,加入准备好的样品和标准品,37℃反应30 min,洗板5次,加入酶标试剂,37℃反应30 min,洗板5次,加入显色液A、B,37℃显色10 min,加入终止液比色,15 min之内读OD值,计算待测样品的浓度。
1.3.6 肺组织中性粒细胞凋亡的检测 使用TUNEL细胞凋亡检测试剂盒检测肺组织中性粒细胞的凋亡水平。按照试剂盒说明书操作,冰冻组织切片固定后,促进样本通透性,在TdT酶作用下荧光素-dUTP与样本DNA的标记反应,用DAPI染核,荧光显微镜下拍照检测细胞凋亡,用Image-Pro Plus软件统计中性粒细胞总数及凋亡细胞数,计算凋亡百分比。
1.3.7 肺组织膜联蛋白A1的检测 Western blot检测肺组织AnxA1的表达。将各组切取的肺组织用PBS漂洗,裂解细胞提取细胞总蛋白,测定蛋白质的浓度,经SDS-PAGE凝胶电泳分离后电转移到硝酸纤维素膜上,封闭后,分别加入一抗膜联蛋白A1(1∶2 000)、二抗山羊抗兔抗体(1∶1 000),曝光观察蛋白质条带,并进行统计分析。
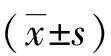
2 结果
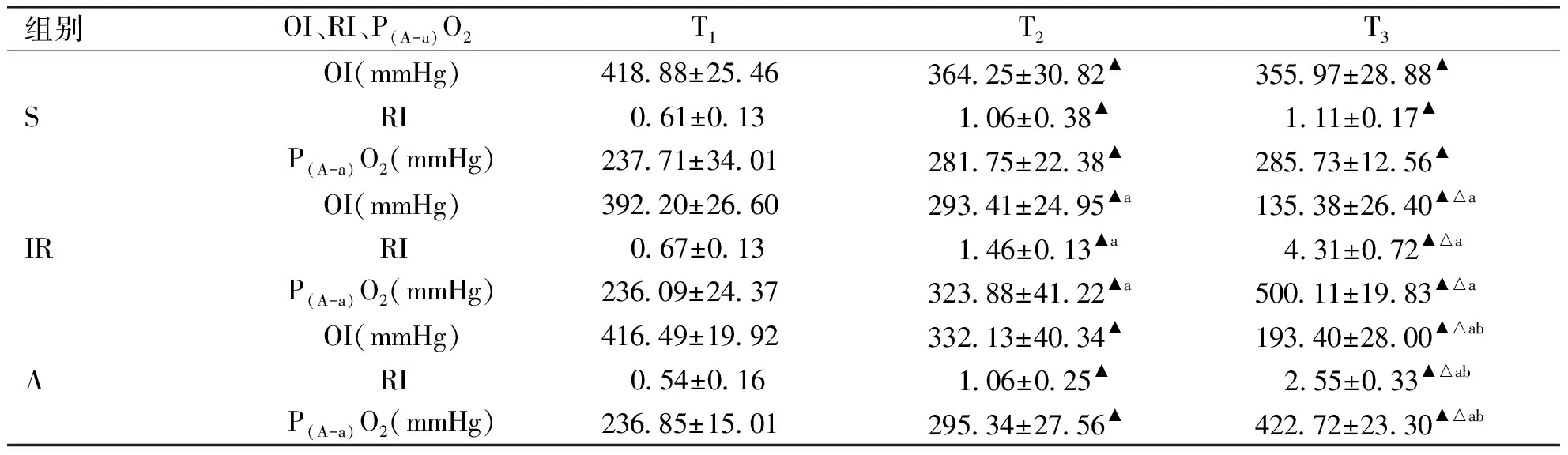
2.1 大鼠肺功能比较 与T1时点比较,三组大鼠T2、T3时点OI降低,RI、P(A-a)O2升高(P<0.05)。与T2时点比较,S组T3时点OI、RI、P(A-a)O2无明显差异(P>0.05);缺血再灌注组和Ac2-26组T3时点OI降低,RI、P(A-a)O2升高(P<0.05)。T3时点,缺血再灌注组和Ac2-26组OI较假手术组降低、而RI、P(A-a)O2较假手术组明显升高(P<0.05);Ac2-26组OI较缺血再灌注组升高,而RI、P(A-a)O2较缺血再灌注组明显降低(P<0.05,见表1)。

组别OI、RI、P(A-a)O2T1T2T3OI(mmHg)418.88±25.46364.25±30.82▲355.97±28.88▲SRI 0.61±0.13 1.06±0.38▲ 1.11±0.17▲P(A-a)O2(mmHg)237.71±34.01281.75±22.38▲285.73±12.56▲OI(mmHg)392.20±26.60293.41±24.95▲a135.38±26.40▲△aIRRI 0.67±0.13 1.46±0.13▲a 4.31±0.72▲△aP(A-a)O2(mmHg)236.09±24.37323.88±41.22▲a500.11±19.83▲△aOI(mmHg)416.49±19.92332.13±40.34▲193.40±28.00▲△abARI 0.54±0.16 1.06±0.25▲ 2.55±0.33▲△abP(A-a)O2(mmHg)236.85±15.01295.34±27.56▲422.72±23.30▲△ab
与T1比,▲:P<0.05;与T2比,△:P<0.05;与S组比较,a:P<0.05;与IR组比较,b:P<0.05。
2.2 大鼠肺组织病理学变化及病理损伤评分 假手术组肺组织结构清晰,肺泡壁较完整(见图1A);缺血再灌注组肺组织结构紊乱,肺泡壁断裂,肺泡腔充满水肿液,可见中等量炎性细胞和红细胞浸润,肺损伤程度加重,同时病理损伤评分较假手术组升高(见图1B);Ac2-26组肺组织结构较完整,可见部分肺泡壁断裂,有少量的炎性细胞浸润,病理损伤评分较缺血再灌注组下降(见图1C);见图1~2。

A:S组; B:IR组; C:A组;HE染色×200。图1 大鼠T3时点肺组织

与S组比较,a:P<0.05;与IR组比较,b:P<0.05。图2 肺组织病理损伤评分比较
2.3 肺组织中TNF-α、IL-10及BALF中IL-6、总蛋白的含量变化 与假手术组比较,缺血再灌注组和Ac2-26组肺组织中TNF-α和BALF中IL-6、总蛋白含量明显增加,肺组织IL-10显著降低(P<0.05);Ac2-26组肺组织中TNF-α和BALF中IL-6、总蛋白含量明显低于缺血再灌注组,肺组织中IL-10明显高于缺血再灌注组(P<0.05,见表2)。
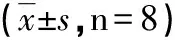

组别TNF-α(pg/mL)IL-10(pg/mL)IL-6(pg/mL)总蛋白(mg/mL)S35.10±2.8854.11±3.4426.17±2.801.53±0.18 IR92.88±3.60a33.64±3.04a39.04±2.29a6.89±0.53aA56.11±2.14ab43.18±4.06ab33.64±2.37ab3.48±0.19ab
与S组比较,a:P<0.05;与IR组比较,b:P<0.05。
2.4 肺组织中性粒细胞的凋亡水平比较 免疫荧光结果显示:相较于假手术组,Ac2-26组和缺血再灌注组中性粒细胞凋亡率升高,Ac2-26组中性粒细胞凋亡率明显高于缺血再灌注组,差异有统计学意义(见图3~4)。
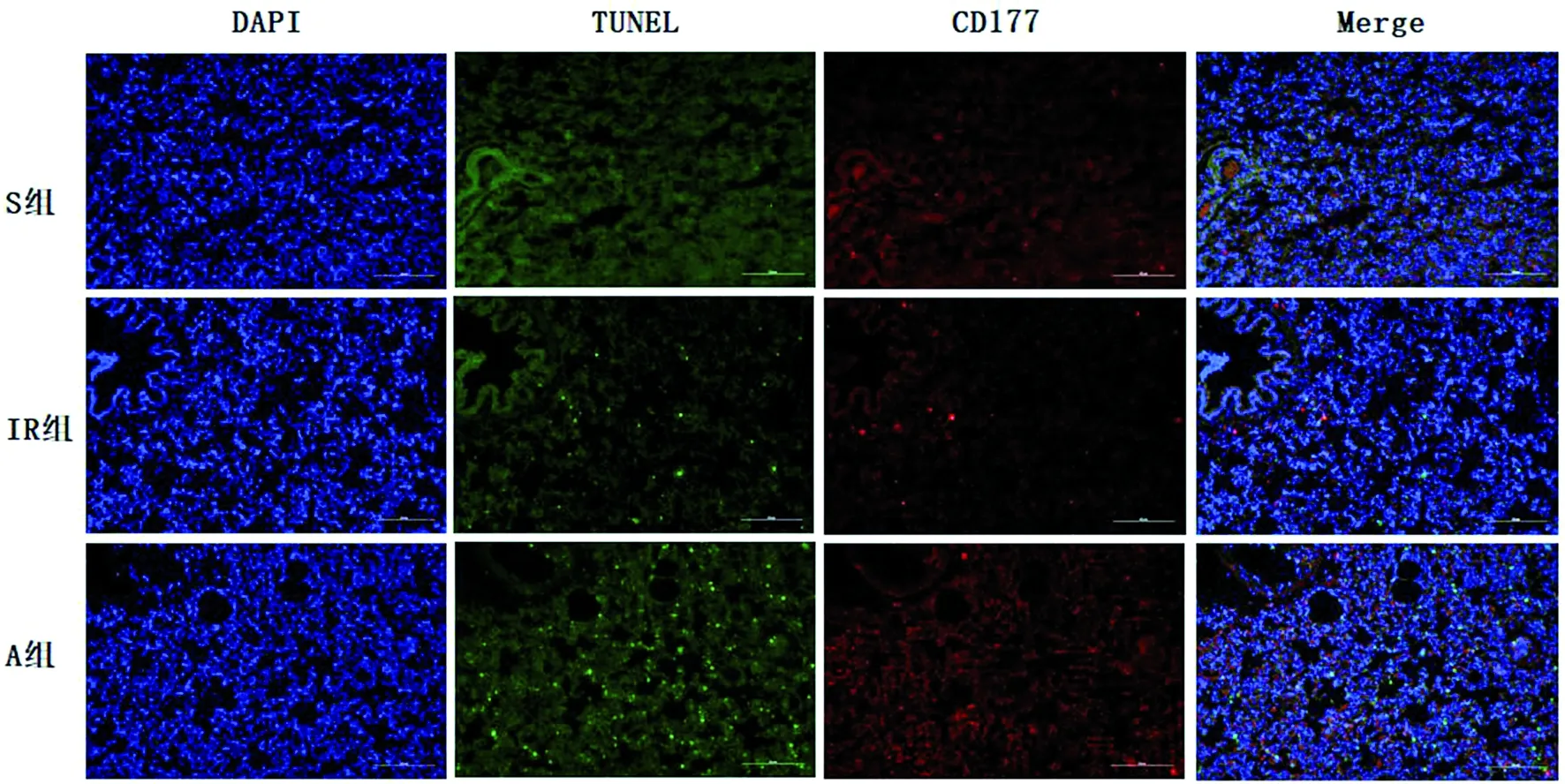
蓝色染色为细胞核;荧光染色为凋亡的中性粒细胞;红色染色为CD177标记中性粒细胞;×200。图3 TUNEL法检测肺组织中性粒细胞凋亡结果
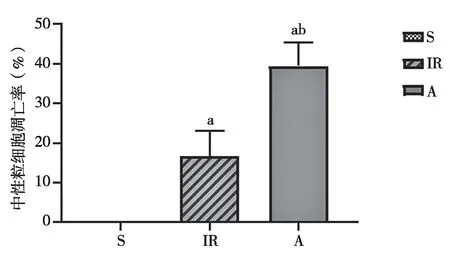
与S组比较,a:P<0.05;与IR组比较,b:P<0.05。图4 肺组织中性粒细胞凋亡水平比较
2.5 肺组织膜联蛋白A1的表达比较 T3时点,与假手术组相比,缺血再灌注组和Ac2-26组肺组织 AnxA1表达升高(P<0.05);与缺血再灌注组比较,Ac2-26组AnxA1表达升高(P<0.05)。与假手术组比较,缺血再灌注组和Ac2-26组肺组织 AnxA1(37kD)表达下降(P<0.05),而肺组织 AnxA1(33kD)表达升高(P<0.05,见表3、图5)。
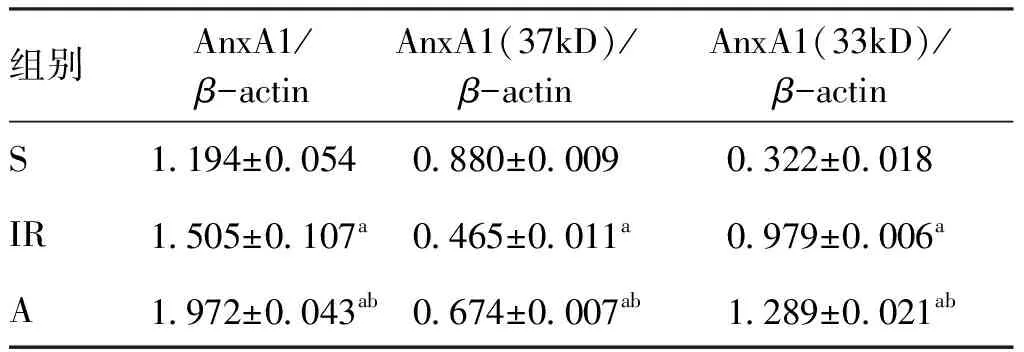
组别AnxA1/β-actinAnxA1(37kD)/β-actinAnxA1(33kD)/β-actinS1.194±0.0540.880±0.0090.322±0.018IR1.505±0.107a0.465±0.011a0.979±0.006aA1.972±0.043ab0.674±0.007ab1.289±0.021ab
与S组比较,a:P<0.05;与IR组比较,b:P<0.05。

图5 肺组织AnxA1蛋白印迹图
3 讨论
CPB引起的肺损伤是术后常见的并发症之一,严重影响患者术后临床转归[12]。研究表明[13],CPB后可产生不同程度的呼吸功能不全,表现为肺通气功能和换气功能下降,动脉氧合不足,肺顺应性下降,肺组织充血,肺血管周围出血及肺泡萎陷等。文献报道[14],在脂多糖(LPS)诱导的肺损伤小鼠模型中,支气管肺泡灌洗液(BALF)中IL-1β、TNF-α及蛋白含量增高。本实验结果显示:实验结束时,缺血再灌注组大鼠光镜下肺组织结构紊乱,病理损伤评分高于假手术组;大鼠氧合指数明显低于假手术组,而呼吸指数、肺泡-动脉氧分压差则相反;同时左肺支气管肺泡灌洗液里IL-6、总蛋白浓度明显增加,说明CPB后大鼠肺组织结构受损,肺功能下降,肺毛细血管通透性增加。在CPB过程中加入Ac2-26后发现,Ac2-26组大鼠肺功能明显改善,肺组织损伤程度明显比缺血再灌注组轻,表明AnxA1拟肽Ac2-26能减轻大鼠CPB肺损伤,对肺有一定的保护作用。
在正常条件下,AnxA1主要位于细胞质中无活性,在炎症因子的作用下,中性粒细胞与毛细血管内皮细胞结合,刺激大量AnxA1移动到细胞表面,以钙离子依赖的方式锚定在细胞的浆膜上并与粘附分子相互作用,从而抑制白细胞向炎症部位迁移,调节机体自身的抗炎作用[15],本实验结果显示:与假手术组比较,缺血再灌注组及Ac2-26组肺组织 AnxA1表达升高,说明CPB导致的强烈的炎症反应和缺血再灌注损伤激活了大鼠肺组织内源性的AnxA1表达。应用AnxA1肽Ac2-26后,肺组织中AnxA1表达明显高于缺血再灌注组,肺功能改善,肺组织炎症反应及损伤程度减轻,提示Ac2-26可通过调节大鼠CPB肺组织AnxA1的表达,起到与AnxA1相似的抗炎作用,这与Stuqui等[16]研究的结果相一致。研究发现[17],AnxA1的抗炎作用主要是限制炎症介质(TNF-α、IL-6等)产生和白细胞的聚集,促进巨噬细胞分泌抗炎细胞因子IL-10, 通过阻断中性粒细胞对内皮黏附与跨内皮迁移[18],并促进中性粒细胞的凋亡[19],减轻组织损伤。CPB后肺组织TNF-α、IL-6等炎症因子可以直接损伤内皮细胞,使毛细血管通透性增高,促进肺水肿,造成组织损伤[20];IL-10为体内重要的抗炎细胞因子,在调节炎症方面有着重要的作用[21]。本研究发现,实验结束时Ac2-26组大鼠肺组织AnxA1表达增加的同时IL-10含量及中性粒细胞凋亡率明显高于缺血再灌注组,TNF-α含量则明显降低,肺损伤则明显减轻。提示Ac2-26减轻大鼠CPB肺损伤的机制可能与增加肺组织内源性的AnxA1的表达及抗炎因子IL-10含量,促进中性粒细胞凋亡有关。
综上所述,膜联蛋白A1拟肽Ac2-26可减轻大鼠体外循环肺损伤,其机制可能与增加肺组织AnxA1表达,促进中性粒细胞凋亡减轻肺部炎症反应有关。
