膜联蛋白A1基因敲除加重大鼠体外循环后肺损伤
2020-05-06吴汉华张元杰刘科宇
吴汉华 ,张元杰,刘科宇,董 良,张 红
(1.遵义医科大学 贵州省麻醉与器官保护重点实验室暨贵州省普通高等学校脑科学特色重点实验室, 贵州 遵义 563099;2.遵义市第四人民医院 麻醉科,贵州 遵义 563000;3.遵义医科大学第一附属医院 麻醉科,贵州 遵义 563099)
随着心脏手术及体外循环(cardiopulmonary bypass,CPB)技术的提高,心脏病人术后并发症正逐渐减少,但急性肺损伤(Acute lung injury ,ALI)仍然是 CPB 术后的主要并发症之一[1],重者可发展为急性呼吸道窘迫综合征(Acute respiratory distress syndrome,ARDS),死亡率高达50%[2]。CPB肺损伤的具体机制并不清楚,大多数学者认为主要原因是缺血再灌注损伤和全身炎症反应综合征。
膜联蛋白A1(AnxA1)是膜联蛋白超家族第一个被发现的成员,参与多种细胞生物学功能,包括细胞增殖分化、凋亡和抗炎症作用;其广泛分布在成年哺乳动物体内[3]。AnxA1活化后被转运到细胞表面,与甲酰基肽受体(Formylpeptide receptor,FPR)特异性结合发挥作用,通过促进炎症细胞的凋亡,下调白细胞在损伤或感染部位的聚集调节炎症的消退[4]。在博莱霉素诱导的肺纤维化模型中,AnxA1基因敲除小鼠因为该蛋白的缺失导致比野生型小鼠更严重的肺部炎症和纤维化[5]。
本实验拟对野生型及AnxA1基因敲除型大鼠建立CPB肺损伤模型,观察AnxA1在CPB肺损伤中的作用,为临床寻找有效的CPB肺保护措施提供新的理论依据。
1 材料与方法
1.1 动物 全身AnxA1-/-大鼠(KO大鼠)和SD野生型大鼠(WT大鼠)各12只,12~16周龄,体重350~450 g,KO大鼠由上海和元生物技术股份有限公司提供,许可证号:SCXK(苏)2018-0003;SD野生型大鼠由长沙天勤生物技术有限公司提供,许可证号:SCXK(湘)2019-0015。
1.2 试剂 兔抗大鼠AnxA1单克隆抗体(英国Abcam);兔抗大鼠β-actin多克隆抗体(武汉三鹰);辣根过氧化物酶(HRP)标记山羊抗兔IgG(上海碧云天生物)。
1.3 实验方法
1.3.1 动物分组 按随机数字表法分组:①WT大鼠假手术组(WT-Sham);②WT大鼠肺损伤组(WT-IR组);③KO大鼠假手术组(KO-Sham组);④KO大鼠肺损伤组(K0-IR组),每组6只。
1.3.2 动物模型的建立 所有大鼠术前禁食12~16 h,自由饮水。根据本课题组设计建立大鼠CPB肺损伤模型[6],用1%戊巴比妥(50 mg/kg)腹腔注射麻醉,仰卧位固定于手术板上,喉镜明视下确认气管插管成功连接呼吸机,设定潮气量12 mL/kg,呼吸频率60次/min,吸呼比=1∶2.5,吸入氧浓度:99%。行尾静脉穿刺置管用于给药,分离两侧股静脉及右侧颈动脉并穿刺置管,分离一侧股动脉连接生物信号采集处理系统监测大鼠生命体征。准备并安装好储血室(20 mL注射器)、蠕动泵、硅胶泵管(直径1.6 mm)、大鼠膜肺及动、静脉管路。20 mL注射器抽取羟乙基淀粉9 mL,钠钾镁钙葡萄糖注射液1 mL,5%碳酸氢钠1 mL,甘露醇1 mL预充CPB管道及实验用膜式氧合器,排出CPB管道中的气泡。尾静脉注射肝素5 mg/kg,连接CPB管道,待激活全血凝固时间(ACT)≥480 s后,将双侧股静脉血液引流至储血室中,经膜肺过滤氧合后,经右侧颈总动脉输注回流转机;10 min后开胸用无创血管钳夹闭左侧肺门,转机45 min后,开放左侧肺门恢复双肺通气,继续转机30 min后经尾静脉注射鱼精蛋白中和多余肝素后停止转机;再持续机械通气90 min后实验结束。CPB期间维持肛温在32~34 ℃,平均动脉压在50~80 mmHg,灌注流量在40 mL/(kg·min)。术中密切关注动脉血气分析结果维持大鼠内环境稳态;采用戊巴比妥钠维持麻醉深度,芬太尼保证术中镇痛,维库溴铵维持肌松,必要时应用血管活性药物维持大鼠生命体征。
1.3.3 标本采集 分别在体外循环前(T1)、开放肺门后(T2)和实验结束时(T3)取动脉血行血气分析,计算大鼠氧合指数(OI)和呼吸指数(RI),术中记录大鼠生命体征。各组大鼠在实验后处死,取左肺组织,一部分行电镜和光镜观察肺组织损伤程度,一部分行冰冻切片TUNEL法检测中性粒细胞的凋亡率,另外提取组织蛋白行免疫印迹检测。
1.3.4 肺组织病理检查 左肺组织经石蜡包埋处理,切成3~5 μm薄片,50%乙醇和正丁醇分别脱水2次,二甲苯脱蜡3次,苏木精-伊红(HE)染色后封片。每张病理切片随机选择3个高倍镜视野(×100),采用Cheng C等[7]标准进行评分。按照肺泡及肺泡间质有无水肿液和红细胞渗出的面积及炎性细胞浸润程度半定量评估肺损伤的程度,评分标准为:0分(无),1分(<25%,间质少量中性粒细胞),2分(25%~50%,间质及部分肺泡腔内有较多中性粒细胞),3分(50%~75%,间质及大部分肺泡腔内有中性粒细胞聚集成团),4分(>75%)。评分由两名未参与实验的病理科医生进行,取平均值。
1.3.5 肺组织电镜检查 标本放入2.5%戊二醛 4℃固定过夜,经漂洗后用10%明胶包埋固定,在4℃下用戊二醛固定1 h;脱水后用环氧树脂浸透包埋,Leica UC6超薄切片机切片。最后在110 kV的条件下,用透射电子显微镜观察肺组织并拍摄照片。
1.3.6 TUNEL法检测肺组织中性粒细胞凋亡率 肺组织固定于10%甲醛过夜。脱水、包埋后对标本进行切片,厚度8~10 μm。冰冻切片放入4%多聚甲醛液室温固定30 min。加蛋白酶K工作液(蛋白酶K储存液用PBS 1∶9稀释)覆盖组织,37℃温箱孵30 min,PBS洗3次,每次5 min。切片滴加破膜工作液覆盖组织,常温下孵育20 min,PBS洗3次。切片上滴加TUNEL试剂,湿盒内37℃恒温孵育2 h。每张切片加适量试剂3(Streptavidin-Fluorescein)覆盖组织,湿盒内37℃温箱孵育30 min。PBS洗3次。加入0.2%Triton X-100通透10 min,PBS洗3遍。然后滴加与二抗相同宿主的血清封闭30 min,PBS洗3遍。添加抗中性粒细胞表面特异性蛋白CD177试剂,4℃湿盒内过夜,PBS洗3遍。二抗孵育室温2 h(避光),PBS洗3遍。最后用DAPI染核10 min,PBS洗3遍,然后直接照荧光片。
1.3.7 免疫印迹法 取出-80℃保存的肺组织,每组各取约100 mg加人约1mL预冷蛋白裂解液,12 000 rpm离心15 min,取上清,BCA法测蛋白浓度并定量。每组蛋白取40μg上样于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)胶,以浓缩胶100 V,30 min、分离胶120 V,60 min电泳,电泳结束后湿转至聚偏氟乙烯(PVDF)膜上。TBS洗膜5 min,置于5%脱脂牛奶中封闭1 h,将膜分别放入一抗兔抗大鼠AnxA1抗体(1∶1 000)和兔抗大鼠β-actin抗体(1∶1 000),4℃冰箱孵育过夜。TBST液漂洗3次,每次10 min,加入二抗HRP标记山羊抗兔IgG(1∶2 000),37℃孵育1 h。TBST漂洗3次,与显影液反应后,化学发光仪检测,采用Image J软件进行灰度分析,以β-actin作为内参,用目的蛋白与β-actin的比值表示目的蛋白相对表达量。
2 结果
2.1 各组大鼠各时点生命体征的变化
2.1.1 心率的变化 各组同时点比较:各组大鼠在T1时刻,心率差异无统计学意义(P>0.05),在T2及T3时间点,WT-IR组心率较WT-Sham组明显降低(P<0.05),KO-IR组心率较KO-Sham组明显下降(P<0.05),WT-IR和KO-IR组在T2及T3时点心率差异无统计学意义(P>0.05);各组不同时点比较:假手术组WT-sham和KO-Sham组各时点心率差异无统计学意义(P>0.05);WT-IR组和KO-IR组随着时间点推移,心率逐渐降低且差异有统计学意义(P<0.05),见表1。
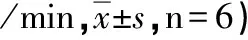
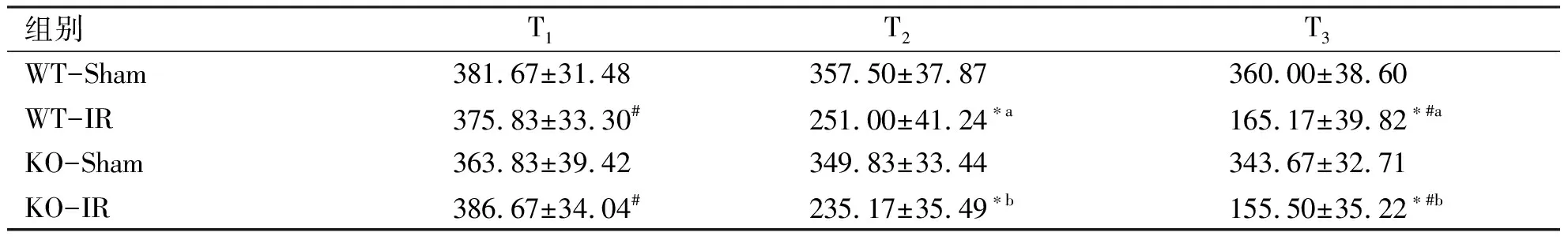
组别T1T2T3WT-Sham381.67±31.48357.50±37.87360.00±38.60WT-IR375.83±33.30#251.00±41.24∗a165.17±39.82∗#aKO-Sham363.83±39.42349.83±33.44343.67±32.71KO-IR386.67±34.04#235.17±35.49∗b155.50±35.22∗#b
与T1比,*:P<0.05;与T2比,#:P<0.05;与同时点WT-Sham组比,a:P<0.05;与同时点KO-Sham组比,b:P<0.05。
2.1.2 平均动脉压的变化 各组同时点比较:各组大鼠在T1时刻,MAP差异无统计学意义(P>0.05),在T2及T3时间点,WT-IR组MAP较WT-Sham组明显降低(P<0.05),KO-IR组MAP较KO-Sham组明显下降(P<0.05),WT-IR和KO-IR组在T2及T3时点MAP差异无统计学意义(P>0.05);各组不同时点的比较:假手术组WT-sham和KO-Sham组各时点MAP差异无统计学意义(P>0.05),WT-IR组和KO-IR组随着实验进行,在T2及T3时刻MAP较T1明显降低(P<0.05),两组T3和T2时刻MAP差异无统计学意义(P>0.05),见表2。
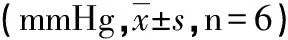
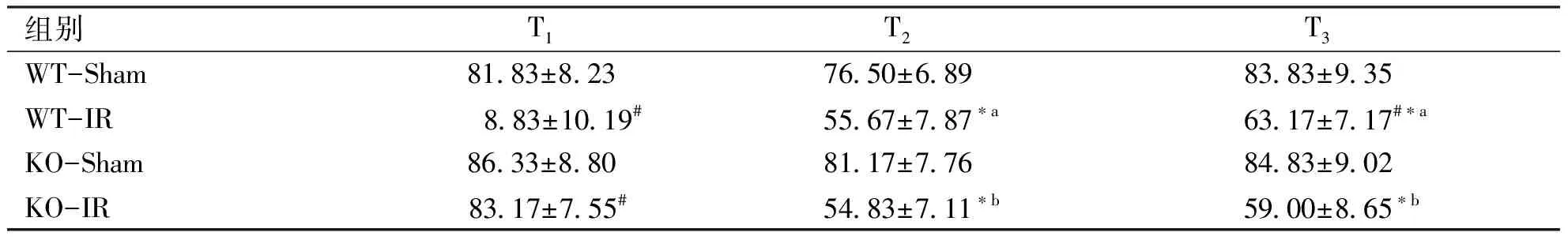
组别T1T2T3WT-Sham81.83±8.2376.50±6.8983.83±9.35WT-IR 8.83±10.19#55.67±7.87∗a63.17±7.17#∗aKO-Sham86.33±8.8081.17±7.7684.83±9.02KO-IR83.17±7.55#54.83±7.11∗b59.00±8.65∗b
与T1比,*:P<0.05;与T2比,#:P<0.05;与同时点WT-Sham组比,a:P<0.05;与同时点KO-Sham组比,b:P<0.05。
2.2 各组大鼠氧合指数(OI)和呼吸指数(RI)的变化 各组同时点比较:各组大鼠在T1时刻,OI和RI差异均无统计学意义(P>0.05),在T2及T3时间点,WT-IR组OI较WT-Sham组明显降低(P<0.05),KO-IR组OI较KO-Sham组明显下降(P<0.05),WT-IR组RI较WT-Sham组明显升高(P<0.05),KO-IR组RI较KO-Sham组明显增加(P<0.05),WT-IR和KO-IR组在T2时间点OI及RI差异均无统计学意义(P>0.05),在T3时刻,KO-IR组OI明显低于WT-IR组(P<0.05),而RI显著高于WT-IR组(P<0.05);各组不同时点比较:假手术组WT-sham和KO-Sham组各时点OI、RI差异无统计学意义(P>0.05);WT-IR组和KO-IR组随着时间点推移,OI逐渐降低差异有统计学意义(P<0.05),RI逐渐升高差异有统计学意义(P<0.05),见表3~4。
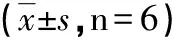

组别T1T2T3WT-Sham428.33±37.88411.50±27.49414.17±22.78WT-IR445.33±30.75#227.17±39.95∗a135.67±27.71∗#aKO-Sham424.83±33.77405.17±30.75410.00±39.48KO-IR436.67±32.20#212.00±27.47∗b100.67±21.48∗#bc
与T1比,*:P<0.05;与T2比,#:P<0.05;与同时点WT-Sham组比,a:P<0.05;与同时点KO-Sham组比,b:P<0.05;与同时点W-IR相比,c:P<0.05。


组别T1T2T3WT-Sham0.34±0.100.39±0.080.37±0.07WT-IR0.29±0.11#1.59±0.41∗a3.35±0.90∗#aKO-Sham0.33±0.100.40±0.090.41±0.13KO-IR0.33±0.11#1.66±0.39∗b4.55±0.95∗#bc
与T1比,*:P<0.05;与T2比,#:P<0.05;与同时点WT-Sham组比,a:P<0.05;与同时点KO-Sham组比,b:P<0.05;与同时点W-IR相比,c:P<0.05。
2.3 各组大鼠肺组织形态改变及病理损伤评分
2.3.1 肺组织形态学改变及病理评分 (H&E)染色光镜下观察T3时刻WT-Sham和KO-Sham组肺组织结构清晰,可见少量肺泡壁断裂及炎性渗出;病理损伤评分WT-Sham组(1.67±0.52)及KO-Sham组(1.83±0.61)差异无统计学意义。WT-IR组肺组织结构紊乱,肺泡壁断裂严重,肺泡腔充满水肿液,可见大量炎性细胞和红细胞浸润;KO-IR组肺组织结构受损严重,肺泡间隔增宽,肺泡腔见大量炎性细胞和红细胞浸润,且观察到炎性细胞聚集成团;KO-IR组病理损伤评分(4.91±0.20)高于WT-IR组(4.58±0.20),差异具有统计学意义(P<0.05),见图1~2。
A:WT-Sham组;B:WT-IR组;C:KO-Sham组;D:KO-IR组。图1 各组大鼠T3时刻肺组织光镜改变(×200)

与WT-Sham组比较,a:P<0.05;与KO-Sham组比较,b:P<0.05;与WT-IR组比较,c:P<0.05。图2 各组大鼠肺组织损伤评分比较
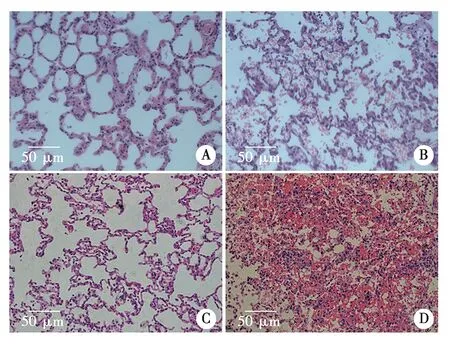
2.3.2 肺泡II型上皮细胞形态的改变 电镜下观察到T3时刻WT-Sham和KO-Sham组肺泡II型上皮细胞整体轮廓清楚,界限清晰,胞内可见数个结构完好的板层小体结构,无线粒体肿胀。在WT-IR组电子显微镜下,观察到肺泡II型细胞板层结构数减少,肿胀增多,可见线粒体水肿。KO-IR组电镜下可见肺泡II型细胞数量较WT-IR组减少,并观察到肺泡II型上皮细胞出现坏死,细胞膜结构破坏,肺泡腔内出现细胞碎片,特异性结构板层小体的平行排列板消失,线粒体肿胀明显,膜外可见残余的绒毛结构(见图3)。
A:WT-Sham组;B:WT-IR组;C:KO-Sham组;D:KO-IR组。嗜锇性板层小体(红色箭头);线粒体(黄色箭头);细胞碎片(蓝色箭头,bar=2 μm)。图3 各组大鼠T3时刻肺组织电镜改变
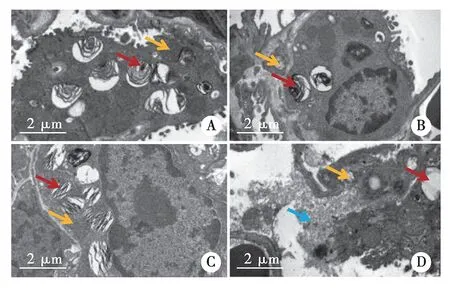
2.4 大鼠肺组织中性粒细胞细胞凋亡 在WT-Sham组和KO-Sham组仅观察到少量中性粒细胞,未发现凋亡的中性粒细胞。WT-IR和KO-IR组观察到中性粒细胞的凋亡,KO-IR组中性粒细胞的凋亡率(6.32±2.57%)相较于WT-IR组(17.72±6.35%)明显降低,差异具有统计学意义,见图4~5。
2.5 大鼠肺组织AnxA1的表达 T3时刻WT-IR组肺组织中AnxA1/β-Actin表达(1.43±0.32)明显高于WT-Sham组(0.93±0.42),KO组因为敲除了相关基因,肺组织中并未检测到AnxA1的表达(见图6)。

与WT-IR组相比,a:P<0.05。图4 各组大鼠肺组织中性粒细胞凋亡率统计
图5 TUNEL法检测中性粒细胞凋亡结果(×200)
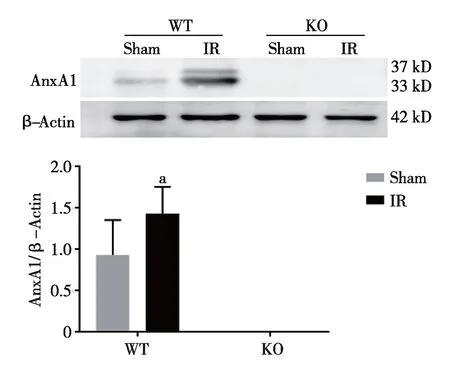
与WT-Sham组相比,a:P<0.05。 图6 各组大鼠T3时点肺组织AnxA1的表达
3 讨论
急性肺损伤是CPB后常见的并发症之一,其主要表现是肺功能受损和肺组织病理学改变。临床上常用OI和RI来评价肺功能。RI和OI之间存在负相关,两者的变化都可以反映肺功能的变化。本实验血气分析计算显示:随着实验时间的延长,WT-IR组和KO-IR组大鼠的OI逐渐下降低,明显低于CPB前;RI 则相反;而WT-sham和KO-Sham组各时点OI和RI无明显差异,提示CPB后大鼠肺功能明显受损。但在实验结束时,KO-IR组OI明显低于WT-IR组,而RI显著高于WT-IR组,说明AnxA1基因敲除大鼠CPB后肺功能受损比野生型大鼠严重。病理切片显示CPB后WT-IR组及KO-IR组均有肺组织结构破坏,肺泡壁断裂,肺泡腔充满水肿液,可见大量炎性细胞和红细胞浸润;但KO-IR组肺组织病理评分明显高于WT-IR组。肺泡Ⅱ型上皮细胞作为肺泡上皮的祖细胞,不仅可以自我更新,在损伤修复过程中还可以分化为Ⅰ型肺泡上皮细胞[8],肺泡Ⅱ型上皮细胞通过合成和分泌肺泡表面活性物质,维持肺泡的稳定性,在肺内免疫中起关键作用[9]。有研究发现[10],在脓毒症导致小鼠急性肺损伤的模型中,因肺泡II型上皮细胞的受损,增加了肺泡气-血屏障的通透性,从而导致肺泡腔和肺间质水肿、出血,大量中性粒细胞和肺泡巨噬细胞浸润,加重肺损伤。本实验电子显微镜下观察到两组大鼠肺泡II型细胞板层结构视野数减少,肿胀增多,可见线粒体水肿;KO-IR组可见肺泡II型细胞数量较WT-IR组减少,并观察到肺泡II型上皮细胞出现坏死,细胞膜结构破坏,肺泡腔内出现细胞碎片,特异性结构板层小体的平行排列板消失,线粒体肿胀明显,膜外可见残余的绒毛结构,KO-IR组肺泡II型上皮细胞受损严重。以上结果提示:AnxA1基因敲除后加重了大鼠CPB肺损伤。
在CPB期间,血液与CPB人工回路表面的直接接触会引起全身炎症反应和肺循环系统中性粒细胞的逐渐积累,中性粒细胞-内皮细胞相互作用,促进炎症因子和氧自由基的释放导致组织损伤[11]。中性粒细胞凋亡被认为是炎症消散的关键,是机体自我限制炎症反应的一种重要方式。有研究表明,CPB开始后中性粒细胞凋亡明显减少,且随着CPB时间增加,中性粒细胞凋亡率逐渐下降[12]。 CPB后滞留在肺内的中性粒细胞凋亡受到抑制,生命周期延长,始终处于活化状态,持续释放大量具有组织毒性及酶解基质蛋白作用的内容物,加重肺组织损伤[13]。CPB后肺组织中性粒细胞凋亡延迟是导致肺损伤的重要因素。
AnxA1是一种重要的内源性抗炎介质,在正常条件下,AnxA1主要位于细胞质中无活性,发生炎症时,中性粒细胞与毛细血管内皮细胞结合,刺激大量AnxA1移动到细胞表面与粘附分子相互作用,通过介导炎症细胞和内皮细胞之间的相互作用,从而抑制炎症细胞向炎症部位聚集,调节机体自身的抗炎作用。AnxA1在中性粒细胞、单核细胞、嗜酸细胞和浆细胞的胞浆中高表达[14],可通过诱导中性粒细胞的凋亡调节炎症的消退。有研究发现,在脂多糖(LPS)诱导小鼠急性胸膜炎的实验中,内源性AnxA1通过激活caspase-3及抑制erk1 /2磷酸化等相关通路促进中性粒细胞的凋亡,从而抑制了炎症[15]。本实验结果显示,WT-IR组和 KO-IR组大鼠CPB 后均观察到肺组织中性粒细胞的凋亡,但WT-IR组中性粒细胞的凋亡率明显高于KO-IR组,同时WT-IR组大鼠肺功能及肺组织受损程度比KO-IR组轻;WT-IR组大鼠肺组织AnxA1的表达明显高于WT-sham组,KO-IR及KO-sham肺组织未检测到AnxA1的表达。说明CPB后WT-IR组大鼠肺组织AnxA1的表达增加,可促进中性粒细胞的凋亡,肺损伤程度减轻。AnxA1基因敲除后中性粒细胞的凋亡延迟,肺损伤程度加重。提示:内源性的AnxA1通过促进中性粒细胞的凋亡,对CPB肺损伤有积极的抗炎作用。
综上所述,本研究通过观察AnxA1基因敲除型大鼠与野生型大鼠CPB后对肺损伤的影响,发现基因敲除型大鼠肺损伤明显加重,提示内源性AnxA1对CPB肺损伤有一定积极的作用。因此深入研究AnxA1或其拟肽药有望成为CPB肺损伤的一种新的保护策略。
