绿原酸对荧光假单胞菌群体感应现象及其腐败特性的抑制作用
2020-05-04王虹懿吴海虹张新笑孙芝兰诸永志王道营徐为民
王虹懿,吴海虹,张新笑,刘 芳,3,孙芝兰,3,*,诸永志,王道营,徐为民,彭 景
(1.扬州大学食品科学与工程学院,江苏扬州 225127;2.江苏省农业科学院农产品加工研究所,江苏南京 210014;3.省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室,江苏南京 210014)
细菌的群体感应也称自身诱导,是指细菌通过产生和感应信号分子浓度的变化来检测其群体密度,进而调控群体行为的过程。自身诱导物随着细菌密度的增高而增高,当自身诱导物达到某一阈值后,会与一些转录调节子结合,从而诱导或抑制多种基因的表达。研究发现群体感应系统(quorum sensing system,QS)主要参与调控细菌胞外酶的分泌、毒力因子的表达和细菌运动等生理性状[1-2]。经研究发现,大多数革兰氏阴性菌通过QS机制分泌并感应酰基高丝氨酸内酯类分子类信号分子(N-acylhomoserine lactones,AHLs)来判断菌群密度,并以此浓度阈值来调节细菌相关腐败基因的表达,进而在食品腐败过程中发挥致腐作用[3]。群体感应抑制剂(quorum sensing inhibitors,QSIs)指对细菌间信息交流具有阻碍作用,干扰或抑制QS现象,且对细菌正常生命活动不造成破坏的物质。天然来源的QSI浓度低且毒性小,利用天然 QSI 阻断细菌群体感应系统,降低腐败菌致腐能力成为当前人类研究的热点。研究发现阿魏精油作为一种新型的QSI可显著抑制紫色杆菌的QS现象[4]。Chow等[5]报道了水杨酸对铜绿假单胞菌 QS 现象具有抑制作用,可有效降低其毒力效应。目前已从药用植物、果蔬、海洋藻类中分离出具有抑制群体感应的天然活性物质。绿原酸是具有生物抑菌活性的天然植物源生物防腐剂[6],目前已有研究表明绿原酸对多种腐败菌起到一定的抑制效果[7-8],但将其作为QSI研究其对腐败菌致腐特性的影响却鲜见报道。绿原酸作为新型植物源QSI与传统的防腐剂相比,首先并不妨碍细菌的正常生长,仅在适当浓度时对靶细胞的QS系统起到调控作用,在避免细菌产生耐药性的情况下抑制细菌腐败因子的表达,降低细菌的致腐能力。
致腐微生物的生长是引起肉品腐败变质的关键因素,其中假单胞菌属通常被鉴定为肉类优势腐败菌,假单胞菌在冷鲜肉中的生长速率比其他细菌快三分之一左右[9-10]。荧光假单胞菌(P.fluorescens)为假单胞菌属嗜冷革兰氏阴性菌,是引起低温条件下高蛋白和高脂肪食品腐败变质的优势腐败菌群[11]。细菌胞外蛋白酶、脂肪酶作为毒力因子在腐败菌的侵染过程中起重要作用,可降解肉品中的蛋白质、脂肪等物质,产生多种腐败代谢产物,进而使肉类食品风味和品质发生腐败变性。因此,通过干扰或阻断腐败菌之间的信息传递来抑制其致腐特性的表达成为肉品保鲜领域重要的研究课题。本文以P.fluorescens为研究对象,探究绿原酸在不抑制其正常生长的条件下,对产生嗜铁素、胞外蛋白酶、胞外脂肪酶、群集泳动等致腐特性的抑制作用,以期拓宽绿原酸在肉品防腐保鲜方面的应用范围,为其作为天然群体感应抑制剂提供理论依据。
1 材料与方法
1.1 材料与仪器
供试菌株:荧光假单胞菌(P.fluorescens) 由江苏省农业科学院农产品加工所自主从冷鲜鸡肉中分离得到;紫色杆菌Chromobacteriumviolaceum026(CV026) 培养时需添加卡那霉素 20 μg/mL,由本实验室保藏;绿原酸(杜仲提取物,98%) 陕西慧科植物开发有限公司;蛋白酶活性检测试剂盒 索莱宝公司;AHLs类信号分子标准品(C4-HSL、C6-HSL、3-oxo-C8-HSL、C10-HSL、3-oxo-C12-HSL、C12-HSL、C14-HSL) Sigma公司;无水甲醇(HPLC纯) 国药集团;脱脂乳粉、对硝基苯酚、对硝基苯酚棕榈酸酯、Tris-HCl、铬天青S(CAS)、十六烷基三甲基溴化铵(HDTMA) 生工生物工程有限公司。
JY5002型电子天平 海良平仪器仪表有限公司;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;UniCenMR台式高速冷冻离心机 德国Herolab公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SPX-250B-Z型生化培养箱 上海博讯实业有限公司医疗设备厂;Ⅱ-ZX-40高效液相色谱串联质谱分析仪 美国Aglient公司;Gen5全波长酶标仪 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 绿原酸对P.fluorescens的最小抑菌浓度(MIC)及群体感应抑制活性的检测 将菌株P.fluorescens过夜活化两次后,按2%接种量接种于新鲜LB液体培养基中,培养至对数期后收集菌株,用磷酸盐缓冲液(PBS)将细菌重悬至OD600为0.5,按2%(V/V)的比例将菌悬液加入到LB液体培养基中混匀。采用二倍稀释法,向上述培养基中加入绿原酸使终浓度分别为0.625、1.25、2.5、5、10 mg/mL,28 ℃培养24 h后测定OD600,以抑制菌株生长的最低绿原酸的质量浓度为MIC。
报告菌株CV026过夜活化两次,按2%的接种量接种于含有20 μg/mL卡那霉素的新鲜LB液体培养基中,于28 ℃摇床培养(180 r/min)至对数生长期,按2%接种量接种于含有20 μg/mL C4-HSL信号分子的LB半固琼脂培养基,混合均匀后倒平板,待培养基凝固后缓慢放入牛津杯,杯中加入200 μL 1.5 mg/mL的绿原酸,以体积分数50%甲醇溶液作为空白对照,28 ℃培养24 h后观察紫色素的产生情况。
1.2.2 绿原酸对P.fluorescens产信号分子AHLs的影响 AHLs粗提液的制备:活化后的P.fluorescens接种于LB液体培养基中,分别添加终浓度为1.5、2、2.5、3 mg/mL的绿原酸,以未添加绿原酸的液体培养基作为空白对照组。置于30 ℃摇床培养(200 r/min)12 h,12000 r/min、4 ℃离心20 min,取上清液,用等体积乙酸乙酯(含0.1 mL/L乙酸)萃取,吸出有机相,旋转蒸发蒸干有机溶剂(35 ℃,真空度0.1 MPa),用甲醇充分润洗蒸发瓶,所得甲醇溶液即为AHLs粗提液,-20 ℃保存。
AHLs的检测:以甲醇为溶剂制备含有7种AHLs标准品的混合标准溶液,由HPLC-MS检测确定各AHLs的保留时间,参照马晨晨等[12]的方法设置色谱、质谱条件,将提取的AHLs粗提液做进一步鉴定。色谱条件:Waters Sunfire C18色谱柱(50 mm×2.1 mm,3.5 μm);流速:0.2 mL/min;进样量:10 μL;柱温:35 ℃;流动相为甲醇∶水(50∶50,V/V)等梯度洗脱。质谱条件:离子源温度:120 ℃,脱溶剂温度350 ℃;脱溶剂气和锥孔气N2,脱溶剂气流速500 L/h,锥孔气流速50 L/h;毛细管电压3.5 kV。样品经C18色谱柱分离后进入质谱,采用电喷雾离子源正离子模式和多反应监测模式,外标法进行定量分析。
1.2.3 绿原酸对P.fluorescens生长曲线的影响 过夜活化得到的指示菌株按2%的接种量接种于LB液体培养基中,分别添加终浓度为1.5、2、2.5、3 mg/mL的绿原酸,设置未添加绿原酸的液体培养基作为空白对照组,添加C4-HSL信号分子为阳性对照组。将菌液置于28 ℃条件下200 r/min摇床培养,每隔1 h测定其OD600值,记录并绘制生长曲线。
1.2.4 绿原酸对P.fluorescens腐败特性的影响
1.2.4.1 CASAD嗜铁素平板法检测嗜铁素含量 无菌上清液处理方法:将过夜活化的P.fluorescens菌株接种至含有不同浓度绿原酸(1.5、2、2.5、3 mg/mL)和添加外源C4-HSL信号分子(2 μg/mL)的LB液体培养基中,于28 ℃,200 r/min培养24 h后,4 ℃,12000 r/min离心2 min,吸取上清液并用0.22 μm无菌滤膜过滤除菌备用。
嗜铁素检测平板配制参照参考文献[13],待固体培养基凝固后缓慢放入牛津杯,每孔加入培养液上清200 μL,28 ℃培养24 h后观察。由于嗜铁素竞争结合培养基中的铁,使杯周围的培养基由原来的蓝色变成黄色,黄色晕圈的大小代表菌株分泌嗜铁素的含量。
1.2.4.2 绿原酸对P.fluorescens胞外蛋白酶活性的影响 本研究蛋白酶活性定性检测参照文献采用牛奶平板法[14],并稍做修改。本研究蛋白酶活性的定量检测使用碱性蛋白酶试剂盒。
牛奶平板法:15%的脱脂乳粉用纯水溶解后单独灭菌(115 ℃,30 min),取10 mL脱脂乳与90 mL含0.85%琼脂的LB半固态营养培养基混合均匀,倾注到水琼脂平板中。待培养基凝固后缓慢放入牛津杯,每孔加入菌液上清200 μL,28 ℃静置培养24 h后观察其水解圈直径,设置未添加绿原酸的液体培养基作为空白对照组,添加C4-HSL信号分子为阳性对照组。
蛋白酶含量测定:参照1.2.4.1方法制备菌液上清并过滤除菌,根据碱性蛋白酶活性检测试剂盒说明书进行操作,测定680 nm处吸光度,按照蛋白浓度计算蛋白酶活性。
1.2.4.3 绿原酸对P.fluorescens胞外脂肪酶活性的影响 采用对硝基苯酚(p-NP)法进行脂肪酶活性的定量检测[15],取90 mg对硝基苯酚棕榈酸酯(p-NPO)溶解于30 mL乙腈溶液中,作为底物溶液存于-20 ℃备用。取100 μL底物溶液加入900 μL 50 mmol/L的Tris-HCL缓冲液(pH8.0)中,摇匀后于37 ℃保温5 min,然后向其加入50 μL适当稀释的脂肪酶待测样品,设置相应体积的灭活样品作为空白对照,37 ℃振荡反应5 min。反应结束后,立即加入300 μL 10%的三氯乙酸中止反应,摇匀后静置5 min,加入300 μL 10% Na2CO3溶液,摇匀,于4 ℃,13500 r/min离心2 min,取反应液测定OD410值。1个酶活单位定义为:在37 ℃条件下,每分钟水解p-NPO释放1 μmol p-NP所需的酶量,以U表示。计算脂肪酶活性公式如下:
式中:X为脂肪酶活性,U·mL-1;c为p-NP浓度,μmol·mL-1;V为终止后总体积,mL;v为酶液用量,mL;t为反应时间,min。
1.2.4.4 绿原酸对P.fluorescens群集运动和泳动的影响 参照文献[16]配制群集琼脂培养基(1%蛋白胨(质量分数计,下同)、0.5%氯化钠、0.5%琼脂和0.5%葡萄糖)和泳动琼脂培养基(1%胰蛋白胨、0.5%氯化钠、0.3%琼脂),将不同浓度的绿原酸经0.22 μm的滤膜过滤除菌后,与冷却至40 ℃的群集泳动琼脂培养基混匀,倒平板,使平板中绿原酸的终浓度为1.5、2、2.5、3 mg/mL,设置未添加绿原酸的液体培养基作为空白对照组,添加C4-HSL信号分子为阳性对照组。向冷却的平板中央加入5 μL过夜活化的P.fluorescens菌液,无菌风吹干后28 ℃静置培养24 h,观察供试菌株的迁移情况。
1.3 数据分析
每组实验均设置3个平行并重复操作三次,结果均表示为平均值±标准偏差(n≥3),利用SPSS 16.0统计软件,采用最小显著差异法(LSD)分析均值的差异性,显著性水平为0.05。使用分析软件Origin 8.5进行作图。
2 结果与分析
2.1 绿原酸的最小抑菌浓度及QSIs活性
采用二倍稀释法观察绿原酸浓度梯度为0.625~10 mg/mL时P.fluorescens和CV026菌株的生长情况,确定了绿原酸对P.fluorescens和CV026菌株的最小抑菌浓度均为5 mg/mL。因此,为保证后续实验效果非绿原酸本身的抑菌作用,绿原酸浓度均设置为亚抑菌浓度[17],即1.5、2、2.5、3 mg/mL。
图1表示在亚抑菌剂量下绿原酸对紫色杆菌CV026 QS活性的影响。紫色杆菌CV026紫色素的产生受其群体感应系统的调控,当存在信号分子时,其群体感应系统被激发,产生紫色表型[17];若样品中含有群体感应抑制剂,则会抑制CV026产生紫色素的能力。图1显示,加入绿原酸的牛津杯周围出现浑浊、不透明的抑制圈,表明绿原酸在不影响菌株生长的情况下,具有抑制CV026群体感应活性的能力。
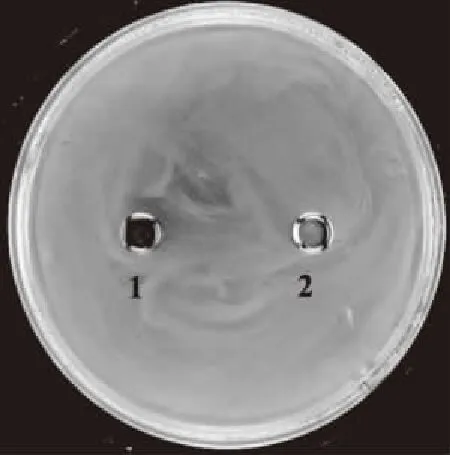
图1 绿原酸对紫色杆菌CV026紫色素产生的抑制作用Fig.1 Effect of hlorogenic acid on violacein production of CV026注:1:2.5 mg/mL绿原酸;2:50%甲醇溶液。
2.2 绿原酸对P. fluorescens产AHLs的影响
2.2.1 HPLC-MS/MS检测AHLs标准品 HPLC-MS/MS在所述条件下分别对7种AHLs信号分子标准品进行检测,得到AHLs混合标准品的色谱图(图2)。可以看出峰分离良好,C4-HSL、C6-HSL、3-oxo-C8-HSL、C10-HSL、3-oxo-C12-HSL、C12-HSL、C14-HSL标准品保留时间分别为1.009、1.922、2.421、4.808、4.904、5.306和5.928 min。
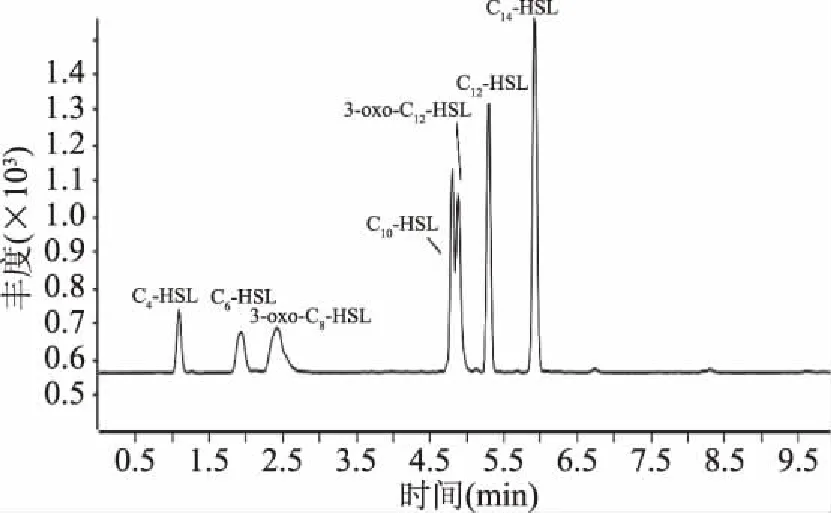
图2 AHLs混合标准品离子流图Fig.2 Chromatograms of mixture of AHLs
2.2.2P.fluorescens释放AHLs的检测P.fluorescens所产生信号分子的种类为:C4-HSL、C6-HSL、C10-HSL、C12-HSL和3-oxo-C8-HSL。各类信号分子的质量浓度见表1,荧光假单胞菌分泌量较高的信号分子为C4-HSL和C6-HSL。与空白组相比,经绿原酸处理的实验组释放AHLs的种类未发生明显变化,但随着绿原酸浓度的增加,各AHLs质量浓度明显下降,提示绿原酸能够抑制P.fluorescens群体感应信号分子的表达或释放,可能是抑制了信号分子合成酶基因(LuxR/LuxI)的表达,使AHLs的催化合成释放减少。

表1 荧光假单胞菌AHLs信号分子水平(μg/L)Table1 The AHLs level of P. fluorescens(μg/L)
2.3 绿原酸对P. fluorescens生长曲线影响
对生长曲线进行测定能够更加深入地观察菌株的生长情况。由图3可知,低于3 mg/mL绿原酸浓度处理的P.fluorescens与对照组的生长趋势基本一致,0~2 h为细菌生长的迟缓期,2 h后开始进入生长对数期,经绿原酸处理的菌株生长稍缓于C4-HSL处理组和空白对照组,至12 h菌株生长趋于稳定,此时C4-HSL处理组的OD600值为1.40,空白对照组为1.41,添加1.5、2、2.5 mg/mL绿原酸的处理组OD600值分别为1.35、1.37、1.36,与空白对照组几乎保持一致,菌株的生长水平并没有受到明显影响。而经3 mg/mL绿原酸处理的P.fluorescens生长明显放缓,于3~4 h后开始进入生长对数期,在12 h时其菌体密度OD600为1.28。上述结果表明浓度低于3 mg/mL的绿原酸不影响P.fluorescens的生长,浓度到达3 mg/mL时能一定程度减缓P.fluorescens生长,但对最终的菌体浓度未造成显著影响(P>0.05)。
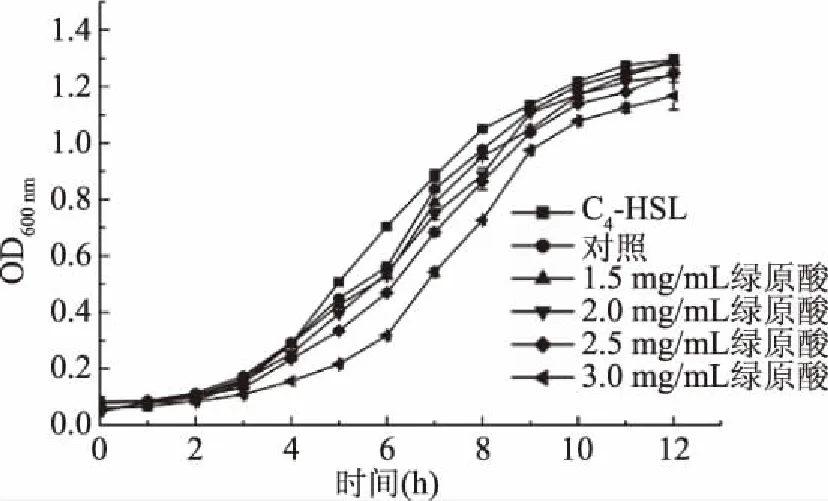
图3 绿原酸对荧光假单胞菌的生长曲线的影响Fig.3 Effect of chlorogenic acid on the growth curve of P. fluorescens
2.4 绿原酸对P. fluorescens腐败特性的影响
2.4.1 绿原酸对P.fluorescens嗜铁素产生的影响 嗜铁素的产生是腐败细菌拮抗竞争的一种方式[18],其作为P.fluorescens成为优势腐败菌的重要因子,主要通过对铁离子的竞争影响其他细菌的生长。荧光假单胞菌产生的嗜铁素络合食品基质中的铁离子,使其他微生物得不到足够的铁营养,生长发育受到抑制,从而使其能够维持自身的菌体密度[19]。李婷婷等[3]发现AHLs对温和气单胞菌嗜铁素产生具有调控作用。Stintzi等[20]报道了铜绿假单胞菌通过QS调控嗜铁素的产生量。CASAD嗜铁素平板法检测P.fluorescens嗜铁素晕圈,结果如图4所示。相比对照组,添加外源C4-HSL时嗜铁素水解圈直径明显增大,表示嗜铁素生成量增多,而绿原酸处理组嗜铁素的生成量明显降低,且呈浓度效应关系。这表明绿原酸可能通过干扰P.fluorescens由AHLs介导的群体感应系统有效抑制嗜铁素的产生,进而降低其致腐能力。

图4 C4-HSL和绿原酸对荧光假单胞菌嗜铁素产生的影响Fig.4 Effect of chlorogenic acid on the siderophore production of C4-HSL and P. fluorescens 注:1:C4-HSL;2:对照;3:1.5 mg/mL;4:2 mg/mL;5:2.5 mg/mL;6:3 mg/mL。
2.4.2 绿原酸对P.fluorescens蛋白酶活性的影响P.fluorescens是肉产品中主要的蛋白分解菌,具有产生高活性蛋白水解酶的能力[21]。其致腐机理是利用蛋白酶降解肉品中蛋白质,促进自身生长繁殖,同时产生异味和挥发性盐基氮并使肉软化,导致肉品风味和品质发生劣变,甚至产生有毒有害物质[22]。本文探究不同浓度绿原酸对P.fluorescens胞外蛋白酶活性的抑制作用,结果如图5所示。与未添加绿原酸处理的对照组相比,C4-HSL处理组水解圈直径更大,经绿原酸处理后蛋白酶水解圈直径明显减小,且水解圈直径与绿原酸浓度呈负相关。

图5 C4-HSL和绿原酸对荧光假单胞菌胞外蛋白酶活性的影响Fig.5 The effects of C4-HSL and chlorogenic acid on extracellular protease activity of P. fluorescens注:1:C4-HSL;2:对照;3:1.5 mg/mL;4:2 mg/mL;5:2.5 mg/mL;6:3 mg/mL。
相关研究表明,细菌蛋白酶的分泌受到QS系统的调控[6],且通过添加姜油酮[23]、富马酸钠[24]等QSI发现,细菌胞外蛋白酶分泌量明显降低。牛奶平板法能初步定性显示蛋白酶的含量,为了定量细菌所产胞外蛋白酶,进一步确定受AHLs介导的QS系统是否参与调控P.fluorescens胞外蛋白酶的分泌,探究不同浓度绿原酸对P.fluorescens胞外蛋白酶活性的影响,采用蛋白酶试剂盒法检测蛋白酶活性。结果如图6所示,经外源C4-HSL诱导的细菌菌液上清中蛋白酶活性显著高于包括空白组在内的其他处理组(P<0.05),高达0.834 U/mg prot,提示QS系统参与调控其胞外蛋白酶的产生。且随着添加绿原酸浓度的升高,P.fluorescens胞外蛋白酶活性逐渐降低,除2和2.5 mg/mL绿原酸处理组间差异无统计学意义之外(P>0.05),其余绿原酸处理组之间比较差异均有统计学意义(P<0.05)。绿原酸浓度为3 mg/mL时,胞外蛋白酶活性降低为0.26 U/mg prot。表明绿原酸可通过干扰AHLs介导的QS系统来抑制P.fluorescens胞外蛋白酶活性,且浓度越高,抑制作用越强。
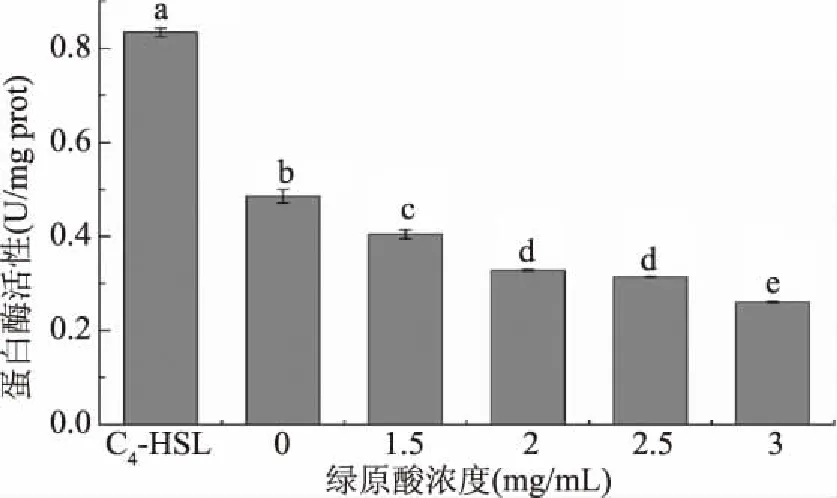
图6 C4-HSL和绿原酸对荧光假单胞菌胞外蛋白酶活性的影响Fig.6 The effect of C4-HSL and chlorogenic acid on extracellular protease activity of P. fluorescens注:不同字母表示差异显著(P<0.05)。图7同。
2.4.3 绿原酸对P.fluorescens脂肪酶活性影响 肉品中的腐败菌能产生降解肌肉组织的脂肪酶,将甘油三酯降解为甘油或脂肪酸,从而改变禽畜肉组织结构导致腐败。脂肪酶活性可能受到由AHLs介导的QS系统参与调控,为探究不同浓度绿原酸对P.fluorescens胞外脂肪酶活性的影响,采用p-NPP比色法测定不同处理菌株的脂肪酶活性,结果由图7可知。通过比较分析发现,当C4-HSL存在时脂肪酶活性最高,达0.49 U/mL,其余实验组酶活性均显著低于C4-HSL处理组(P<0.05),提示其胞外脂肪酶的产生受到QS系统影响。各浓度绿原酸处理组比较差异均有统计学意义(P<0.05)。其中经3 mg/mL绿原酸处理后P.fluorescens酶活性最低,仅为0.074 U/mL。说明绿原酸能明显抑制荧光假单胞菌胞外脂肪酶活性,且浓度越高,抑制作用明显。研究中发现P.fluorescens脂肪酶活性普遍偏低,可能与培养基和发酵等培养条件相关;其次有研究表明细菌脂肪酶的分泌需要同源分泌系统,但细菌脂肪酶基因一般受到严格的表达调控,其机制和途径复杂,导致细菌脂肪酶(特别是假单胞菌属脂肪酶)产量普遍不高[25]。

图7 C4-HSL和绿原酸对荧光假单胞菌胞外脂肪酶活性的影响Fig.7 The effect of C4-HSL and chlorogenic acid on extracellular lipase activity of P. fluorescens
2.4.4 绿原酸对P.fluorescens群集与泳动的影响 群集和泳动作为细菌的两种迁移方式,其区别在于前者是群体行为,指细菌在大于0.45%的琼脂培养基上的表面迁移,后者则是一种个体行为,指细菌在小于0.45%的琼脂培养基表面迁移[26-27]。细菌鞭毛介导的运动特性在定殖到宿主表面及后续生物被膜形成过程中起到重要作用[28]。细菌的运动性被证实在定植到宿主表面后菌体聚集导致微菌落及后继形成生物膜的过程中发挥关键作用[29]。图8、图9为不同浓度下绿原酸对P.fluorescens群集与泳动的抑制效果图。由图8、图9可以看出,添加C4-HSL的处理组菌株运动能力明显强于对照组和其他任何浓度绿原酸处理的菌株,其群集与泳动直径分别为27.26、30.10 mm,进一步说明了AHLs可调控P.fluorescens的运动能力,而经绿原酸处理后荧光假单胞菌的运动性受到明显的抑制,且P.fluorescens群集和泳动运动特性与绿原酸的添加量呈负相关。表明P.fluorescens运动能力受群体感应系统调控,且绿原酸可能干扰了荧光假单胞菌鞭毛粘附至接触面的能力[28],进而影响其致腐能力。

图8 C4-HSL和绿原酸对荧光假单胞菌群集(a)和泳动(b)的影响Fig.8 The effects of C4-HSL and chlorogenic acid on swarming and swimming of P. fluorescens注:1:C4-HSL;2:对照;3:1.5 mg/mL;4:2 mg/mL;5:2.5 mg/mL;6:3 mg/mL。
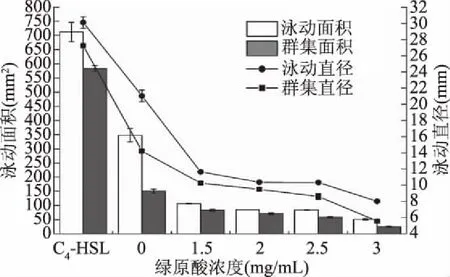
图9 C4-HSL和绿原酸对荧光假单胞菌运动区直径和面积的影响Fig.9 The effect of C4-HSL and chlorogenic acid on diameter and area of the motility zone of P. fluorescens
3 结论
利用紫色杆菌CV026检测模型证明了绿原酸具有群体感应抑制活性;绿原酸在不影响P.fluorescens正常生长的条件下明显抑制了P.fluorescens与腐败相关的生物特性。P.fluorescens这些腐败特性的表达均受由信号分子介导的QS的调控,当添加3 mg/mL以下亚抑菌浓度的绿原酸时,嗜铁素、蛋白酶活性、脂肪酶活性、群集和泳动能力均受到明显的抑制,且随着绿原酸浓度的增加,抑制效果更趋明显。此外,HPLC-MS/MS检测结果表明,绿原酸能够有效降低P.fluorescensAHLs的释放。因此推测绿原酸可能通过降解P.fluorescens信号分子的方式来阻断P.fluorescens的群体感应系统,从而减弱其腐败特性的表达,证实了绿原酸良好的群体感应抑制活性,但对其调节细菌AHLs的分泌进而抑制致腐能力的分子机制尚未明了,因此可以进一步解析绿原酸对腐败菌QS系统的调控靶点及作用方式,为其作为新型QSIs的开发提供理论支撑,促进其在食品防腐保鲜中发挥优势作用。
