植物LEAFY基因的起源和进化分析
2020-05-03刘嘉欣陈志阳
刘嘉欣 陈志阳

摘 要:植物LEAFY(LFY)基因编码植物特有的一类转录因子,在显花植物营养生长向生殖生长的转变中起了重要作用。本研究采用同源性检索、系统进化分析和正选择作用检测等方法对植物LEAFY基因进行了系统的进化分析,结果发现植物LEAFY基因最早起源于轮藻,并在陆生植物基因组中稳定遗传下来;不同陆生植物基因组的LEAFY基因具有相似的基因结构;单子叶植物的LEAFY基因经历了明显的正选择作用,而玉米和油棕中分别具有2个LEAFY基因,且其中的一个经历了正选择作用,可能与新功能的形成及功能分化有关。
关键词:植物;LEAFY基因;系统进化;正选择作用
The origin and evolution of the plant LEAFY gene
Liu Jiaxin Chen Zhiyang
Jiangsu Key Laboratory of Crop Genetics and Physiology/Key Laboratory of Plant Functional Genomics
of the Ministry of Education/Jiangsu Key Laboratory of Crop Genomics and Molecular Breeding,
Agricultural College of Yangzhou University JiangsuYangzhou 225009
Abstract:The plant LEAFY(LFY) gene encodes a type of plant-specific transcription factors,which plays an important role in the transformation of vegetative to reproductive growth in flowering plants.In this study,a comprehensive analysis of sequence similarity,phylogenetic analysis and positive selection was performed to investigate the molecular evolution of LEAFY genes in plants.The results revealed that the plant LEAFY genes have first emerged in the streptophyte algae,and then were stably inherited in land plant genomes.Gene structure analysis suggested that plant LEAFY genes shared similar gene structure in different genomes of land plants.In addition,LEAFY genes have undergone positive selection in monocots,whereas only one of both two LEAFY genes in Zea mays and Elaeis guineensis were detected under positive selection,respectively,which might be associated with the formation of novel function and functional divergence.
Key words:Plant;LEAFY gene;Phylogenenetic analysis;Positive selection
植物在由營养生长向生殖生长的转变过程中,需要多个基因协同调控。其中LEAFY基因在该过程中具有至关重要的作用[1]。LEAFY基因编码植物特有的一类转录因子,在金鱼草中克隆的LEAFY基因FLORICAULA具有启动植物开花过程并调控花生长发育的作用。拟南芥LEAFY基因的突变体具有与金鱼草同源基因相似的功能,而过表达该基因则使得植株花期提前,并且侧枝均被单一花器官所替代。除了调控花的生长发育之外,LEAFY基因还具有调控烟草顶端分生组织发育、番茄复叶发育和水稻花序分枝等功能[3,4]。
在大部分显花植物中,LEAFY基因只具有一个拷贝[5],并且每一LEAFY基因通常具有2个内含子,其第二个内含子经常被用来作为被子植物系统发育分析的参考序列。在玉米基因组中,具有2个LEAFY基因,分别是Zfl1和Zfl2,其突变体具有与其他植物相似的调控花器官生长发育的作用,并且在不同的玉米杂种优势群中,具有明显人工选择的信号[6]。本文拟基于在基因组水平上对LEAFY基因的鉴定,通过系统进化树分析该基因在植物中的进化规律,并通过正选择作用的分析,阐明其在禾本科植物进化过程中经历的选择压力。
1 材料与方法
1.1 植物LEAFY基因的鉴定
利用拟南芥(AtLFY)和玉米的LEAFY基因(Zfl1和Zfl2)编码的蛋白质序列作为检索序列,采用BLASTP检索Phytozome[9]和NCBI的nr和ref_seq序列数据库,获得植物代表性物种基因组中的LEAFY同源基因,并下载相应的编码区序列和基因组序列。
1.2 植物LEAFY基因序列分析与系统进化树构建
通过Cluster X[7]对所有代表性物种LEAFY蛋白序列进行比对,将比对结果输入MEGA[8]软件中,分别采用极大似然法(ML)法和邻接法(NJ)构建系统进化树。极大似然法和邻接法参数设置都为JTT模型,bootstrap重抽样100次以获取每一分枝的支持率。系统进化树的显示利用MEGA软件。
1.3 正选择作用检测
利用PAML[9]中的CODEML软件包对所有单子叶植物LEAFY基因的dN/dS(ω)值进行计算。使用PAL2NAL软件[10]对代表性物种蛋白质和与之对应的核苷酸序列进行转换,得到对齐的核苷酸序列,将该序列输入CODEML程序进行分析。
利用“位点特异性”模型中的M3/M0和M8/M7进行似然比检验(LRT)。其中M3/M0模型用来检测编码位点之间选择压力的差异,而M8/M7模型用来对正选择作用位点进行估计。在每个似然比检验中,对两对模型的对数似然值差数的2倍(2ΔlnL)进行卡方(χ2)测验,自由度为模型中参数个数的差值。其中M3/M0模型LRT的自由度为3,M8/M7模型LRT的自由度为2。
利用“分枝-位点”模型检测正选择对单子叶植物LEAFY基因在植物的固定中起到的作用。分别设定单子叶植物基因簇中的每个基因为前景枝,剩余为背景枝,进行正选择作用检测。通过比较备择假设和无效假设对9个单子叶植物LEAFY基因受到的选择压力进行适应性分析。在似然比测验为显著的前提下,进一步利用贝叶斯经验贝叶斯(BEB)方法计算前景枝中每个位点经历的正选择作用后验概率值。
2 结果与分析
2.1 植物LEAFY基因的鉴定
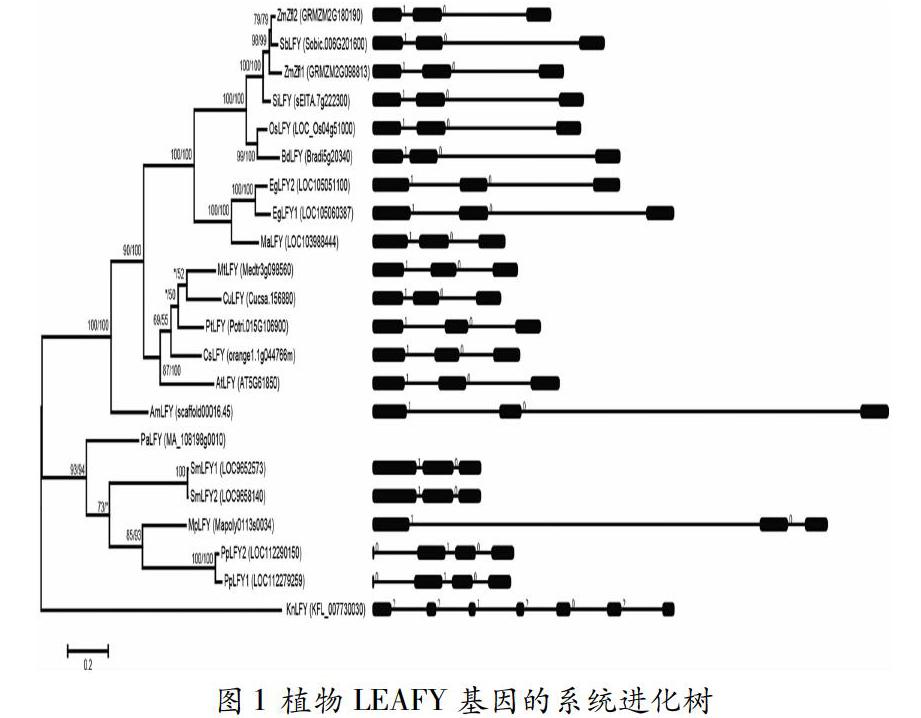
本研究分别以拟南芥和水稻的LEAFY基因作为检索序列,在NCBI的nr数据库中进行了检索,结果发现LEAFY基因仅存在于植物中,在其他物种中没有发现同源基因。进一步分析发现在绿藻中也不存在同源基因,但在轮藻Klebsormidium nitens基因组中具有同源基因。除此之外,虽然没有获得轮藻Chara vulgaris基因组中的全长基因序列,但在该基因组中也有部分同源序列。而在陆生植物基因组中则普遍具有同源基因。由此表明,LEAFY基因最早起源于轮藻,并传递到所有陆生植物中。
为进一步阐明该基因在植物中的起源和进化模式,本研究筛选了陆生植物18个代表性物种对该基因的进化进行分析。LEAFY基因在这些物种的基因组中分布不均衡,其中玉米、油棕、小立碗藓和江南卷柏中具有2个LEAFY基因,而在其他植物的基因组中只具有1个LEAFY基因。
2.2 植物LEAFY基因的系统进化分析
对18个代表性植物的22个LEAFY基因分别采用极大似然法和邻接法构建了系统进化树,两种方法构建的系统进化树具有相似的拓扑结构,并且系统进化关系与植物系谱进化关系比较一致。此外,4个物种中具有的LEAFY旁系同源基因均位于进化树的末端或相对末端,表明这些旁系同源基因是其物种基因组与其他主要系谱分化之后通过复制形成的。进一步分析了不同物种LEAFY基因的外显子/内含子结构,结果发现除了轮藻Klebsormidium nitens的KnLFY基因之外(6个内含子),植物LEAFY普遍具有2-3个内含子,并且内含子所在的位置是非常保守的。
2.3 单子叶植物LEAFY基因的选择压力分析
正选择检测的“位点特异性”模型能有效估算一组同源基因的正选择效应,本研究基于该模型对单子叶植物LEAFY基因进行了正选择检测。在该模型下,每个位点的dN/dS(ω)值不同,当ω>1时,认为位点经历了正选择作用。首先通过比较M0和M3模型估算每个氨基酸位点的ω值,从而判断同源基因在进化过程中是否存在不同的选择压力。结果发现M0模型下ω估计值为0.0752,表明纯化选择是单子叶植物LEAFY基因进化过程中受到的主要选择压力。然而基于M3/M0的似然比测验发现达到了显著水平,表明不同氨基酸位点存在选择压力的差异。进一步通过M8/M7模型的似然比测验鉴定受到正选择作用的氨基酸位点,结果发现该基因在单子叶植物中的进化受到了正选择作用的影响。在M8模型下进行了贝叶斯后验概率估计,发现了5个氨基酸位点存在明显的正选择作用。
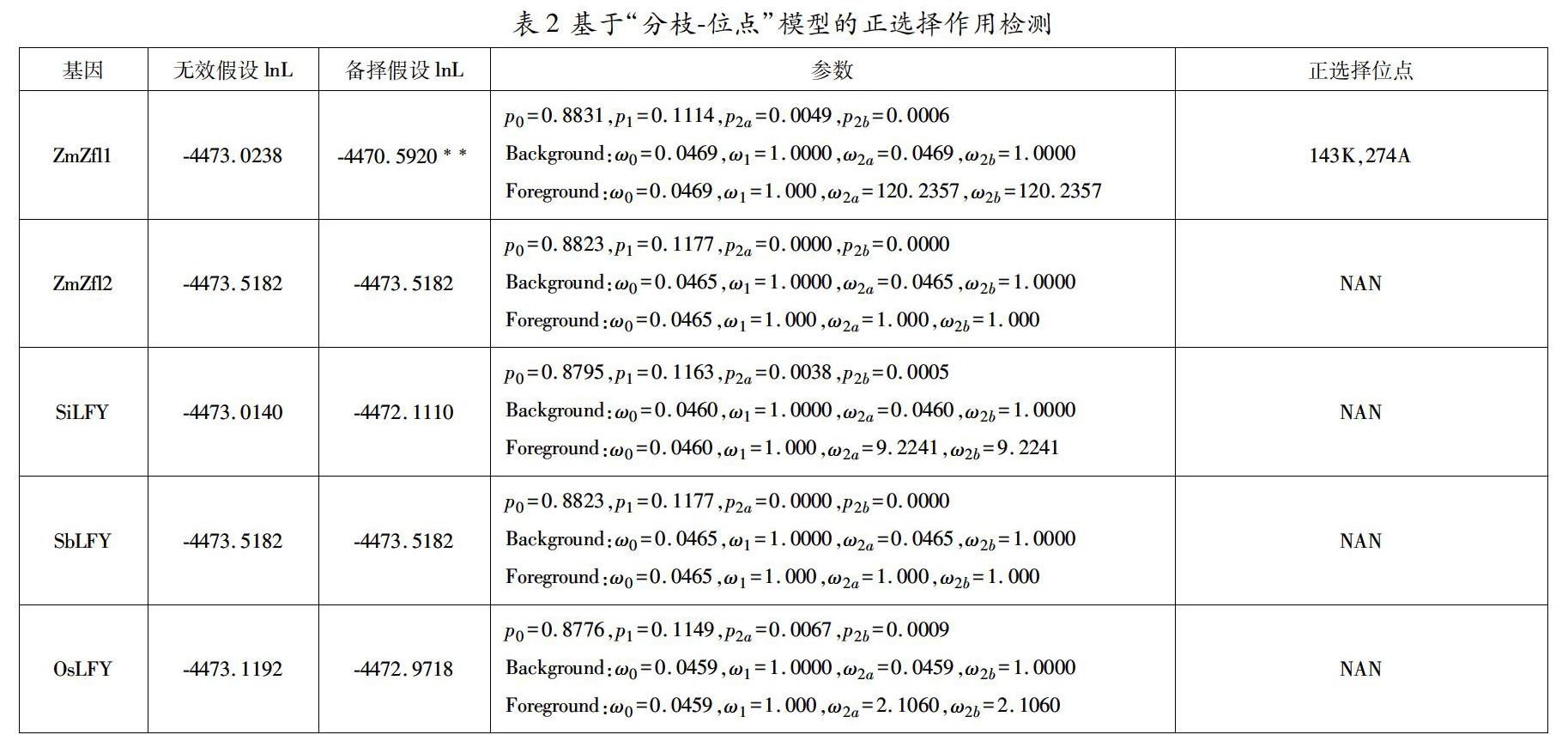
进一步利用“分枝-位点”模型检测9个单子叶植物LEAFY基因的正选择作用位点,通过比较备择假设和无效假设对这些基因受到的选择压力进行适应性分析,并通过贝叶斯方法对前景枝每个位点受到的正选择作用的后验概率进行估计(表2)。玉米Zfl1和Zfl2的LRT结果为一个显著一个不显著,说明正选择在玉米Zfl1的进化中起了重要作用。其中在玉米Zfl1中检测到2个平均后验概率大于50%的正选择位点143K和274A,油棕中两个LEAFY基因的LRT结果也为一个显著一个不显著,同样在EgLFY1基因中检测出了正选择位点166T和331A。说明在玉米和油棕的进化过程中,Zfl1和EgLFY1经历了正选择,进化出了新的功能,而Zfl2和EgLFY2经历了纯化选择,保留了其原始的功能。其中正选择位点143K和274A、166T和331A分别对Zfl1和EgLFY1基因功能的固定起到了关键作用。其余单子叶植物单拷贝LEAFY基因的LRT结果均未达到显著。
3 讨论
对植物LEAFY基因在主要代表性植物物种中的分布进行分析,发现其同源基因只存在于植物中,并且在绿藻中没有同源基因,但在轮藻中存在同源基因,由此表明LEAFY基因起源于链形植物(包括轮藻和陆生植物)的祖先物种。直系同源基因是指起源于共同祖先但存在于不同物種之间的基因,基因复制则是在同一物种中发生的。在所有已测序的基因组中都存在大量的基因复制现象,通过重复基因之间的功能冗余,可以保持遗传系统的稳定[11]。本研究对植物LEAFY基因的起源以及进化模式进行分析,发现该基因在大部分代表性植物物种中仅存在单拷贝,在部分物种,如玉米、油棕、江南卷柏和小立碗藓中存在基因复制现象,但也只存在2个拷贝。
选择压力(用ω值表示)作为进化驱动力,对基因功能多样性的形成起到了关键作用,ω<1、ω=1和ω>1分别代表了纯化选择、中性进化和正选择,其中正选择是物种适应环境的表现,有利于获得新的基因和功能,而纯化选择有助于基因保留有利的功能[12,13]。对单子叶植物LEAFY基因的选择压力进行分析,发现纯化选择是单子叶植物LEAFY基因在进化过程中受到的主要选择压力,但是在不同基因上存在差异。基因重复是遗传创新的重要来源,新功能化和亚功能化都是基因家族中重复基因的进化模式[14],在遗传变异过程中可以使作物获得新的功能从而应对环境的变化。FLO/LFY在植物从营养生长向生殖生长的转变中起着重要的作用,其玉米中的同源基因Zfl1和Zfl2在生殖发育中的功能很大程度上是非常保守的[15]。本研究发现,玉米的两个LEAFY基因中,只有Zfl1基因经历了正选择作用。正选择作用往往与新功能的产生或功能分化有关,由此说明玉米的Zfl1和Zfl2基因具有功能分化。这两个重复基因的功能分化已经通过数量性状位点(QTL)定位的方法得到了证实,Zfl1主要行使与开花时间相关的功能,而Zfl2主要调控分枝和花序的结构[16]。由此表明,单拷贝基因往往具有保守的功能,而重复基因往往由于正选择作用等产生功能分化。
参考文献:
[1]Coen E S,Romero J M,Doyle S,et al.floricaula:a homeotic gene required for flower development in antirrhinum majus[J].Cell 1990,63(6):1311-1322.
[2]张亚萍,习珺珺,于丽霞,等.LEAFY(LFY)基因在花发育网络调控中的研究进展[J].现代农业科技,2012,9:11-13.
[3]冯延芝,李芳东,王璐,等.LEAFY同源基因系统进化及研究進展[J].中南林业科技大学学报,2016,36(2):25-32.
[4]Van de Peer Y,Mizrachi E,Marchal K.The evolutionary significance of polyploidy[J].Nature Reviews Genetics,2017,18(7):411-424.
[5]Bomblies K,Wang R L,Ambrose B A,et al.Duplicate FLORICAULA/LEAFY homologs zfl1 and zfl2 control inflorescence architecture and flower patterning in maize[J].Development,2003,130(11):2385-2395.
[6]Goodstein D M,Shu S,Howson R,et al.Phytozome:a comparative platform for green plant genomics[J].Nucleic acids research,2012,40(D1):D1178-1186.
[7]Tuimala J.Using ClustalX for multiple sequence alignment[J].Methods Enzymol,2004,226:383-402.
[8]Kumar S,Stecher G,Tamura K.MEGA7:Molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets[J].Molecular biology and evolution,2016,33(7):1870-1874.
[9]Yang Z.PAML:a program package for phylogenetic analysis by maximum likelihood[J].Bioinformatics,1997,13(5):555-556.
[10]Suyama M,Torrents D,Bork P.PAL2NAL:robust conversion of protein sequence alignments into the corresponding codon alignments[J].Nucleic acids research,2006,34(suppl_2):W609-W612.
[11]Lynch M,Conery J S.The evolutionary fate and consequences of duplicate genes[J].Science,2000,290(5494):1151-1155.
[12]Klassen J L.Pathway evolution by horizontal transfer and positive selection is accommodated by relaxed negative selection upon upstream pathway genes in purple bacterial carotenoid biosynthesis[J].Journal of bacteriology,2009,191(24):7500-7508.
[13]Kosiol C,Vinarˇ T,da Fonseca R R,et al.Patterns of positive selection in six mammalian genomes[J].PLoS genetics,2008,4(8):e1000144.
[14]Sandve S R,Rohlfs R V,Hvidsten T R.Subfunctionalization versus neofunctionalization after whole-genome duplication[J].Nature genetics,2018,50(7):908-909.
[15]Hofer J,Turner L,Hellens R,et al.UNIFOLIATA regulates leaf and flower morphogenesis in pea[J].Current Biology,1997,7(8):581-587.
[16]Bomblies K,Doebley J F.Pleiotropic effects of the duplicate maize FLORICAULA/LEAFY genes zfl1 and zfl2 on traits under selection during maize domestication[J].Genetics,2006,172(1):519-531.
作者简介:刘嘉欣(1995-),女,江苏常州人,扬州大学农学院硕士硕士,主要从事作物遗传育种研究。
