2型糖尿病小鼠模型血糖干预评价点的实验观察
2020-05-03蒲瑞阳史典刘莎程宁
蒲瑞阳,史典,刘莎,程宁
(兰州大学基础医学院甘肃省新药临床前研究重点实验室,兰州 730000)
动物模型是研究2型糖尿病发病机制和药物评价的常用方法,其中高热量饮食加适量链脲佐菌素(STZ)破坏部分胰岛细胞的方法与人类2型糖尿病发病机制相似,且造模周期短、造模后相对可靠稳定,是目前常用的T2DM造模方法[1]。但是至今为止,国内外对T2DM造模的方法仍没有统一的标准,大多数研究中STZ剂量及血糖评价时间点和成模后血糖标准也都各不相同[1-2]。
此外,血糖干预评价的时间点和血糖标准也是影响2型糖尿病模型是否成功的关键。很多研究中选择造模后空腹血糖(FPG)大于7.8 mmol/L或随机血糖大于16.7 mmol/L作为模型成功的标准[3-5],也有研究选择空腹血糖大于11.1 mmol/L[2]。至于哪种评价标准更合理,并没有明确的标准和相关探讨性研究。很多研究也会通过口服葡萄糖耐量实验(OGTT)来判断模型是否为2型糖尿病,而且OGTT也是临床诊断糖尿病最常用的实验[6]。但是糖尿病造模及药物干预过程中,需频繁测血糖,但OGTT不适合大批量频繁监测,因此,本研究提出在早上固定时间禁食2 h,评估餐后2 h血糖作为T2DM小鼠模型血糖干预评价点,并设计实验进行探究和稳定性分析,为今后2型糖尿病模型的建立和评价提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
70只SPF级雄性C57BL/6小鼠,8周龄,体重18 ~ 20 g,购于中国农业科学院兰州兽医研究所【SCXK(甘)2015-0001】。小鼠饲养于兰州大学公共卫生学院实验动物中心【SYXK(甘)2018-0002】,动物房室温20 ~ 25℃,湿度30% ~ 60%,12 h明暗交换。动物自由进食、进水,开始实验前动物适应性喂养1周。
1.1.2 试剂与仪器
避光称取所需的STZ(美国Sigma-Aldrich 公司,批号S0130),在避光、冰浴条件下用柠檬酸-柠檬酸钠缓冲液(pH 4.2,浓度0.1 mmol/L)溶解,现配现用,并于10 min内注射完毕。
1.2 方法
1.2.1 糖尿病小鼠模型制备
取30只小鼠,给予普通小鼠维持饲料适应性喂养1周,通过随机数字表随机将小鼠分为正常对照组(n=10)和造模组(n=20),正常对照继续普通饲料喂养,造模组给予高脂饲料喂养(高脂饲料各成分含量是在65%大小鼠维持饲料基础上,添加10%猪油、20%蔗糖、2.5%胆固醇、1%胆酸钠、1%矿物质混合物、0.5%维生素混合物,购自北京博爱港商贸有限公司),连续喂养4周后,造模组以50 mg/kg STZ剂量造模,禁食不禁水12 h,连续腹腔注射3次,隔3天测血糖,继续禁食后腹腔注射2次。在完成5次STZ注射后第7天,测定小鼠空腹血糖及餐后2 h血糖,以造模小鼠出现明显“三多一少”症状,且血糖达到空腹血糖大于7.8 mmol/L,餐后2 h血糖大于11.1 mmol/L为造模成功。
1.2.2 空腹血糖测定
采用ACCU-CHEK® Performa(德国罗氏公司)罗氏血糖仪及试纸条测定两组小鼠连续空腹血糖。随机选取已成功造模的糖尿病小鼠及正常小鼠各10只,并统一剪趾标记。两组小鼠夜间禁食12 h,测定空腹血糖。3 d后,测定两组小鼠日间连续空腹血糖,即夜间正常饮食,次日早晨8:00换笼、撤食、不撤水,并开始测定0时血糖,每隔1 h测1次血糖,连续测定4 h内的血糖,之后每两小时测定1次血糖,连续4次直至完成12 h内小鼠连续血糖。
1.2.3 随机血糖测定
次日将上述方法1.2.2中的两组小鼠自由给食给水,于上午8:00开始测定0时血糖,每隔1 h测1次血糖,连续测定4 h内的血糖,之后每2 h测定1次血糖,连续4次直至完成12 h内小鼠连续血糖。
1.2.4 餐后2 h血糖长期观察
另取40只小鼠制备T2DM小鼠模型(方法同1.2.1)。同时以8只正常小鼠为空白对照。观察两组小鼠连续7周内餐后2 h的血糖及体重变化,每周测1次。作每周血糖及体重波动散点图,观察糖尿病小鼠血糖稳定性,探讨餐后2 h作为评价T2DM小鼠模型血糖评价点的可行性及稳定性。
1.3 统计学分析
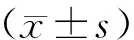
2 结果
2.1 T2DM组及对照组小鼠造模前后空腹血糖及体重
20只小鼠以50 mg/kg STZ按上述方法所述注射5次完成造模,并测定造模完成后5日血糖,其中餐后2 h血糖大于11.1 mmol/L的16只,其余4只小于10 mmol/L,成模率80%。随机选取10只成模小鼠作为模型组,分别测定对照组与模型组小鼠造模前后体重和空腹血糖。如图1所示,造模前两组小鼠体重无差异(P> 0.05),造模过程中两组小鼠经过4周喂养,对照组与T2DM组小鼠体重分别为(24.0 ± 1.0)g和(23.8 ± 0.98)g,体重明显上升(P< 0.0001)。注射STZ造模后,T2DM组小鼠体重下降至(23.2 ± 0.53)g,与正常组小鼠相比差异有统计学意义(P< 0.01);空腹血糖分析结果显示,造模前两组小鼠空腹血糖无差异。糖尿病小鼠造模前后血糖分别为(7.1 ± 1.02)mmol/L和(9.1 ± 2.55)mmol/L, 血糖变化明显(P< 0.05); 造模后糖尿病小鼠与正常组小鼠空腹血糖差异具有显著性(P< 0.05)。
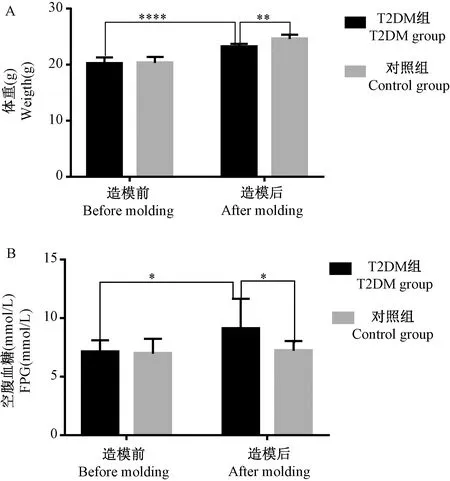
注:(A)T2DM组造模后体重与造模前相比显著增加,****P < 0.0001;造模后,T2DM组体重与正常对照组相比明显降低,**P < 0.01。(B) 造模后T2DM组空腹血糖与造模前相比明显升高,*P< 0.05;造模后T2DM组空腹血糖与正常对照组相比明显升高,*P < 0.05。图1 造模前后糖尿病组和正常组小鼠体重与空腹血糖Note. (A) The weight of T2DM group was significantly higher than before modeling,****P <0.0001. Compared with the control group, the weight of T2DM group decreased significantly after modeling, **P< 0.01. (B) The FPG of T2DM group was significantly higher than before modeling,*P < 0.05.Compared with the control group, the FPG of T2DM group increased significantly after modeling, *P < 0.05.Figure 1 Body weight and FPG of diabetic and normal mice before and after modeling
2.2 T2DM组及正常组小鼠连续空腹血糖
T2DM组小鼠从0 h撤去食物后至1 h血糖迅速下降;2 ~ 3 h期间,血糖变化相对稳定,并一直处于较高水平。空腹4 h后血糖大幅下降,此后6 ~ 8 h糖尿病小鼠血糖持续降低,至12 h,血糖降至12.4 mmol/L。 T2DM组小鼠空腹4 ~ 12 h期间降幅超过7 mmol/L。然而正常组小鼠禁食12 h期间血糖稳定在正常范围内,主要变化趋势为禁食1 h以后逐渐缓慢下降,空腹4 h后轻微上升,4 ~ 12 h期间波动幅度不超过1 mmol/L,如图2所示。

图2 糖尿病小鼠及正常组小鼠连续空腹血糖Figure 2 Continuous fasting glucose in diabetic mice and normal mice
2.3 糖尿病小鼠及正常小鼠连续随机血糖
两组小鼠自由饮食饮水,自8:00开始测12 h内连续随机血糖,血糖变化如图3所示。T2DM组小鼠在不禁食状态下,血糖随着小鼠进食变化较大,8 ~ 12 h期间血糖相对稳定在较高水平,可能是受小鼠进食规律的影响。因此总体来说,正常组小鼠随机血糖稳定在正常范围内,而T2DM小鼠随机血糖波动较大。
2.4 T2DM造模组小鼠及对照组小鼠7周内体重及餐后2 h血糖变化
40只T2DM造模组小鼠中死亡2只,造模完成第4周餐后2 h血糖 > 11.1 mmol/L的32只,成模率为80%,存活率95%。7周内40只T2DM造模组小鼠及对照组小鼠体重及餐后2 h血糖结果进一步验证了餐后2 h血糖作为评价2型糖尿病模型血糖评价点的可靠性和稳定性,如图4及图5所示。图4显示T2DM小鼠在造模完成后一周血糖有上升趋势,第4周开始血糖持续稳定且明显高于对照组。T2DM组小鼠在造模后的2周内体重会明显降低,第4周开始逐渐恢复并保持稳定,而对照组小鼠7周的血糖和体重均处于稳定状态。由此可见,餐后2 h血糖可以相对准确地反映糖尿病模型中血糖变化情况及模型的稳定性。
3 讨论
目前国内外研究中2型糖尿病模型造模标准不一,尽管很多通过探讨不同STZ剂量、注射次数来评价及优化造模条件,但由于各实验室具体环境、小鼠批次等因素的影响,各个研究间STZ剂量和注射次数仍然不完全统一,值得注意的是各研究中评价模型的血糖标准也各不相同[7-9]。STZ剂量和次数可以根据每次试验的具体情况通过预实验来确定,但模型血糖评价点和评价标准理应是固定且稳定的。遗憾的是,并没有相关研究详细阐述糖尿病模型的血糖标准,很多研究也并没有说明选择血糖评价标准的依据,导致多数研究盲目从众选择, 造成糖尿病模型评价没有广泛认同的标准,给糖尿病模型及相关研究造成了一定的困难。

图3 糖尿病小鼠与正常组小鼠连续随机血糖Figure 3 Continuous random blood glucose in diabetic mice and normal mice
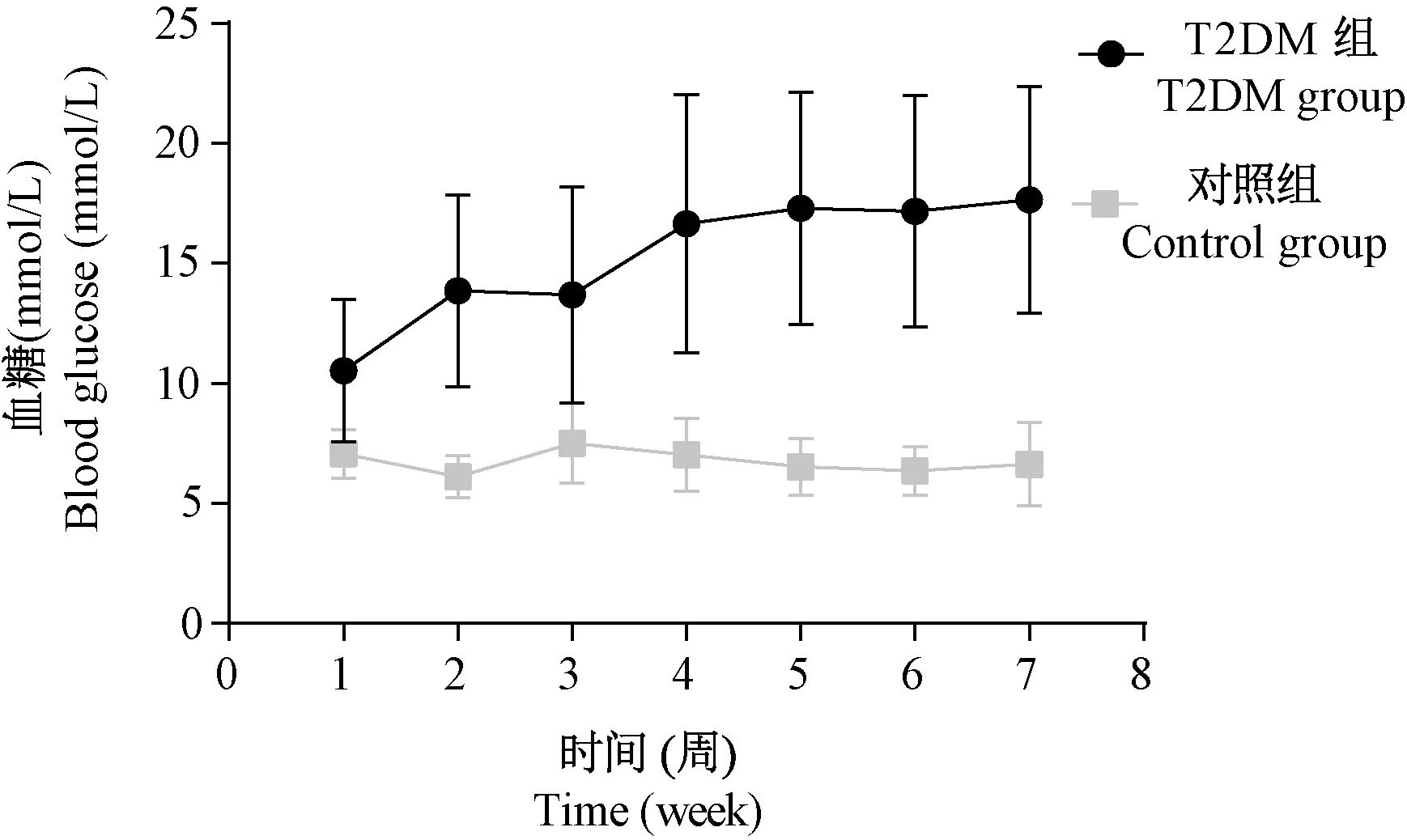
图4 糖尿病小鼠及对照组小鼠连续7周内餐后2 h血糖变化图Figure 4 Changes in 2 h postprandial blood glucose within 7 consecutive weeks of diabetic mice and normal mice

图5 糖尿病小鼠及对照组小鼠连续7周内体重变化图Figure 5 Changes in body weight of diabetic mice and normal mice within 7 consecutive weeks
研究发现STZ是诱导β细胞凋亡造成胰岛功能损伤的,大剂量STZ注射会造成胰岛β细胞大量破坏而出现1型糖尿病[6]。最近T2DM小鼠模型的相关研究中,作者张吟等以空腹12 h血糖 > 11.1 mmol/L为T2DM成模标准,认为高剂量STZ造模后空腹血糖持续在25 ~ 30 mmol/L,胰腺病理显示胰岛细胞大部分萎缩,胰岛体积明显缩小数量减少是理想的T2DM模型;但认为100 mg/kg STZ造模后,血糖虽> 11.1 mmol/L,但期间会上下波动,胰腺病理结果显示胰腺轻微损伤的模型效果不佳[2]。而本研究认为前者可能已经成为1型糖尿病模型;恰恰是后者的情况,比较符合本研究前期遇到的问题,即造模完成后,小鼠已经出现了明显的“三多一少”糖尿病症状,口服葡萄糖耐量实验(OGTT)中2 h血糖也> 11.1 mmol/L,但夜间禁食12 h后小鼠空腹血糖仍然达不到造模标准,或者空腹血糖持续升高时,小鼠已经有成为1型糖尿病的可能。因此,T2DM模型中,是否应一味追求空腹高血糖,还是应该寻找一个合理的血糖评价点?为进一步探索理想的血糖评价点,我们设计实验,并测定白天连续空腹血糖和连续随机血糖,分析小鼠血糖规律,以此寻找糖尿病小鼠血糖最佳评价点。
本研究通过连续空腹血糖和连续随机血糖实验结合实际造模经验,总结出了T2DM小鼠不同于正常小鼠的血糖变化规律。对于正常C57BL/6小鼠,不论是夜间禁食12 h的空腹血糖,还是白天禁食的连续空腹血糖,其血糖均能维持在正常范围内,不会出现较大的变化,这一结果与大部分研究中对照组血糖结果相符[2, 10]。但对于T2DM小鼠,由于糖尿病引起的血糖调节失衡,不能正常调节血糖,如果长时间夜间禁食,会导致空腹血糖过低而造成模型评价失真的情况。由于随机血糖不能确定小鼠进食的时间,有可能造成随机血糖大幅波动,也不利于T2DM模型的评价。本研究中,从T2DM小鼠连续空腹血糖实验结果可看出,对于造模体重在25 g左右的T2DM小鼠,白天禁食2 ~ 3 h期间血糖变化趋势相对稳定,且能较好反应真实的T2DM小鼠血糖情况,故选择餐后2 h血糖作为T2DM小鼠血糖评价点。
很多研究中也会通过OGTT判断糖尿病模型动物血糖情况[11-12],但鉴于OGTT操作复杂,并不适用于长期频繁监测以评价模型稳定性和药效。蔡清颜等在西格列汀对2型糖尿病小鼠降脂及改善炎症反应的研究中,以餐后2 h血糖> 16.7 mmol/L为T2DM造模成功的标准,但并未说明选择这一标准的依据[13]。本实验中之所以选取餐后2 h为糖尿病小鼠血糖评价点,不仅是根据严格的实验设计后得出的小鼠血糖规律,而且更接近临床OGTT实验和临床餐后2 h血糖。
为了进一步验证餐后2 h血糖评价T2DM小鼠模型血糖的稳定性,本研究连续监测40只糖尿病造模组小鼠和8只对照组小鼠7周内餐后2 h血糖和体重,发现餐后2 h血糖能稳定反应2型糖尿病模型的血糖情况,。由于STZ造模后对小鼠机体的短期伤害,小鼠体重会在造模后1 ~ 2周内明显下降,T2DM组小鼠在造模后出现明显的血糖上升,同时伴体重降低,随着模型的稳定,小鼠体重也趋于稳定,而正常组小鼠7周内血糖和体重都相对稳定,这一结果与大部分糖尿病模型长期观察的结果基本吻合[2, 14]。
综上所述,本研究首次通过连续12 h空腹血糖监测,初步得出T2DM小鼠空腹血糖变化规律,并通过长期监测验证了餐后2 h血糖作为评价T2DM模型血糖的稳定性,因此,餐后2 h血糖在评价小鼠T2DM模型中具有较好的实验血糖干预评价应用价值,为今后2型糖尿病C57BL/6小鼠模型造模及评价提供了可靠的依据,同时,对其他动物类型的T2DM模型也有参考和借鉴价值。
[收稿日期]2019-08-31
