模拟衰老大鼠星形胶质细胞条件培养基对神经干细胞增殖能力的影响
2020-05-03卢延华管博文刘旭吕颖王卫魏强孟爱民
卢延华,管博文,刘旭,吕颖,王卫,魏强,孟爱民
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
目前,越来越多的研究证明细胞衰老与疾病的发生发展关系密切[1],而脑内细胞的衰老与神经系统疾病的关系也逐渐得到研究者的关注[2-3]。星形胶质细胞是脑内存在数量最多的细胞类型,疾病损伤会使星形胶质细胞衰老,星形胶质细胞出现功能障碍时对大脑的结构和功能具有较大的影响,一方面结构支持功能丧失,另一方面也通过分泌衰老相关分泌表型(senescence-associated secretory phenotypes,SASP)、降低神经营养因子的分泌改变脑内微环境损伤神经细胞[4-5]。另外,神经退行性疾病和脑卒中多发于中老年人,目前仍然缺乏有效治疗,随着再生医学的发展,从上世纪末开始进行干细胞治疗的实验研究,大量的动物实验表明通过移植干细胞可有效改善疾病症状[6],但老年动物模型疗效比年轻动物模型差[7],说明不同的大脑微环境会对干细胞的功能产生影响,降低干细胞疗效。本研究模拟老年大鼠体内星形胶质细胞衰老,建立大鼠星形胶质细胞衰老模型,检测衰老的星形胶质细胞是否对胎鼠端脑神经干细胞增殖产生影响,用以探讨衰老的星形胶质细胞所导致的脑组织微环境的改变是否可以影响干细胞的功能。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级SD大鼠孕15 d胚胎及出生1 d新生鼠,购于北京华阜康生物科技股份有限公司【SCXK(京)2014-0004】。本实验通过了实验动物伦理审查会审批(IACUC号:MAM19001)。
1.1.2 试剂与仪器
DMEM/F12 HEPES培养基(Gibco,11330032),B27(Gibco,17504044),NEAA(Gibco,11140050),N2添加剂(invitrogen,17502048),rat EGF(peprotech,400-25-20),rat bFGF(peprotech,400-29-10),L-谷氨酰胺(solarbio,G0200),青链霉素(碧云天,C0222),FBS(hyclone,SH30406.05),30% H2O2(天津市大茂化学试剂),0.25% trypsin(hyclone,SH30042.01),accutase消化酶(gibco,A1110501),Poly-D-lysine hydrobromide(PDL,sigma,P0296),细胞衰老β-半乳糖苷酶染色试剂盒(β-gal,碧云天,C0602),Anti-Glial Fibrillary Acidic Protein(GFAP)antibody(R&D,MAB1195),Anti-nestin Antibody(chemicon,MAB353),Goat anti-Rabbit IgG secondary antibody, Alexa Fluor 594(invitrogen,R37117),Goat anti-Rat IgG Secondary Antibody, Alexa Fluor 594(invitrogen,A11007),封闭用正常山羊血清工作液(北京中山金桥生物科技公司,ZLI9056),MTT(Thermo Fisher,M6494)。
荧光显微镜(leica,DMi8,德国),酶联免疫检测仪(Thermo Fisher,51119200,美国),countstar自动细胞计数仪(上海睿钰生物科技有限公司,IC-1000,中国)。
1.2 方法
1.2.1 原代细胞分离及纯化
新生大鼠皮层星形胶质细胞(astrocyte,AS)[8]:取新生鼠大脑,剪去嗅球、小脑和脑干,夹取皮层机械剪碎呈乳糜状,加入0.25% trypsin 37℃消化15 min,待组织呈絮状时加入10% FBS/DMEM终止消化,1000 r/min离心7 min,弃上清,以AS培养基(DMEM/F12+10% FBS+1% L-谷氨酰胺+1%双抗)重悬,过滤并计数,调整细胞浓度为1 × 106/mL,接种在事先用PDL包被过的 25T培养瓶中,细胞贴壁生长,4 h后更换培养基,之后连续培养数天,待细胞长满基本融合,置37℃恒温摇床以200 r/min振摇4 h进行纯化,弃去培养基,加入0.25% trypsin消化5 min,收集细胞悬液,1500 r/min离心5 min,弃上清,AS培养基重悬并继续培养至第3代备用。
胎鼠端脑神经干细胞(neural stem cell,NSC)[9]:取胎鼠大脑,剪去嗅球、小脑和脑干,机械剪碎呈乳糜状,加入accutase消化15 min,待组织呈絮状时1000 r/min离心7 min,弃上清,以NSC增殖培养基(DMEM/F12+2% B27+20 ng/mL EGF+20 ng/mL bFGF+1% L-谷氨酰胺+1%双抗+1% N2添加剂+1% NEAA)重悬,过滤并计数,调整细胞浓度为1 × 106/mL,接种在25T培养瓶中,细胞悬浮生长,第2天换液,继续培养至第3代备用。
1.2.2 细胞免疫荧光检测
胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是AS的特异性蛋白,是一种胞浆内丝状蛋白;巢蛋白(nestin)表达于胞浆,是NSC的特征性蛋白。将第3代AS和NSC分别制备成浓度为1 × 105和1 × 106/mL的单细胞悬液,24孔板每孔加0.5 mL细胞悬液,其中加NSC的孔需事先用PDL包被,孵箱培养24 h,4%多聚甲醛固定15 min,0.05% TritonX-100破膜15 min,山羊血清封闭1 h,滴加稀释200× 的一抗,4℃过夜,避光条件下滴加稀释200 × 的相应的荧光二抗,室温孵育1 h,DAPI封闭液封片,荧光显微镜下照相观察。随机选择8个视野(×200)至少200个细胞计算阳性率。
1.2.3 H2O2诱导大鼠星形胶质细胞衰老及条件培养基的收集
将AS浓度以1 × 105/mL接种在25T培养瓶中,培养48 h后,分为两组,对照组:培养基更换为不含H2O2的DMEM/F12培养基;衰老组:培养基更换为含200 μmol/L H2O2的DMEM/F12培养基,培养4 h,再次更换为DMEM/F12培养基连续培养3 d或7 d,收集星形胶质细胞条件培养基(astrocyte conditioned medium,ACM)和衰老星形胶质细胞条件培养基(senescent astrocyte conditioned medium,SACM)。
1.2.4 ACM和SACM处理胎鼠端脑神经干细胞:
96孔板每孔接种5 × 103个NSC(浓度为5 × 104/mL),实验按加入AS条件培养基的不同分5组:control组,培养基为NSC增殖培养基;ACM1组,ACM与NSC增殖培养基比例为1∶3;ACM2组,ACM与NSC增殖培养基比例为1∶2;SACM1组,SACM与NSC增殖培养基比例为1∶3;SACM2组,SACM与NSC增殖培养基比例为1∶2。培养3 d或7 d后,显微镜下照相,随机选择8个视野(100 ×)计算神经球数量(/mL),之后收集细胞悬液,制备成单细胞悬液进行计数(/mL)。
1.2.5 MTT法测大鼠星形胶质细胞活力
将AS浓度以0、0.625 × 104、1.25 × 104、2.5 × 104、5 × 104、1 × 105/mL接种在96孔板中,每孔100 μL,设6个平行孔,分别在第1、3、5、7天进行MTT实验,每孔加MTT溶液(10 g/L)20 μL,继续培养4 h后终止培养,弃去培养液,每孔加150 μL DMSO,振荡10 min,选择570 nm波长(参比波长630 nm),在酶联免疫监测仪上测定各孔光吸收值(OD)[10]。
1.2.6 β-gal染色
星形胶质细胞诱导衰老培养3 d或7 d后,按试剂盒提供的方法进行β-gal染色。加入β-gal固定液室温固定15 min,去除固定液加入β-gal染色工作液,37℃孵育过夜(无CO2),显微镜下照相观察。随机选择8个视野(× 200)至少200个细胞计算阳性率。
1.3 统计学分析

2 结果
2.1 大鼠皮层星形胶质细胞和胎鼠端脑神经干细胞的分离及鉴定
对培养至第3代的AS和NSC分别进行抗GFAP和抗nestin免疫荧光染色,结果显示细胞表达GFAP的阳性率为(97.15 ± 1.48)%(见图1),细胞表达nestin的阳性率为(98.03 ± 1.36)%(见图1),即分离的原代大鼠AS和NSC纯度均在95%以上。
2.2 大鼠星形胶质细胞增殖活力
通过MTT法测定AS增殖活性,结果显示不同浓度细胞接种后在第3~5天为对数生长期,增殖速度较快,之后慢慢降低,其中细胞浓度在2.5 × 104、5 × 104/mL时始终保持稳定增长,见图2。

图1 大鼠原代星形胶质细胞和神经干细胞(× 200)Figure 1 Rat primary AS and NSC (× 200)

图2 大鼠星形胶质细胞生长曲线Figure 2 Cell growth curve of rat AS
2.2 H2O2诱导大鼠星形胶质细胞衰老

注: A: H2O2诱导后培养3 d AS β-gal染色(× 200);B: H2O2诱导后培养7 d AS β-gal染色(× 200);C: H2O2诱导后培养3 d β-gal阳性细胞比例;D: H2O2诱导后培养7 d β-gal阳性细胞比例;E:H2O2诱导后培养3 d AS细胞数量差异;F: H2O2诱导后培养7 d AS细胞数量差异。与对照组相比,*P< 0.05。图3 H2O2诱导星形胶质细胞衰老Note. A, Stained with β-gal 3 days after H2O2 induction (× 200). B, Stained with β-gal 7 d after H2O2 induction (× 200). C, Percent of β-gal+ cells 3 d after H2O2 induction. D, Percent of β-gal+ cells 7 d after H2O2 induction. E, Number of AS 3 d after H2O2 induction. F, Number of AS 7 d after H2O2 induction. Compared with control group,*P< 0.05.Figure 3 Senescent AS induced by H2O2 exposure
AS经H2O2诱导后,衰老细胞胞体变大呈扁平状,β-gal染色阳性(见图3A、B),与对照组相比,培养3 d和7 d后β-gal阳性细胞数分别增加(16.95 ± 1.93)%、(68.40 ± 4.16)%(见图3C、D),AS细胞数量分别减少(24.27 ± 1.56)%、(41.10 ± 2.22)%(见图3E、F),差异均有显著性(P﹤0.05),提示200 μmol/L H2O2诱导4 h能够使AS衰老,结果见图3。
2.3 衰老大鼠星形胶质细胞条件培养基对胎鼠端脑神经干细胞短期增殖能力的影响
为观察衰老AS对NSC短期增殖能力的影响,分别收集连续培养3 d和7 d的ACM和SACM,以不同的比例加入NSC增殖培养基中,培养3 d后对NSC的增殖情况进行检测。
结果显示,加入3 d条件培养基,ACM2组、SACM1组和SACM2组均可使神经球数量减少(P< 0.05),条件培养基的含量越高,神经球数量越少,直径越大,见图4A、B。消化为单个细胞计数结果显示,ACM组神经干细胞的数量变化没有显著性差异,而SACM1组神经干细胞数量降低(18.13 ± 5.49)%;SACM1组与ACM1组相比降低(22.99 ± 5.43)%,SACM2组与ACM2组相比降低(18.98 ± 3.57)%,差异均具有显著性(P<0.05),见图4C。
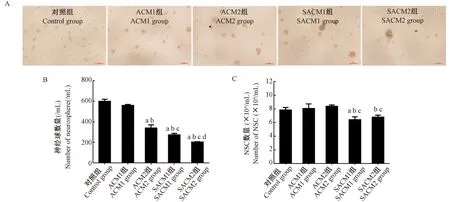
注:A:3 d条件培养基培养NSC 3 d后增殖情况(× 200)。B: 神经球数量的变化。C: NSC总数量的变化。与对照组相比,aP< 0.05;与ACM1(ACM∶NSC为1∶3)组相比,bP< 0.05;与ACM2(ACM∶NSC为1∶2)组相比,cP< 0.05;与SACM1(SACM∶NSC为1∶3)组相比,dP< 0.05。图4 3 d条件培养基对NSC短期增殖功能的影响Note. A, Proliferation of NSC cultured for 3 ds (× 200). B, Number of neurosphere. C, Number of NSC. Compared with control group,aP< 0.05. Compared with ACM1(ACM:NSC=1∶3) group,bP< 0.05. Compared with ACM2(ACM:NSC=1∶2) group,cP< 0.05. Compared with SACM1(SACM:NSC=1∶3) group,dP< 0.05.Figure 4 Effects of 3 d conditioned medium on short-term proliferation of NSC
加入7 d条件培养基,ACM或者SACM均可使神经球数量减少(P< 0.05),条件培养基的含量越高,神经球数量越少,直径越大,见图5A、B。消化为单个细胞计数结果显示,ACM2组神经干细胞数量增加(22.21 ± 7.02)%,SACM2组降低(24.25 ± 6.93)%;SACM1组和SACM2组与ACM2组相比分别降低(13.48 ± 3.10)%、(38.02 ± 5.67)%,SACM2组与SACM1组相比降低(28.36 ± 6.55)%,差异均具有显著性(P﹤0.05),见图5C。
以上结果显示,3 d SACM对NSC短期增殖有抑制作用,7 d ACM促进NSC增殖,7 d SACM抑制神经干细胞的增殖,并且加入SACM比例越大,抑制作用越显著。此外,加入条件培养基可使神经球数量减少,SACM比ACM抑制作用更显著,但神经球直径SACM组 > ACM 组> control组。
2.4 衰老大鼠星形胶质细胞条件培养基对胎鼠端脑神经干细胞长期增殖能力的影响
为观察星形胶质细胞对神经干细胞长期增殖能力的影响,分别收集连续培养3 d和7 d的ACM和SACM,不同的比例加入NSC增殖培养基中,培养7 d后对NSC的增殖情况进行检测。
结果显示,加入3 d条件培养基,ACM1组、ACM2组、SACM1组和SACM2组均可使神经球数量减少(P< 0.05),直径增大,但各组间无差异,见图6A、B。消化为单个细胞计数结果显示,ACM1组、ACM2组、SACM1组和SACM2组NSC数量分别降低(50.76 ± 2.28)%、(46.00 ± 7.34)%、(57.40 ± 3.99)%、(58.04 ± 3.11)%,差异均具有显著性(P﹤ 0.05),见图6C。
加入7 d条件培养基,ACM1组、ACM2组、SACM1组和SACM2组均可使神经球数量减少(P< 0.05),直径增大,但各组间无差异,见图7A、B。消化为单个细胞计数结果显示,ACM1组、ACM2组、SACM1组和SACM2组NSC数量分别降低(61.86 ± 5.34)%、(65.23 ± 2.60)%、(73.08 ± 1.90)%、(79.77 ± 3.47)%,SACM1组和SACM2组比ACM1组分别降低(29.41 ± 4.99)%、(46.97 ± 9.10)%,差异均具有显著性(P﹤ 0.05),见图7C。

注: A:7 d条件培养基培养NSC 3 d后增殖情况(× 200)。B. 神经球数量的变化。C. NSC总数量的变化。与对照组相比,aP < 0.05;与ACM1(ACM:NSC为1∶3)组相比,bP < 0.05;与ACM2(ACM:NSC为1∶2)组相比,cP < 0.05;与SACM1(SACM:NSC为1∶3)组相比,dP < 0.05。图5 7 d条件培养基对神NSC短期增殖功能的影响Note. A, Proliferation of NSC cultured for 3 days (×200). B, Number of neurosphere. C, Number of NSC. Compared with control group,aP< 0.05. Compared with ACM1(ACM:NSC=1∶3) group,bP< 0.05. Compared with ACM2(ACM:NSC=1∶2) group,cP< 0.05. Compared with SACM1(SACM:NSC=1∶3) group,dP< 0.05.Figure 5 Effects of 7 d conditioned medium on short-term proliferation of NSC

注: A:3 d条件培养基培养NSC 7 d后增殖情况(× 200)。B:神经球数量的变化。C:NSC总数量的变化。与对照组相比,aP < 0.05。 图6 3 d条件培养基对NSC长期增殖功能的影响Note. A, Proliferation of NSC cultured for 7 days (× 200). B, Number of neurosphere. C, Number of NSC. Compared with control group,aP< 0.05.Figure 6 Effects of 3 d conditioned medium on long-term proliferation of NSC

注:A. 7 d条件培养基培养NSC 7 d后增殖情况(200×);B. 神经球数量的变化;C. NSC总数量的变化。与对照组相比,aP < 0.05;与ACM1(ACM:NSC为1∶3)组相比,bP < 0.05。图7 7 d条件培养基对NSC长期增殖功能的影响Note. A, Proliferation of NSC cultured for 7 days (× 200). B, Number of neurosphere. C, Number of NSC. Compared with control group,aP< 0.05. Compared with ACM1(ACM:NSC=1∶3) group,bP< 0.05.Figure 7 Effects of 7 d conditioned medium on long-term proliferation of NSC
以上结果显示,3 d ACM和SACM对NSC长期增殖有抑制作用,两者抑制作用无差异;7 d ACM和SACM对NSC长期增殖有抑制作用,但SACM抑制作用大于ACM。此外,加入条件培养基可使神经球数量显著减少,ACM和SACM作用无差异,神经球直径无差异。
3 讨论
为了探讨衰老的AS是否会影响NSC功能,本研究首先在体外分离原代AS和NSC,培养至第3代后纯度均在95%以上,符合实验要求,之后通过200 μmol/L H2O2诱导4 h建立AS衰老模型,与Bitto等[11]研究结果相似,经H2O2诱导后的AS可模拟体内相似的衰老样改变,包括形态学变化、细胞活力下降、生长周期停滞、细胞凋亡增加、β-gal染色阳性、分泌SASP等等,培养时间越长,衰老的AS越多,培养3 d后约30% AS衰老,培养7 d后约80% AS衰老,最后收集AS条件培养基检测其对NSC增殖能力的影响。
NSC作为一种成体干细胞,是用以治疗神经退行性疾病和脑卒中最常用的干细胞类型之一,具有自我更新和多向分化能力,理论上可分化为神经元重建损伤的神经系统。哺乳动物神经系统发育出现在胚胎发育的中后期,因此选择15 d胎鼠分离NSC,结果显示此种方法可成功分离NSC,且分离效率较高。增殖能力是判断NSC功能的重要指标,第3代NSC正常情况下具有良好的增殖分裂能力,因此选择第3代NSC培养3 d或7 d后检测其短期和长期增殖能力。本研究发现,正常的AS条件培养基可促进NSC的短期快速增殖,表现为少量神经球的直径迅速增大,Wang等[12]认为是AS通过分泌IL-6、TNF-α、BDNF等细胞因子和神经营养因子来实现的。以往研究也证明在成体海马存在内源性NSC,当大脑受损时可刺激NSC增殖、迁移和分化以修复大脑功能[13]。但培养7 d时NSC数量显著降低,提示AS虽然可以促进少量NSC快速增殖,但由于单个NSC增殖能力有限,因此表现为抑制作用,这可能也是神经系统损伤时仅依靠内源性NSC难以有效恢复功能的原因之一。
同时本研究还发现SACM抑制NSC的增殖,培养的时间越长、加入的比例越大,抑制作用越显著,提示衰老AS可能通过分泌SASP、降低神经营养因子含量等抑制NSC活性,并且相比ACM组,SACM组神经球数量更少,提示由衰老AS所引起的微环境的变化更不利于大部分NSC的存活,甚至促进干细胞的凋亡[4],目前的许多研究发现,随着年龄增长或者神经系统疾病的发生,脑内AS会出现衰老性改变,衰老的AS结构支持功能丧失,增加衰老相关分泌表型、减少神经营养因子的分泌,改变脑内微环境,这可能也是NSC治疗老年性神经系统疾病时疗效不显著的原因之一,目前AS也已成为治疗神经系统疾病新的靶点[14-16]。
在NSC的应用中,NSC在脑组织中的存活率较低仍然是此类研究尚未解决的难题,研究者尝试通过采用与神经营养因子或者其他类型干细胞共移植的方式期望能够提高干细胞的存活率[17],大脑中复杂的微环境不仅使移植的干细胞难以存活,同时也使NSC更多地向AS方向分化,而受损脑内衰老的AS在其中所发挥的作用仍难有定论,衰老AS对NSC分化方向的影响以及衰老AS对NSC产生功能影响的分子机制值得进一步探讨,以便为NSC在神经退行性疾病和脑卒中等老年病中更好的应用提供基础数据。
