文冠果MAPK16基因全长cDNA序列与生物信息学分析
2020-04-30文嗣鑫王莉邓金兰纪冬颖王兵徐世琦
文嗣鑫 王莉 邓金兰 纪冬颖 王兵 徐世琦
摘 要:为探明文冠果MAPK16基因的生物学特征及功能,根据文冠果de novo转录组数据搜索MAPK16基因的cDNA序列(XsMAPK16),并对XsMAPK16基因全长cDNA序列进行生物信息学分析。结果显示,XsMAPK16基因cDNA序列包含1个长度为1 677bp的完整ORF,可编码558个氨基酸。XsMAPK16蛋白大部分区域为亲水区,由235个ɑ螺旋、232个无规则卷曲,59个延伸链、32个β转角构成。依据2gcc.1.A同源建模法,获得1个三级结构模型,该模型从第12个氨基酸开始到第362个氨基酸结束。XsMAPK16蛋白与12种其他植物MAPK蛋白的同源性分析显示,文冠果MAPK16与甜橙MAPK的同源性最高(94.93%)。该结果将为解析文冠果抗旱的调控机制提供新的理论基础,并为文冠果的抗旱育种提供新思路。
关键词:文冠果;MAPK16蛋白;亲水性;ɑ螺旋;同源性
中图分类号:F307.11; S341.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.02.004
Full-length cDNA Sequence and Bioinformatic Analysis of MAPK16 Gene from Yellow Horn
WEN Sixin, WANG Li, DENG Jinlan, JI Dongying, WANG Bing, XU Shiqi
(College of Environment and Resources, Dalian Minzu University, Dalian, Liaoning 116600, China)
Abstract: In order to explore the biological characteristic and function of MAPK16 gene from Xanthoceras sorbifolia (yellow horn), the cDNA sequence of MAPK16 gene(XsMAPK16) was searched based on the de novo transcriptome data of yellow horn, and then the full-length cDNA sequence of XsMAPK16 gene was analyzed by bioinformatics. The results showed that the cDNA sequence of XsMAPK16 gene contained a complete ORF of 1677 bp, which encoded 558 amino acids. The majority of XsMAPK16 protein is hydrophilic, consisting of 235 helium spirals, 232 random coils, 59 extended strands, and 32 beta turns. According to the 2gcc.1.A homology modeling method, a tertiary structure model was obtained, ranging from the 12th amino acid to the 362th amino acid. The homology analysis of XsMAPK16 protein and MAPK proteins from 12 higher plants showed that MAPK16 had the highest homology with sweet orange MAPK (94.93%). These results will provide a new theoretical basis for the analysis of the regulation mechanism of drought resistance of yellow horn, and provide new ideas for drought-resistant breeding of yellow horn.
Key words: Xanthoceras sorbifolia; MAPK16 protein; hydrophilic; ɑ helix; homology
植物為应对外界环境变化会作出适应性反应从而进化出了一系列复杂的信号传导机制,外界刺激被传递到细胞内部并转化为对应的胞内信号以调控下游反应[1]。蛋白激酶特定位点上氨基酸残基的磷酸化以及去磷酸化是细胞内信号传递的主要途径之一[2]。促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是植物体内MAPK信号通路的重要成员之一,与植物体的生长、发育和逆境胁迫响应等密切相关[3]。MAPK与促分裂原激活蛋白激酶激酶(mitogen-activated protein kinase kinase,MAPKK)以及促分裂原激活蛋白激酶激酶激酶(mitogen-activated protein kinase kinase kinase,MAPKKK)通过逐级磷酸化构成了MAPKKK→MAPKK→MAPK级联反应信号传导途径[4]。保守的蛋白激酶MAPK级联信号传导系统是真核生物应答和传导外界信号的关键通路[5-10]。植物MAPK级联途径可以响应多种生物胁迫(真菌、细菌侵染)和非生物胁迫(高盐、低温、干旱、活性氧爆发、激素诱导、组织机械损伤)。近年来的研究发现MAPK参与植物生长发育及抗逆过程的研究主要集中在拟南芥[11]、烟草[12]等植物中,已发现了大量MAPK家族成员。
文冠果(Xanthoceras sorbifolia)是我国北方特有的木本食用油料树种[13],易繁殖,具有耐旱[14]、耐寒[12]、耐瘠薄和盐碱[15]等抗逆特征。然而木本油料文冠果中MAPK研究仍为空白。本研究拟在文冠果转录组的基因注释结果搜索得到MAPK16基因的全长cDNA序列,并采用生物信息学相关方法来分析MAPK16蛋白的结构与理化性质,为解析文冠果干旱胁迫抗性的调控机制提供理论依据,对文冠果抗旱种质的筛选和育种具有重要意义。
1 材料和方法
1.1 搜索文冠果转录组获得XsMAPK16基因的cDNA序列
根据大连民族大学资源植物研究所高通量测序获得的文冠果根、茎、叶的de novo转录组的基因注释结果搜索获得XsMAPK16基因的cDNA序列,用于后续生物信息学分析。
1.2 文冠果XsMAPK16基因cDNA序列的生物信息学分析
XsMAPK16基因cDNA序列的ORF区:利用NCBI 网站的ORF Finder在线软件(https://www.ncbi.nlm.nih.gov/gorf/gorf.html)依据标准遗传代码进行预测;XsMAPK16蛋白序列的一级结构:使用ProtParam在线软件(http://web.expasy.org/protparam/)进行预测;XsMAPK16蛋白的疏水性/亲水性:通过ProtScale在线软件(http://web.expasy.org/protscale/)进行分析;XsMAPK16蛋白序列的二级结构:利用SOPMA在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/securedsopma.pl)进行预测;XsMAPK16蛋白的三级结构:采用SWISS-MODEL软件(http:// www.swissmodel.expasy.org/)进行预测。
1.3 文冠果MAPK16与其他植物MAPK氨基酸序列的同源性比较
利用DNAman软件对文冠果MAPK16氨基酸序列和克莱门柚(Citrus clementia)、甜橙(Citrus sinensis)、可可(Theobroma cacao)、胡杨(Populus euphratica)、木薯(Manihot esculenta)、榴莲(Durio zibethinus)、麻风树(Jatropha curcas)、枣(Ziziphus jujuba)、白桦(Betula platyphylla)、欧洲甜樱桃(Prunus avium)等10种其他植物的MAPK氨基酸序列进行同源性分析,上述10种植物的MAPK氨基酸序列通过NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载。
2 结果与分析
2.1 文冠果XsMAPK16基因cDNA序列的ORF
文冠果XsMAPK16基因cDNA序列的ORF分析结果显示,XsMAPK16基因包含1个长度为1 677 bp的ORF,可编码氨基酸个数为558个(图1)。
2.2 XsMAPK16蛋白一级结构
利用ProtParam在线软件对XsMAPK16基因编码的蛋白质结构进行预测,XsMAPK16蛋白分子式为C2836H4455N789O819S22,相对分子质量为63 413.69,等电点为8.86,脂肪系数为78.69,不稳定系数为35.67,正电荷(精氨酸+赖氨酸)残基80个,负电荷(天冬氨酸+谷氨酸)残基71个,平均疏水性为
-0.475,其中正值表示疏水性,负值表示亲水性,且该值越高则表示该性质越强。说明XsMAPK16为稳定的亲水性蛋白,这与其疏水性/亲水性分析结果基本一致。
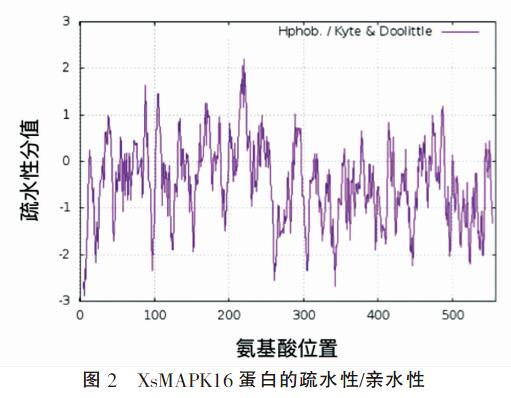
2.3 XsMAPK16蛋白疏水性/亲水性分析
由图2可见XsMAPK16蛋白的疏水性最大值为2.298,最小值为-2.898,说明XsMAPK16蛋白中大部分氨基酸为亲水性氨基酸,与其理化性质分析结果相一致。
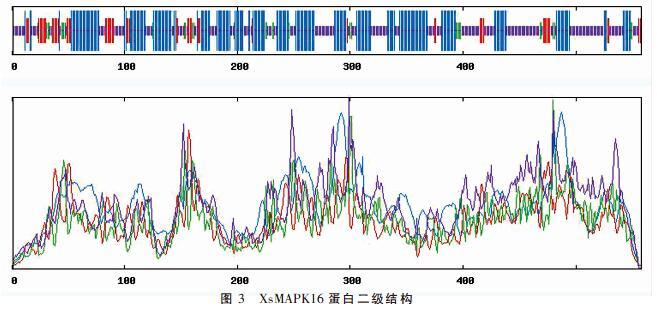
2.4 XsMAPK16蛋白序列的二级结构
基于蛋白质数据库,利用SOPMA软件对XsMAPK16蛋白序列进行二级结构预测,结果(图 3)显示,XsMAPK16蛋白由235个ɑ螺旋、232个无规则卷曲、59个延伸链、32个β转角构成,分别占42.11%、41.58%、10.57%、5.73%,其中ɑ螺旋和无规则卷曲所占比例分别位列第1、2位,可以推测文冠果XsMAPK16蛋白二级结构的结构元件是以ɑ级螺旋和无规则卷曲的形式存在,而β旋转角和延伸链散布在整个蛋白质中。
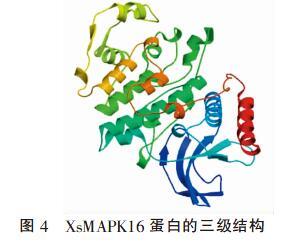
2.5 XsMAPK16蛋白序列的三级结构
利用同源建模法,将XsMAPK16蛋白质序列提交至SWISS-MODEL,根据 2gcc.1.A同源建模法,得到1个三级结构模型(图4),该模型从第12个氨基酸开始到第362个氨基酸结束,主要由ɑ氨螺旋、无规则卷曲、延伸链和β旋转角组成,与二级结构预测结果基本一致。
2.6 XsMAPK16蛋白序列与其他植物MAPK蛋白序列的同源性比较
将XsMAPK16氨基酸序列提交至NCBI數据库进行在线比对,选择与其同源性较高的10种植物的MAPK氨基酸序列:克莱门柚MAPK15(Citrus clementia,XP_006419783.1)、甜橙MAPK15(Citrus sinensis,XP_006489245.1)、可可MAPK15(Theobroma cacao,XP_007034572.1)、胡杨MAPK15(Populus euphratica,XP_011009014.1)、木薯MAPK15(Manihot
esculenta,XP_021594735.1)、榴莲MAPK16(Durio zibethinus,XP_022761951.1)、麻风树MAPK15(Jatropha curcas,XP_012069504.1)、枣MAPK15(Ziziphus jujuba,XP_015888257.1)、白桦MAPK16(Betula platyphylla,AHX99574.1)、欧洲甜樱桃MAPK16(Prunus avium,XP_021806466.1)。利用DNAman软件将这些序列进行多序列比对,发现不同植物的MAPK氨基酸序列同源性较高,其中文冠果XsMAPK16氨基酸序列与甜橙MAPK15氨基酸序列的同源性最高,达到94.93 %。多重序列比对结果如图5所示,深色部分表示高度的保守氨基酸序列,第41个至第450个氨基酸序列存在较长的相对保守重叠区。
3 结论与讨论
MAPK蛋白是植物体内MAPK信号通路的重要成员,与植物体的生长、发育和逆境胁迫响应密切相关。本研究通过将文冠果MAPK16氨基酸序列与NCBI数据库中10种其他植物的MAPK氨基酸序列进行同源性分析,发现文冠果MAPK16与克莱门柚、甜橙、可可、胡杨、木薯、榴莲、麻风树、枣、白桦、欧洲甜樱桃等10种植物均有较高的同源性,其中与甜橙同源性最高(94.93%)。这说明文冠果与其他高等植物在MAPK氨基酸序列上第41个氨基酸至第450个氨基酸存在较长的保守区域,从而在进化上相对较为保守。本研究获得文冠果MAPK家族成员——MAPK16全长cDNA序列以及功能预测结果,将为文冠果抗旱种质的分子育种提供重要参考,也为下一步将该基因的完整ORF区连接入表达载体并转化到模式植物拟南芥中,进行功能验证奠定基础。
參考文献:
[1]潘月云,朱寿松,张银东,等.木薯促分裂原激活蛋白激酶MeMAPK2基因的克隆和功能分析[J].分子植物育种,2019,17(4):1112-1120.
[2]TSUYOSHI M, KAZUYA I, KAZUO S. Environmental stress response in plants: the role of mitogen-activated protein kinases[J]. Trends in biotechnology, 1997,15(1):15-19.
[3]BOLLER T. Chemoperception of microbial signals in plant cells[J]. Annual review of plant physiology and plant molecular biology, 1995,46:189-214.
[4]朱斌,梁颖.植物MAPK C族基因的研究进展[J].生物技术通报,2012(11):27-31.
[5]LI Y Z, ZHANG L, WANG X L, et al. Cotton Gh MPK 6a negatively regulates osmotic tolerance and bacterial infection in transgenic Nicotiana benthamiana, and plays a pivotal role in development[J].FEBS journal, 2013,280(20):5128-5144.
[6]NAKAGAMI H, ANDREA PITZSCHKE A, HIRT H. Emerging MAP kinase pathways in plant stress signalling[J]. Trends in plant science,2005,10(7):339-346.
[7]PITZSCHKE A, SCHIKORA A, HIRT H. MAPK cascade signalling networks in plant defence[J]. Current opinion in plant biology, 2009, 12(4):421-426.
[8]ROMEIS T. Protein kinases in the plant defence response[J]. Current opinion in plant biology, 2001,4(5):407-414.
[9]GUILLAUME T, TSUNEAKI A, CHIU W L, et al. Plant mitogen-activated protein kinase signaling cascades[J]. Current opinion in plant biology,2001,4(5):392-400.
[10]ZHANG S Q, KLESSIG D F. MAPK cascades in plant defense signaling[J]. Trends in plant science, 2001,6(11):520-527.
[11]TSUNEAKI A, GUILLAUME T, PLOTNIKOVA J, et al. MAP kinase signalling cascade in Arabidopsis innate immunity[J]. Nature, 2002, 415:977-983.
[12]赵娜,张媛,李秋琦,等.文冠果FAD2的序列与功能分析[J].北京林业大学学报,2015,37(2):87-93.
[13]HADIARTO T, NANMORI T, MATSUOKA D, et a1. Activation of Arabdopsis MAPK kinase kinase (AtMEKKl) and induction of AtMEKKl~AtMEKl pathway by wounding[J]. Planta, 2006, 223(4):708-713.
[14]ZHOU Y, ZHANG D, PAN J, et a1. Overexpression of a multiple stress-responsive gene, ZmMPK4, enhances tolerance to low temperature in transgenic tobacco[J]. Plant physiology and biochemistry, 2012, 58:174-181.
[15]ULNA R, ICHIMURA K, MIZOGUCHI T, et a1. Distinct regulation of salinity and genotoxic stress responses by Arabidopsis MAPkinase phosphatase 1[J]. EMBO journal, 2002, 21(23):6483-6493.
