AISPPs对木瓜蛋白酶的抗冻保护作用研究
2020-04-30李亚楠
田 野,李亚楠,吴 征,陈 强,曲 敏
(哈尔滨商业大学 食品工程学院 黑龙江省普通高校食品科学与工程重点实验室,哈尔滨 150076)
冰结构蛋白(ice structuring proteins, ISPs),又称不冻蛋白、抗冻蛋白,是一类由某些鱼类、昆虫、植物、真菌和细菌为抵御外界环境应激反应所产生的多肽,能够有效地抑制冰晶生长的蛋白[1].它具有一定的热滞活性,即能够以非依数性方式降低溶液的冰点,但对熔点影响甚微,使溶液冰点和熔点之间出现差值[2].其中,植物源ISPs与动物源ISPs相比具有来源广泛、价格低廉等特点,自1992年以来成为研究的热点[3-4].
木瓜蛋白酶又称木瓜酶,是一类含巯基肽链的内切酶,广泛存在于番木瓜(Cariea papaya)的根、茎、叶和果实内,其中在未成熟的乳汁中含量最为丰富[5].它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品[6]、医药[7]、饲料、日化、皮革及纺织等行业得到广泛应用[8].木瓜蛋白酶最适温度为55~60 ℃,在低温条件下,酶和底物的结合速率减慢,且木瓜蛋白酶中的肽链收缩,不易与底物嵌合,酶活降低.
本课题组利用冰与冰结构蛋白特异性结合法提取AISPs[9],并将其应用于冷冻面团[10]、速冻饺子皮[9]等方面,发现AISPs对其具有明显的保护作用.但木瓜冰结构蛋白酶肽(Allium ice structural proteins peptide,AISPPs)的抗冻保护作用未见报道,故本试验将AISPPs加入木瓜蛋白酶中,探究其对木瓜蛋白酶的抗冻保护作用,以酶活性作为主要的功能性评价指标,并对其冻干保护机理进行初步探讨,以期拓宽AISPPs的应用.
1 材料与仪器
1.1 实验材料
“肇东”紫花苜蓿,由黑龙江省农业科学院草业研究所苜蓿实验基地提供.Na2HPO4,NaH2PO4,乙醇,硫酸铵,丙酮,EDTA-2Na,氢氧化钠,考马斯亮蓝G-250,邻苯三酚,SOD,所有试剂均为分析纯.标准蛋白酶液,生化试剂.
1.2 实验仪器
电子天平,沈阳龙腾电子秤量仪器公司;TGL-16型高速台式离心机,上海医疗器械六厂;721型紫外可见分光光度计,上海精密科学仪器有限公司;DHP-9162型光照培养箱,上海一恒科技有限公司;GW-06A电热恒温干燥箱,哈尔滨仪器五厂;ESJ 180-4型分析天平,沈阳龙腾电子秤量仪器公司;粉碎机,天津市泰斯特仪器有限公司;BCD-247-C型电热恒温水浴锅,聚创环保设备有限公司.
1.3 冰结构蛋白的制备
参照曲敏[9]的方法,取苜蓿草粉以1∶20的料液比在磷酸缓冲溶液,磁力搅拌器搅拌、浸泡2 h,8层纱布及滤纸过滤,弃去草渣,上清液于5 000 r/min离心15 min,得可溶性蛋白的粗提液,采用考马斯亮蓝法测定粗提液中蛋白含量,计算质量,记为m1.
将蒸馏水注入圆球形冰槽,在-18 ℃冰箱冷冻,制成直径为1 cm的冰球,备用.在上清液中加入冰球,于-18 ℃静置,以冰球吸附上清液中的AISPs.2 min后,分离出冰球并待自然融化,测量溶液中蛋白含量,计算质量为m2.最后将融化后的液体装入旋转蒸发仪进行旋转蒸发浓缩,得到的浓缩液即为AISPs溶液.
1.4 标准曲线的测定
参照叶婧[11]的方法,采用考马斯亮蓝染料比色法,分别取0、10、20、30、40、50、60 mg/L牛血清蛋白标准品各1 mL,加入考马斯亮蓝G250溶液5 mL,充分混匀,静置5 min,于595 nm波长处测定吸光值.以牛血清蛋白质量浓度为横坐标,以A595nm为纵坐标,绘制标准曲线.
1.5 酪氨酸标准曲线的测定
本试验采用福林酚试剂法[12]测定酪氨酸标准曲线.分别取1 mL质量浓度为10、20、30、40、50、60 μg/mL的酪氨酸溶液,加入0.5 mL 福林试剂、5 mL 0.4 mol/L Na2CO3均匀混合,于40 ℃水浴锅中放置1 min,于680 nm下测定其吸光度,以空白组为对照,以酪氨酸质量浓度为横坐标,吸光度为纵坐标绘制标准曲线.
1.6 AISPPs的制备
用碱性蛋白酶对AISPs进行酶解制备AISPPs,以蛋白水解度(DH)作为考察指标,考察酶解时间、底物质量浓度、酶质量分数、溶液pH、酶解温度其酶解程度的影响.
1.6.1 酶解时间
酶解温度55 ℃,反应体系的pH为8.0,碱性蛋白酶质量分数为5%条件下分别酶解1.0、1.5、2.0、2.5、3.0、3.5 h,比较不同酶解时间对AISPs的水解程度.
1.6.2酶质量分数的影响
酶解温度55 ℃,反应体系的pH为8.0条件下,分别加入质量分数2%、3%、4%、5%、6%、7%的碱性蛋白酶,酶解2.5 h,比较不同酶质量分数对AISPs的水解程度.
1.6.3 酶解pH的影响
酶解温度55℃,碱性蛋白酶质量分数为5%条件下,分别调节反应体系的pH为7.0、7.5、8.0、8.5、9.0、9.5,酶解2.5 h,比较不同酶解pH对AISPs的水解程度.
1.6.4酶解温度的影响
反应体系的pH为8.0,碱性蛋白酶质量分数为5%条件下分别于45、50、55、60、65 ℃条件下进行反应,酶解2.5 h,比较不同酶解温度对AISPs的水解程度.
1.6.5 蛋白水解度的测定
本试验采用甲醛滴定法测量蛋白质水解度,取2 mL待测蛋白溶液,分别加入4 mL蒸馏水及酚酞溶液3滴,摇匀后用0.095 35 mol/L氢氧化钠溶液滴至成微红色,然后加入4 mL中性甲醛溶液,摇匀后静置片刻.再用0.095 35 mol/L NaOH溶液滴至成为红色,记下加入甲醛后所消耗的标准氢氧化钠体积.以蒸馏水为对照,水解度按下式计算:
DH%=B(Mb)(1/α)(1/MP)(1/htot)×100%
(2)
其中:B为NaOH的体积,mL;Mb为NaOH的浓度,mol/L;1 /α为在pH 7.0,50 ℃的试验条件下,1 /α为2.26;MP为蛋白质的品质,g;htot为每克原料蛋白质中肽键的毫摩尔数,对AISPs蛋白该值取7.40 mmol/g.
1.7 响应面实验
根据单因素实验结果,采用响应面法对碱性蛋白酶对AISPs的水解条件进行优化,选取酶解时间(A)、酶解pH(B)和酶解温度(C)为考察因素,以DH为考察指标,进行响应面试验.见表1.

表1 响应面分析试验设计因素与水平
采用BBD试验设计方法设立17组试验,各因素和响应面值(DH)如表2所示,对数据进行二次回归拟合,分析各因素的效应,最后得到碱性蛋白酶对AISPs的水解条件最佳工艺.
1.8 AISPPs对木瓜蛋白酶的保护作用
1.8.1 不同冻藏时间的比较
取两组木瓜蛋白酶各10 mL,一组加入0.3%的AISPPs,一组为空白对照,于-30 ℃冻藏5、10、15、20、25 d后木瓜蛋白酶活力,比较不同冻藏时间下加入AISPPs对木瓜蛋白酶的保护作用.
1.8.2 不同质量分数AISPPs对木瓜蛋白酶酶活力的影响
取5组木瓜蛋白酶各10 mL,分别加入质量分数为0.2%、0.3%、0.4%、0.5%、0.6%的AISPPs,于-30 ℃冻藏5 d,测定木瓜蛋白酶活力,比较不同AISPPs对木瓜蛋白酶活力的影响.
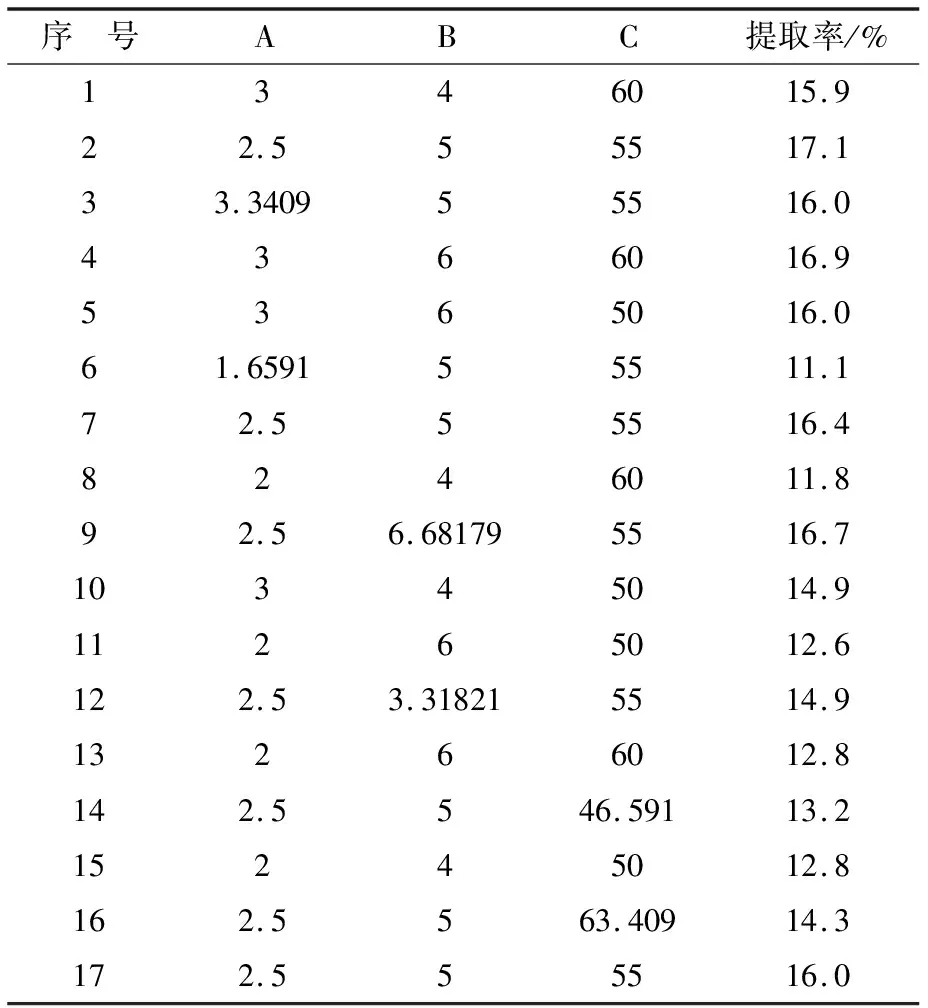
表2 碱性蛋白酶对AISPs的水解条件响应曲面试验设计和结果
2 实验结果与分析
2.1 牛血清蛋白标准曲线及AISPs提取率
由图1可知,蛋白溶液的吸光度与质量浓度存在正比例关系,线性关系良好,可用于后续实验.根据标准曲线,通过计算得出AISPs提取率约为37.77%.
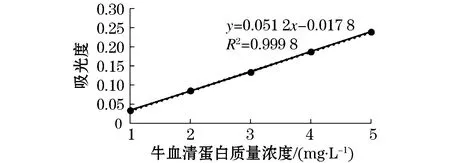
图1 牛血清蛋白标准曲线
2.2 酪氨酸标准曲线
由图2可知,酪氨酸标准曲线为y=0.195 1x-0.151 3,线性关系良好,可用于其他待测蛋白质量浓度的测定.根据标准曲线,根据计算碱性蛋白酶的酶活性为9×104U/mg.

图2 酪氨酸标准曲线
2.3 酶解单因素实验
2.3.1 酶解时间
由图3可知,水解度随着酶解时间的增加,呈现先增大后减小的趋势;当酶解时间为2.5 h时,水解度达到最大值为15.3%,蛋白酶基本和蛋白质完全作用,继续水解底物质量浓度会继续减小,随着水解的进行酶的特异性催化位点减少,即水解过程中酶逐渐失活,故最佳酶解时间为2.5 h.
2.3.2 酶解质量分数
由图4可知,水解度随着酶解质量分数的逐渐升高,呈现先增大后减小的趋势.当酶质量分数为1%~ 4%时,酶质量分数的逐渐增加使反应物逐渐达到反应完全,AISPs水解度逐渐增加.当酶解质量分数达到4%时,水解度达到最大值为14.6%.此后再增加酶质量分数,增加了溶液体积,AISPPs被稀释,水解度降低.
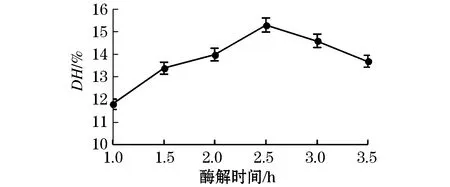
图3 酶解时间对水解度的影响
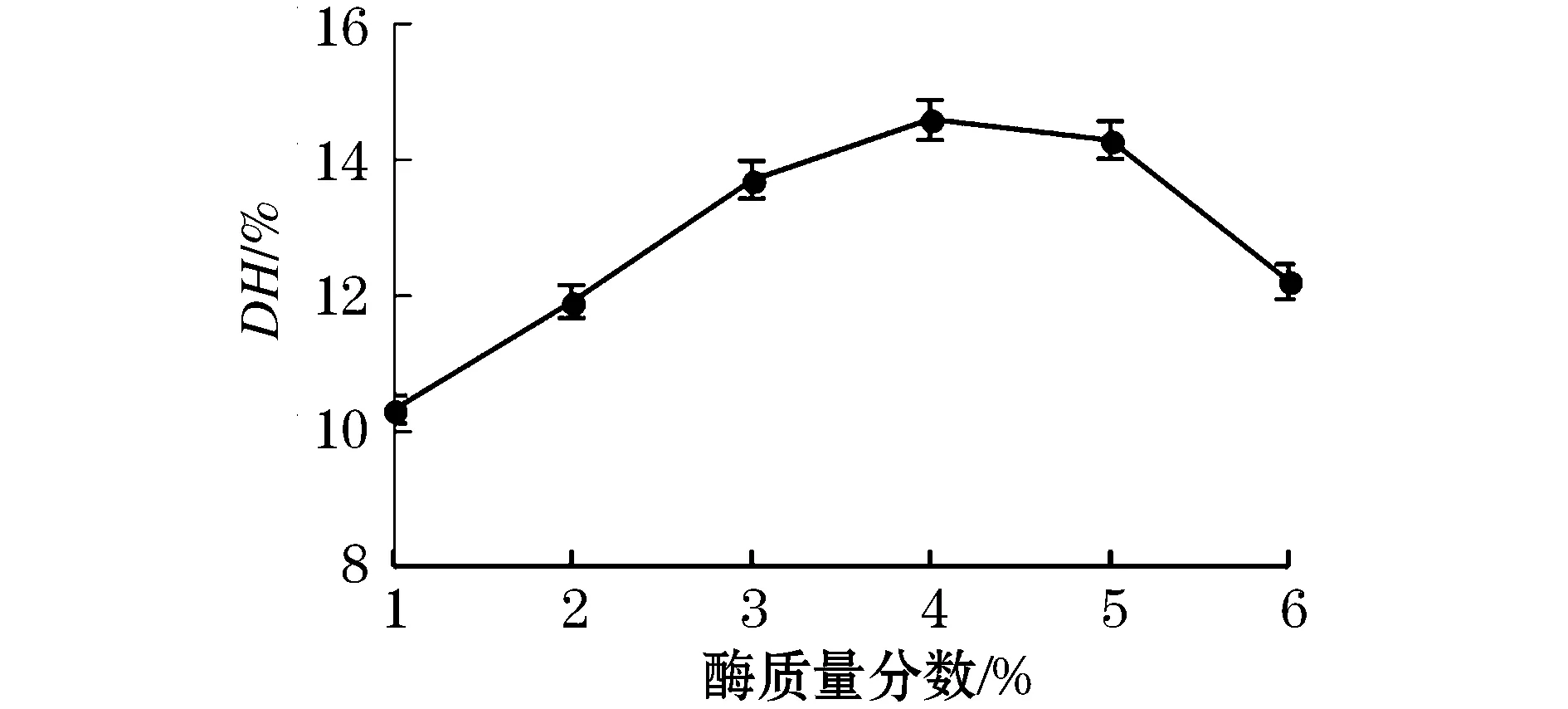
图4 酶质量分数对水解度的影响
2.3.3 酶解pH
图5可知,水解度随着酶解pH的逐渐升高,呈现先增大后减小的趋势.这是由于随着pH的不断增大,AISPs所带的电荷不断增多,蛋白与水之间的相互作用不断增大,蛋白与蛋白之间的相互作用不断减小.当酶解pH达到4时,水解度达到最大值为16.2%.
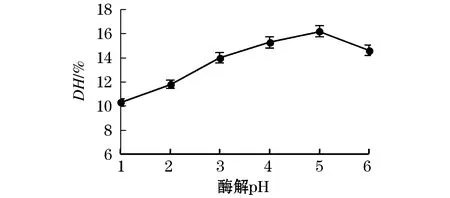
图5 酶解pH对水解度的影响
2.3.4 酶解温度
由图6可知,水解度随着酶解温度的逐渐升高,呈现先增大,后减小的趋势.当在45~55 ℃时,温度升高可以提高酶的活性,且有利于底物折叠结构的展开,水解度随着温度的增加而增加.当酶解温度达到55 ℃时,水解度达到最大值为16.3%,故最佳酶解温度为55℃.当在55~70 ℃时,此时温度超过了酶的最适宜温度时,酶逐渐失活,导致蛋白质水解度下降.

图6 酶解温度对水解度的影响
2.4 碱性蛋白酶对AISPs的水解条件优化
2.4.1 回归方程的建立与方差分析
利用软件对试验结果进行回归分析,拟合得到水解度的二次元回归方程为:
DH%=16.5+1.61A+0.43B+0.22C+0.16AB+0.34AC+0.14BC-1.05A2-0.25B2-0.98C2
(3)
由表3可知,失拟项不显著,表明模型的拟合程度良好,未知因素对试验结果的干扰较少,模型的方差分析说明该模型已经达到显著水平(P<0.05).由P值可知各因素对碱性蛋白酶对AISPs的水解条件影响为:酶解时间>酶解pH>酶解温度.校正系数R2Adj为0.95、变异系数(C.V.)为2.9%<10%、决定系数R2为0.43,说明多项式模型的利用性和精密度是可行的,通过此模型方程能预测出碱性蛋白酶对AISPs在任何变量值下的水解条件.

表3 碱性蛋白酶对AISPs的水解条回归模型
2.4.2 响应面分析及验证
图7~9是因素(酶解时间、酶解pH、酶解温度)交互影响的响应面图和等高线图.由图7可知,随着酶解时间的增大,碱性蛋白酶对AISPs的水解度呈现先有所增加后缓慢降低的趋势.酶解pH为 4~6时,提取率呈现先增大后减小的趋势;等值线区域水平,表示酶解时间与酶解pH间具有显著的交互作用.由图8可知,随着酶解pH的不断增加,水解度呈现先增大后趋于平稳的趋势;随着酶解温度的逐渐增大,水解度呈现先增大后减小的趋势.由图9可知,随着酶解温度的不断增高,水解率呈现先增大后减小的趋势.
通过二次多项式回归分析求最大值,得到碱性蛋白酶对AISPs的水解条件最佳工艺为:酶解时间为2.817 h,酶解pH为5.221,酶解温度为50.593 ℃,在此条件下DH的理论预测值为16.04%.结合最优工艺参数和实际生产可操作性,对各因素进行修订,最终确定最有工艺为:酶解时间为2.8 h,酶解pH为5.2,酶解温度为50.6.在最佳工艺条件下,经过3次重复试验验证,DH为15.89%,与预测值相近,说明优化工艺重复性良好,最优工艺的结果可靠.
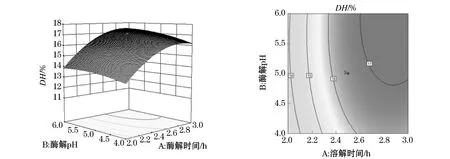
图7 酶解时间和酶解pH对水解条件的交互影响

图8 酶解时间和酶解温度对水解条件的交互影响

图9 酶解pH和酶解温度对水解条件的交互影响
2.5 AISPPs对木瓜蛋白酶的抗冻保护作用
由图10可知,随着冷冻天数的逐渐延长,木瓜蛋白酶的酶活力逐渐降低,但加入AISPPs可明显缓解低温对其的损害.当冷冻时间为25 d时,对照组木瓜蛋白酶酶活性为2.8×105U/mg;而实验组木瓜蛋白酶酶活性为4.1×105U/mg,相比对照组酶活性提高了46.43%.因此,添加AISPPs对木瓜蛋白酶活力具有一定的保护作用.随着冷冻时间的延长,一方面,木瓜蛋白酶溶液中水分开始结晶,蛋白酶分子侧链在冰晶的挤压下发生聚集,其周围的游离水分子因重排布而失去复水力,逐渐导致木瓜蛋白酶变性;另一方面,未冻结时,部分木瓜蛋白酶分子以高度水化的折叠状存在,非极性基团相互作用形成非极性键,因为位于酶分子内部而避开与水分子的接触,所以状态比较稳定;但温度降低时,冰晶的形成使木瓜蛋白酶水化程度降低,致使蛋白酶分子展开变性[13].而AISPPs能吸附于冰晶表面,介于木瓜蛋白酶分子和水分子之间,阻止水与冰的接触,从而抑制冰晶生长,改变冰晶形态,抑制冰晶重结晶[14],从而减缓了冰晶对木瓜蛋白酶的伤害.
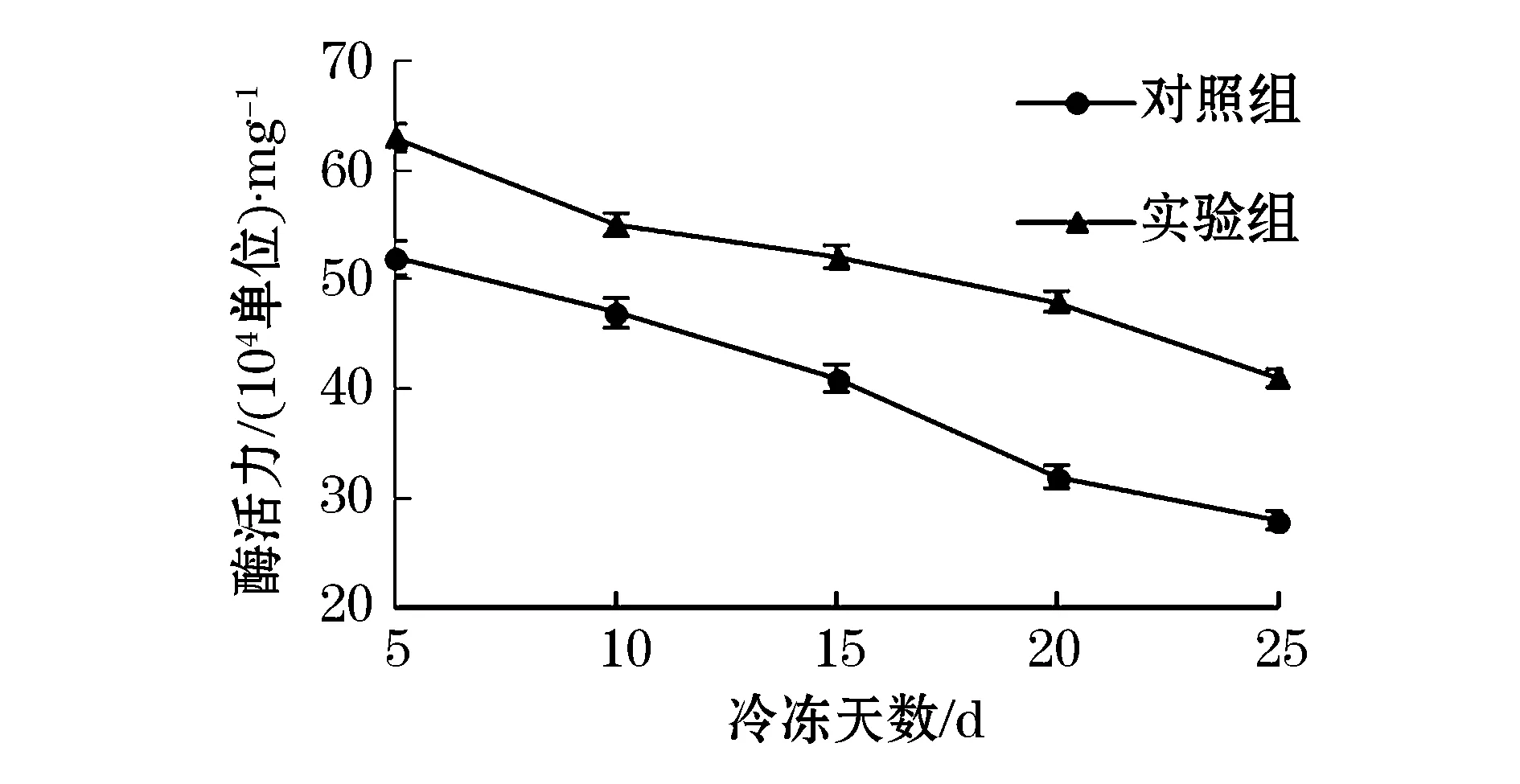
图10 冷冻时间对木瓜蛋白酶活力的影响
2.6 AISPPs添加量的确定
由图11可知,随着添加AISPPs质量分数的增加,木瓜蛋白酶的酶活力呈现先增高后减小的趋势.当AISPPs质量分数为0.5%时,木瓜蛋白酶活力达到最高值6.3×105U/mg.Carpenter J F等[15]发现ISPs相对质量分数较低时可显著提高红细胞的存活率;而较高质量分数将致使红细胞的存活率降低.其原因是ISPs具有双重效应,当质量分数较低时,具有抑制大的冰晶形成的作用,表现出对细胞膜的保护;而当质量分数较高时,ISPs进入磷脂双分子层,破坏其结构引起渗漏,影响了其与冰晶亲和作用强度,促进了大冰晶的形成,成为细胞膜毒害剂[3].说明适宜的质量分数决定了其抗冻保护作用,而AISPPs的最适添加量为0.5%.

图11 冰结构蛋白质量分数对木瓜蛋白酶活力的影响
3 结 语
本文利用冰结合磷酸缓冲液提取法提取AISPs,并用碱性蛋白酶对其进行酶解.通过单因素及响应面法对AISPs的水解条件优化,优化结果为酶解时间为2.8 h,酶解pH为5.2,酶解温度为50.6 ℃.在最佳工艺条件下,经过3次重复试验验证,AISPs的DH%为15.89%,水解后得到苜蓿冰结构蛋白肽,探究AISPPs对木瓜蛋白酶活力的影响.于-30 ℃冻藏5 d条件下,发现加入AISPPs可提高木瓜蛋白酶活力;当冷冻时间为25 d时,对照组木瓜蛋白酶酶活性为2.8×105U/mg,实验组木瓜蛋白酶酶活性为4.1×105U/mg,相比对照组酶活性提高了46.43%.比较质量分数为0.2%、0.3%、0.4%、0.5%、0.6%的AISPPs对木瓜蛋白酶活力的影响,发现AISPPs为0.5%时,木瓜蛋白酶活力达到最高值6.3×105U/mg.
