新型抗结核活性化合物H37Ra的耐药菌筛选及其菌落表型
2020-04-30姚梦依钱嘉宁狄玉昌陈润白嘉诚张雪莲
姚梦依,钱嘉宁,狄玉昌,陈润,白嘉诚,张雪莲
复旦大学生命科学学院遗传工程国家重点实验室, 上海 200433
结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)目前仍是全世界十大致死的致病感染源之一,世界卫生组织(World Health Organization,WHO) 2018年数据统计显示,仅2017年度全球共发生约 1 000 万新发结核病病例及160万死亡病例[1],有55.8万新发病例对抗结核一线药物——利福平耐受,其中有82%的患者感染的是耐多药结核菌。耐多药、广泛耐药菌的产生使得结核病治疗面临巨大挑战[2-3],目前临床上广泛使用的仍为20世纪研发的药物。近几十年来抗结核上市新药仅有贝达喹啉和德拉马尼,但耐药结核菌的不断产生,使得抗结核新药的研发依然迫在眉睫[4-5]。
ATB-152E和ATB-152J为本实验室前期获得的具有良好抗结核活性的2种结构类似的小分子化合物,最低抑菌浓度(minimal inhibitory concentration,MIC)均为0.09 μg/mL,专利ZL201210088290.0。由于结核分枝杆菌耐药菌株中存在的突变基因往往与该药物的作用靶标密切相关[6-7],为探索ATB-152E和ATB-152J的抗结核靶标及可能的耐药机制,本实验筛选了这2种小分子化合物的耐药菌株,并对其进行表型分析,期望为后续全基因组测序发现耐药菌基因组突变及探明ATB-152E和ATB-152J可能的抑菌作用机制提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株 结核分枝杆菌H37Ra(MycobacteriumtuberculosisH37Ra,简写为WT Ra)为本实验室保存菌种,卷曲霉素购自美国Sigma公司。
1.1.2 培养基 油酸、白蛋白、右旋葡萄糖、过氧化氢酶(oleic acid,albumin,dextrose,catalase,OADC)培养基100 mL:称取5 g 牛血清白蛋白第5组分(上海艾研生物科技有限公司)、0.03 g 过氧化氢酶(美国Sigma公司)、2 g 右旋葡萄糖、0.85 g NaCl、12 μL Oleic Acid(上海生工生物工程有限公司),加水定容至100 mL,用0.22 μm滤膜(德国默克公司)过滤除菌; Sauton培养基100 mL:称取0.4 g天门冬素、0.2 g柠檬酸、0.05 g磷酸氢二钾、0.05 g MgSO4·7H2O、0.05 g枸橼酸铁铵、6 mL甘油,氨水调pH至7.2~7.4,加水定容至100 mL;米氏7H9、7H10 肉汤为美国 BD公司产品。
1.1.3 仪器 宏观变倍体视显微镜(型号:Stereo Discovery. V20)购自德国卡尔蔡司公司。
1.1.4 抗结核活性小分子化合物 ATB-152E和ATB-152J为上海皓元化学合成有限公司为本实验室合成定制[8]。
1.2 方法
1.2.1 耐药菌的筛选 准备含有1x、2x、4x、8x MIC ATB152-E和ATB152-J的7H10-OADC平板。将对数期的WT Ra按1∶50接种于100 mL 7H9-OADC培养基中,37 ℃培养2周至A600=0.8,按每管1 mL(约107CFU/mL)菌液分装,13 000 r/min离心1 min,弃去900 μL上清液,将菌体重悬在100 μL的培养基中备用。将上述离心、重悬、含107CFU/mL的菌液,分别涂布于含有不同浓度的ATB152-E或者ATB152-J的7H10-OADC平板(1x MIC ATB152-J、2x MIC ATB152-E、2x MIC ATB152-J、4x MIC ATB152-E、4x MIC ATB152-J),每个梯度设多个重复板。将这些平板于37 ℃倒置培养3~4周,统计每个浓度梯度生长的菌落数,挑取单克隆,在液体培养基7H9-OADC中37 ℃扩大培养,培养基中加有单克隆生长平板对应的药物浓度。待菌长到对数期,将菌液继续在含有2倍化合物浓度的固体平板上划线培养。如此不断提高化合物筛选浓度以获得遗传稳定的耐药菌株。
1.2.2 耐药菌MIC的测定 Mtb MIC测定方法采用微孔法[9],将培养至对数期的WT Ra和耐药菌菌液分别稀释到A600=0.1,然后用7H9-OADC培养基稀释100倍。取2块96孔圆底微孔板,在第1块板中,B2、D2孔中加入198 μL 稀释后的耐药菌菌液,B、C、D、E行的其余孔内加入100 μL耐药菌菌液,在F2和G2孔内加入稀释后的WT Ra菌液,F、G行的其余孔加入100 μL WT Ra菌液;在B2和D2孔内加入2 μL浓度为10 mg/mL的ATB152-E(或ATB152-J),F2和G2孔内加入2 μL浓度为10 mg/mL的卷曲霉素作为阳性对照;在B2孔内吸取100 μL混匀的菌液加入B3孔内,吹打均匀后再吸取100 μL加至B4孔。以此类推,梯度稀释,直到下一行C10孔,直接吸取100 μL弃去,C11孔为不加化合物的对照孔;D、E行是技术重复孔,方法相同。F2~F10同理梯度稀释,G行同理为技术重复孔。在第2块板中,第2列B~E内,加入稀释后的WT Ra菌液198 μL和2 μL浓度为144 μg/mL的化合物(终浓度为16x MIC),B2、C2中加ATB152-E,D2、E2中加ATB152-J;接下来每行进行同上的梯度稀释;最后每块板的四周每孔需加上200 μL无菌H2O,以防蒸发。封口膜封口,37 ℃培养箱静置培养,3周后观察实验结果。
1.2.3 耐药菌菌落形态观察 将培养至对数期的WT Ra和耐药菌菌液分别稀释到A600=0.3,梯度稀释到10-4,取50 μL涂布于相应MIC的平板,37 ℃ 倒置培养约6周,置于宏观变倍体视显微镜下观察菌落形态并拍照记录,对菌落形态表型进行分析。
1.2.4 耐药菌的成膜观察 收集5 mL培养至对数期的WT Ra和耐药菌菌液,用Sauton培养基洗1次; 用Sauton培养基将菌液调整到A600=0.3,再稀释30倍,于24孔板中加入菌液1.3 mL/孔,每种菌各3个复孔,四周加1 mL无菌H2O以防蒸发;封口膜封口,铝箔包裹,于37 ℃培养4~6周,观察结果并对形成的生物膜表型进行分析。
2 结果
2.1 耐药菌的筛选
经过含药平板涂板以及平板划线逐步提高化合物浓度的层层筛选,得到了ATB-152E的耐药株(表1)以及ATB-152J的耐药株(表2)。第1轮筛选从1x MIC ATB-152E平板筛选到1株耐药菌,其余重复平板上的单克隆没能在含有化合物的培养基中生长,即未能形成稳定耐药;从6个不同的2x MIC ATB-152E平板筛选到6株耐药菌;后期通过不断提高化合物筛选浓度的方法,最终筛选到ATB-152E耐药菌17株(表1)。ATB-152J耐药菌也经历类似的筛选过程,在4x MIC和8x MIC分别筛选到1个生长菌落,通过连续不断提高化合物浓度,最终筛选到ATB-152J耐药菌15株(表2)。这两种化合物的耐药频率均为10-7,即涂107CFU于平板上最多只能长出1个耐药菌株。
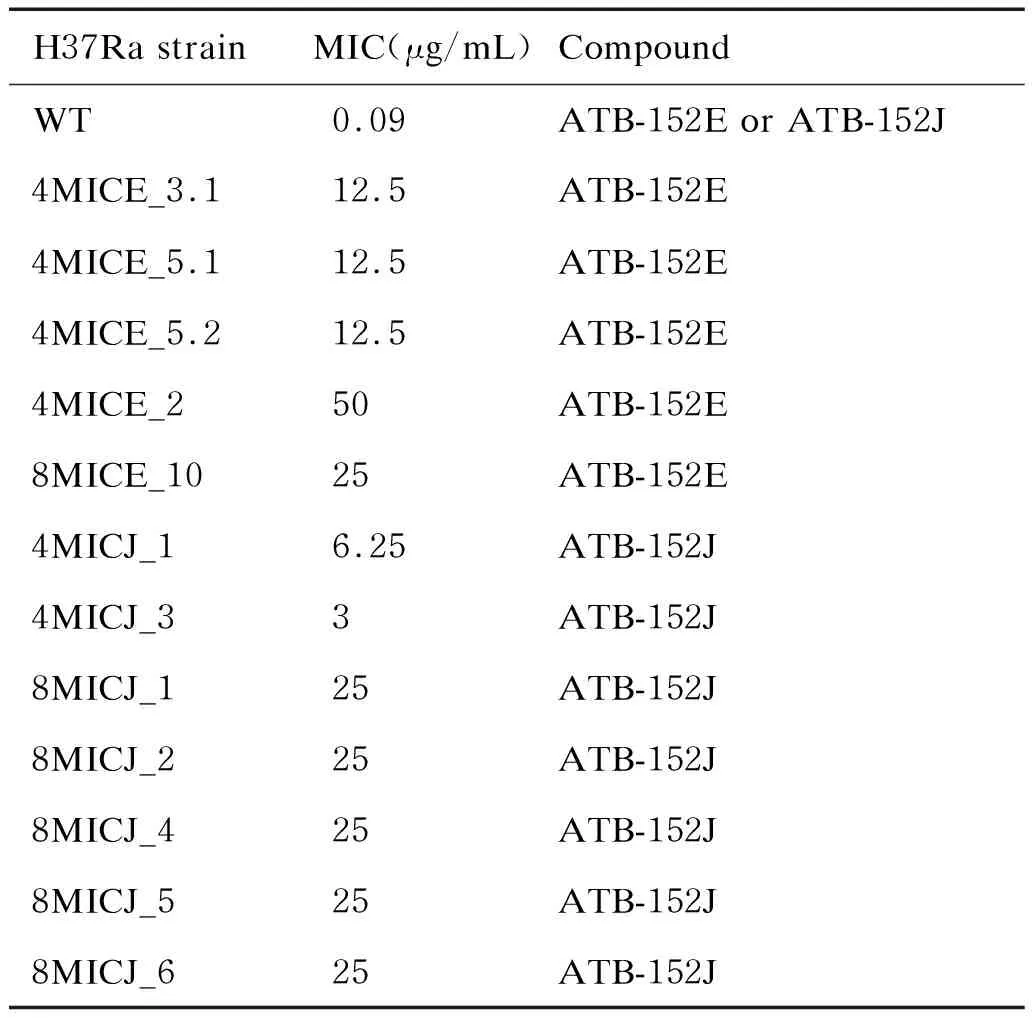
2.2 耐药菌MIC测定
为确定筛选得到的耐药菌遗传稳定性及具体耐药程度,对筛选的菌株进行两种化合物的MIC测定。采用微孔法对在含4x MIC以上的培养板上依然生长的耐药菌进行MIC测定,结果见表3所示。测定结果显示这些耐药菌分别为化合物ATB-152E和ATB-152J的耐药菌株,且部分菌属于高度耐药菌,它们是:4 MICE_2、8 MICE_10、4 MICJ_1、8 MICJ_1、8 MICJ_2、8 MICJ_4、8 MICJ_5和8 MICJ_6。
2.3 耐药菌与野生株菌落形态的差异
为分析筛选的耐药菌与野生株的形态差异, 用宏观变倍体视显微镜观察7H10-OADC固体平板上培养 6 周后的单菌落形态。结果显示,生长6周后,耐药菌的形态与野生株存在显著差异。随着耐药程度的增加,ATB-152E耐药菌形态逐渐变得更为隆起,褶皱变多;最高倍的耐药菌褶皱密集,几乎凝结成团块状。此外ATB-152E耐药菌较野生株更为干燥(图1)。ATB-152J耐药菌随着耐药程度的增加,形态更为扁平,褶皱减少,表面呈现出颗粒状隆起(图1)。
表1 ATB-152E H37Ra耐药菌
Tab.1 ATB-152E resistant H37Ra strains

ATB-152Er H37Ra strainsSource1MICE_1colony from 1x MIC plate2MICE_1colony from 2x MIC plate2MICE_2colony from 2x MIC plate2MICE_3colony from 2x MIC plate2MICE_5colony from 2x MIC plate2MICE_6colony from 2x MIC plate2MICE_7colony from 2x MIC plate4MICE_3.1restreaked from 2MICE_34MICE_5.1resreaked from 2MICE_54MICE_5.2resreaked from 2MICE_54MICE_2resreaked from 2MICE_28MICE_10resreaked from 4MICE_24MICE_1'colony from 4x MIC plate4MICE_2'colony from 4x MIC plate8MICE_2.2'resreaked from 4MICE_2'8MICE_2.3'resreaked from 4MICE_2'8MICE_2.4'resreaked from 4MICE_2'
表2 ATB-152J H37Ra耐药菌
Tab.2 ATB-152J resistant H37Ra strains

ATB-152Jr H37Ra strainsSource4MICJ_1colony from 4x MIC plate4MICJ_3colony from 4x MIC plate4MICJ_1'colony from 4x MIC plate4MICJ_2'colony from 4x MIC plate4MICJ_3'colony from 4x MIC plate4MICJ_4'colony from 4x MIC plate8MICJ_1.1'resreaked from 4MICJ_1'8MICJ_1.2'resreaked from 4MICJ_1'8MICJ_1.3'resreaked from 4MICJ_1'8MICJ_1.4'resreaked from 4MICJ_1'8MICJ_1colony from 8x MIC plate8MICJ_2colony from 4x MIC plate8MICJ_4colony from 4x MIC plate8MICJ_5colony from 4x MIC plate8MICJ_6colony from 4x MIC plate
表3 耐药菌MIC测定
Tab.3 MICs against monodrug-resistant H37Ra strains
H37Ra strainMIC(μg/mL)CompoundWT0.09ATB-152E or ATB-152J 4MICE_3.112.5ATB-152E4MICE_5.112.5ATB-152E4MICE_5.212.5ATB-152E4MICE_250ATB-152E8MICE_1025ATB-152E4MICJ_16.25ATB-152J4MICJ_33ATB-152J8MICJ_125ATB-152J8MICJ_225ATB-152J8MICJ_425ATB-152J8MICJ_525ATB-152J8MICJ_625ATB-152J
2.4 耐药菌与野生株成膜能力的差异
研究中还发现耐药菌菌膜形成速度以及形成时间与野生株也存在明显差异,因此我们对耐药菌株的生长表型进行了分析。H37Ra野生株(WT)、 ATB-152E高度耐药菌株4MICE_2、8MICE_10、 ATB-152J高度耐药菌株4MICJ_1、8MICJ_1在液体Sauton培养基中培养4~6周后,液体表面会逐渐形成生物膜。将生物膜置于宏观变倍体视显微镜下观察(图2),结果显示,4周时菌株4MICE_2没有形成生物膜,4MICJ_1生物膜并没有完全形成,而野生株生物膜已基本形成,菌株8MICE_10和8MICJ_1生物膜形成能力都强于野生株,且8MICJ_1成膜能力更强;6周时4MICE_2生物膜仍未形成,4MICJ_1生物膜已形成,但膜的完整性明显低于野生株,8MICE_10和8MICJ_1生物膜形成能力都强于野生株,均有褶皱形成,且8MICJ_1成膜能力更强,褶皱更多。

图1 H37Ra野生株、ATB-152E耐药株和ATB-152J耐药株的菌落形态
Fig.1 Colony morphology of H37Ra (WT), ATB-152E resistant H37Ra strain and ATB-152J resistant H37Ra strain

图2 H37Ra野生株、ATB-152E耐药株和ATB-152J耐药株的生物膜形成
Fig.2 Biofilm formation of H37Ra (WT), ATB-152E resistant H37Ra strain and ATB-152J resistant H37Ra strain
3 讨论
细菌产生耐药有各种各样的机制,研究表明目前主要包括通过降低细胞膜的通透性以减少药物与靶标的结合、靶标发生基因突变、细菌对靶标进行翻译后修饰、对抗菌药物进行修饰等[10]。在Mtb中,细菌耐药与靶标基因突变关系密切,如果基因组不发生变化,则为表型耐药,细菌转接后无法在含药培养基中生长[11],具有遗传稳定性的耐药则大多由基因组上靶蛋白的突变导致,因而筛选细菌的耐药菌,探究耐药菌中的突变位点,是寻找抗结核药物中作用靶标最保守、最可靠的方式[6-7]。
本研究筛选了ATB-152E和ATB-152J两种化合物的耐药菌,在筛选过程中发现,两种化合物的耐药菌都比较难以筛选,只有当平板上涂布菌量达到107以上才能长出1株耐药菌株,且耐药频率较低。研究中发现,Mtb ATB-152E和ATB-152J耐药菌菌落形态和生物膜生长速度和成熟均与野生株存在显著的差异。在筛选过程中耐药菌的菌落形态以及液体培养菌膜的产生都发生很大变化,菌落形态明显比野生株更为隆起。液态培养条件下,生长较长时间的Mtb 会形成完整的菌膜,菌膜的生长速度和成熟与细菌代谢和毒力密切相关[12]。本研究中耐药菌菌膜形成速度也与野生株存在明显差异,在同一接种量、相同生长时间条件下,有的耐药菌较野生株菌膜更为厚实,有的则未能形成完整菌膜,因此对耐药菌株的生长表型进行了分析。
尽管ATB-152E和ATB-152J的结构较为类似,但耐药菌株的表型却并不完全一致,提示两种化合物的突变位点可能并不完全相同或化合物作用存在多个作用靶点。Mtb的细胞壁脂质含量高达约40%的细胞干重[13],且细菌的菌落形态、生物膜的形成均与细菌细胞壁的脂质成分相关[14],因而这些表型的改变证明活性化合物耐药菌的基因突变可能导致细菌脂肪酸合成异常。此外ATB-152E或ATB-152J作用Mtb的 RNA-seq数据分析(未发表数据)也初步发现脂肪酸合成通路相关基因有显著变化,提示两种化合物的作用机制可能与脂肪酸合成密切相关。脂肪酸合成是结核分枝菌酸(mycolic acid,MA)合成的重要通路,而MA是Mtb细胞壁的重要组分,因此脂肪酸合成通路是抗结核新药开发非常有潜力的作用靶点方向[15-16]。异烟肼的作用靶点InhA就是靶向脂肪酸合成通路FAS-Ⅱ系统[17]。临床前阶段的抗结核药物BM212也是靶向该通路上的MmpL3,通过阻断海藻糖单霉菌酸酯(trehalose monomycolates,TMM)的转运,影响分枝酸的合成[18]。抗结核新药德拉马尼也被认为影响了MA的合成,可见脂肪酸合成对于Mtb非常重要,通路中的关键蛋白都有可能会成为药物作用的靶点[13]。
随着微生物全基因组测序技术在Mtb耐药机制研究中趋于成熟[19],基于本研究ATB-152E和ATB-152J耐药菌的获得,后续将进一步对这些耐药菌进行全基因组测序,从比较基因组角度来寻找引起菌株耐受两种化合物以及引起耐药菌株表型发生显著变化的分子机制。一方面从突变基因的生化角度,体外表达纯化相关基因编码蛋白,利用药物亲和反应靶点稳定性(drug affinity responsive target stability,DARTS)技术、等温滴定量热法(isothermal titration calorimetry,ITC) 测定目标蛋白与活性化合物的结合能力,同时检测化合物对这些基因的体外生化功能的影响;另一方面从Mtb内作用的靶标角度,通过菌体内过表达筛选的突变基因,评价过表达菌株对ATB-152E和ATB-152J化合物的敏感性,确定基因与耐药的关系,进而最终阐明化合物的耐药和作用机制。
