超声光散射成像技术预测乳腺癌新辅助化疗疗效的价值
2020-04-30唐发兵王红磊马苏美
刘 娟 王 惠 唐发兵 王红磊 吉 琨 马苏美
乳腺癌是全球女性发病率、死亡率最高的恶性肿瘤之一[1]。新辅助化疗(neoadjuvant chemotherapy,NCT)在提高乳腺癌保乳手术率,降低术后复发率方面具有重要作用[2]。乳腺癌分子亚型及个体差异均会导致化疗疗效存在较大差异。因此,早期准确评估对于选择最佳的化疗方案至关重要。超声光散射成像(ultrasound-guided diffuse optical tomography,US-DOT)是一种光学成像技术,可以活体检测乳腺癌的血红蛋白浓度(hemoglobin concebtration,HBT),动态反映肿瘤内血供的变化情况,而肿瘤内血供情况与乳腺癌的发展密切相关[3]。本研究通过监测US-DOT参数HBT的变化,以及其与肿瘤最大径变化的关系,探讨US-DOT预测乳腺癌NCT疗效的价值。
资料与方法
一、研究对象
选取2018年6月至2019年7月在我院行乳腺癌NCT的患者58例,年龄27~68岁,平均(48±9)岁,肿瘤最大径14.5~50.0 mm,平均(27.7±8.9)mm。参照实体瘤临床疗效评估标准(response evaluation criteria in solid tumors,RECIST)[4],58 例患者行 NCT 后根据疗效分为完全缓解8例(CR组),部分缓解33例(PR组),进展17例(SD组),未见稳定患者。纳入标准:①单发病灶;②化疗前经病理证实为浸润性导管癌,临床医师拟行NCT治疗;③化疗前后均行US-DOT检查;④化疗后所有病灶均行手术切除和病理检查。排除标准:①单侧乳腺切除;②多发恶性病灶;③皮肤表面破溃、明显瘢痕、部分内陷及肿物明显突出于体表;④病灶位于乳头和乳晕附近;⑤病灶表面皮肤色素沉着;⑥肿块较大,无法测量大小及HBT。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
使用新奥博为有限公司OPTIMUS-Ⅱ超声光散射成像系统,US-DOT系统复合探头,频率5~10 MHz。患者取仰卧位或侧卧位,充分暴露双乳,先行常规超声扫查,选取病灶最大切面测量病灶最大径,然后启动光学模式,于病灶最大切面获取HBT,连续扫查5次取平均值,每次测量的切面保持一致。化疗前后肿瘤最大径变化百分比(△Size%)=(化疗前肿瘤最大径-化疗后肿瘤最大径)/化疗前肿瘤最大径×100%,化疗前后肿瘤HBT变化百分比(△HBT%)=(化疗前肿瘤HBT-化疗后肿瘤HBT)/化疗前肿瘤HBT×100%。所有检查均由同一具有主治职称的超声医师完成。
三、新辅助化疗疗效评估标准
1.影像学评估标准:使用RECIST标准,将乳腺癌NCT疗效分为:①肿瘤完全消失为完全缓解;②肿瘤最大径减少30%以上为部分缓解;③肿瘤最大径增加20%以上为进展;④介于部分缓解与进展之间为稳定。
2.病理学评估标准:使用 Miller-Payne(MP)[5]病理评估方法,主要针对NCT后残余肿瘤的细胞丰富程度分为5级:①1级(G1),癌细胞无改变或仅个别癌细胞改变,细胞总数未减少;②2级(G2),癌细胞减少不超过30%,总数仍较高;③3级(G3),癌细胞减少30%~90%;④4级(G4),癌细胞减少超过90%,仅残存散在的小簇状癌细胞或单个癌细胞;⑤5级(G5),原肿瘤瘤床部位已无癌细胞,但可存在导管原位癌。NCT后癌细胞减少>30%(G3~G5)判为化疗有效。
四、统计学处理
应用SPSS 19.0统计软件,样本分布的检验采用单样本K-S拟合优度检验,计量资料以x±s或中位数(四分位距)表示,符合正态分布时组内比较行t检验,组间比较采用方差分析;不符合正态分布时组内及组间比较均行非参数检验。化疗前后△HBT%与△Size%的相关性采用Pearson相关性分析法。绘制受试者工作特征(ROC)曲线分析△HBT%预测NCT有效的截断值,计算诊断效能。P<0.05为差异有统计学意义。
结 果
一、NCT前后各组肿瘤HBT和大小的变化
各组患者化疗后HBT和肿瘤最大径均低于化疗前,组内比较差异均有统计学意义(均P<0.001)。见表1,2和图1,2。化疗后各组△Size%和△HBT%组间比较差异均有统计学意义(F=45.049、26.712,均P<0.001)。见表3。
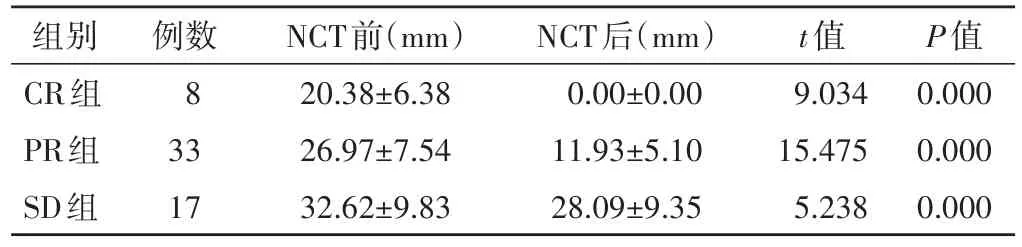
表1 各组NCT前后肿瘤最大径组内比较(x±s)
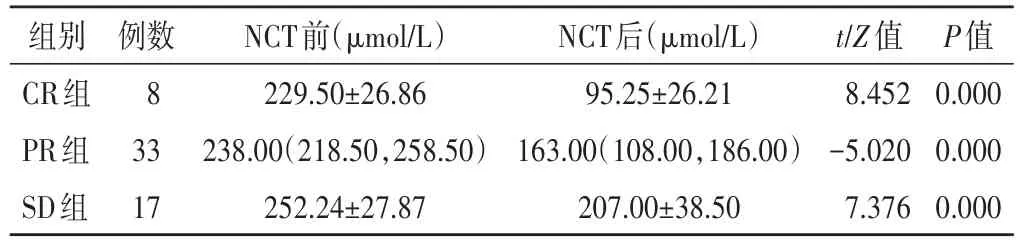
表2 各组NCT前后肿瘤HBT组内比较
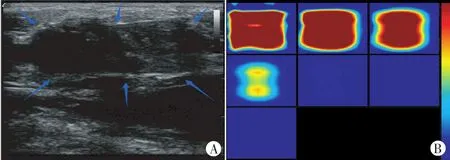
图1 PR组患者NCT前US-DOT图

图2 PR组患者NCT后US-DOT图
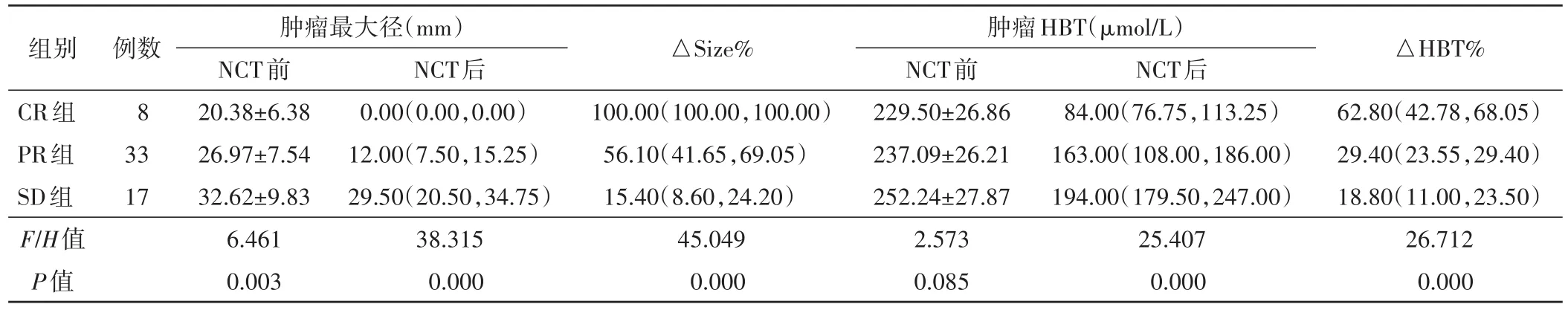
表3 各组NCT前后肿瘤HBT和最大径组间比较
二、相关性分析
Pearson相关性分析显示,△HBT%与△Size%呈正相关(r=0.874,P<0.001)。见图3。
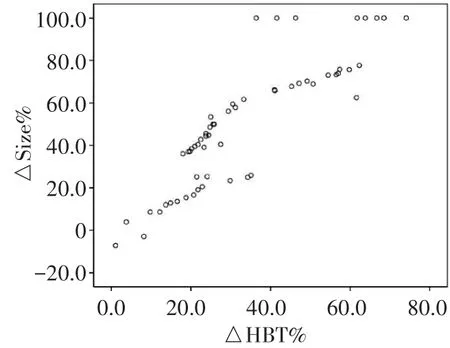
图3 △HBT%与△Size%相关性分析散点图
三、ROC曲线分析
ROC曲线分析显示,△HBT%预测NCT有效的截断值为22.9%,诊断敏感性、特异性、阳性预测值、阴性预测值、准确率分别为82.93%、76.47%、89.47%、65.00%、81.03%,曲线下面积为0.872。见图4。
讨 论
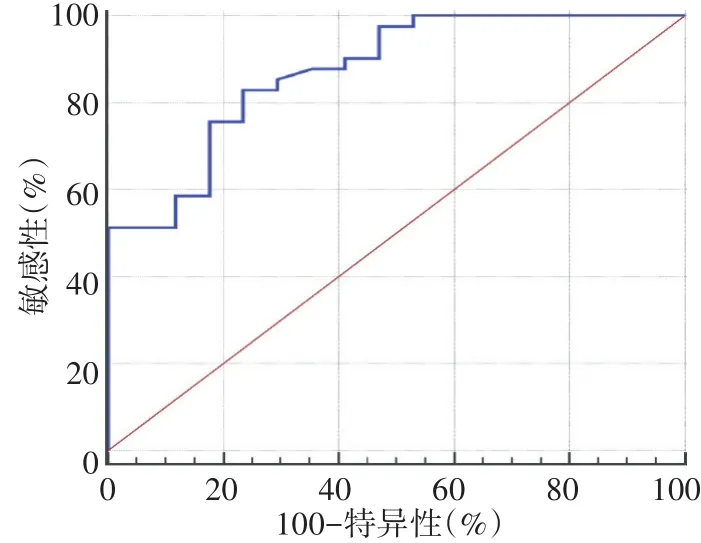
图4 △HBT%预测NCT有效的ROC曲线图
研究[6]显示,仅30%的NCT乳腺癌患者可以达到病理完全缓解,仍有部分患者对NCT不敏感。因此,早期准确评价NCT疗效、及时调整治疗方案至关重要。目前用于评估NCT疗效的方法有临床触诊、影像学检查及病理学评估。临床触诊与检查医师的临床经验有关,主观性较大;病理学评估需要切除肿瘤后进行,检测滞后。因此,影像学检查成为评价NCT疗效的主要方法。
影像学评估方法主要根据RECIST标准[4]对肿瘤最大径的变化率进行监测,以此评估NCT疗效。恶性肿瘤的组织代谢及功能变化早于形态学变化,肿瘤的生物学指标可以更早地预测NCT疗效。微血管的持续生成在恶性肿瘤生长与转移中起着重要作用,随着恶性肿瘤的快速生长,肿瘤细胞消耗大量氧,诱导血管生长因子形成,导致恶性肿瘤大量的微血管形成,随之肿瘤内部的氧合血红蛋白和脱氧血红蛋白均增多[7]。US-DOT利用近红外光下氧合血红蛋白和脱氧血红蛋白具有不同程度的吸收及散射特性的原理,可以无创测量肿瘤HBT,间接反映肿瘤微血管密度[8]。Zhi等[9]研究发现乳腺癌的临床病理特征,如雌激素受体和孕激素受体状态、Ki67指标、腋窝淋巴结转移、淋巴管侵犯等均与HBT相关。因此,可以应用US-DOT监测肿瘤HBT的变化来预测NCT的疗效。目前国内外研究[10-11]均报道HBT的变化可以预测NCT的疗效,从而指导临床治疗方案的选择及患者的个体化治疗。
本研究结果显示,化疗后各组肿瘤最大径和HBT均较化疗前有所下降,下降程度表现为CR组最大,PR组、PD组依次降低,差异均有统计学意义(均P<0.001),且△Sise%与△HBT%呈高度正相关(r=0.874,P<0.001),说明△HBT%和△Sise%均可用于评估肿瘤对化疗药物的反应。分析此线性关系的存在是由于恶性肿瘤有大量新生血管生成,化疗后肿瘤的新生血管被破坏,HBT含量明显减少,肿瘤细胞死亡,肿瘤细胞增殖减慢导致肿瘤体积变小,此为△HBT%预测NCT疗效的临床病理特征依据。本研究进一步以病理结果为金标准,绘制ROC曲线分析△HBT%预测NCT有效的截断值为22.9%,诊断敏感性、特异性、阳性预测值、阴性预测值、准确率分别为82.93%、76.47%、89.47%、65.00%、81.03%,曲线下面积0.872,说明△HBT%预测NCT疗效具可靠性,与智文祥等[11]研究结果一致。
但本研究样本量较少,今后需进一步扩大样本量进行多中心前瞻性研究,以期为临床提供更加便捷、准确的影像学评估方法。
综上所述,US-DOT作为一种组合技术,可以同时获得肿瘤大小和HBT,通过监测△HBT%来预测NCT疗效,能及时、科学地指导临床治疗,在临床应用中具有较好价值。
