Nobiletin 对慢性低灌注损伤后小鼠脑海马神经血管单元的影响
2020-04-29赵宇红陈世坚李坤平郑凌云
赵宇红 陈世坚 李坤平 郑凌云
(广东药科大学 1药学院,广东 广州 510006;2生命科学与生物制药学院)
慢性脑缺血是引起老年脑认知障碍的主要原因,研究表明,慢性脑缺血发生后,脑内神经血管的稳态失衡,继发的局部代谢障碍和蛋白代谢异常均可损伤神经血管单元各组分,引起血管性痴呆、阿尔茨海默病等认知障碍性疾病的发生〔1,2〕。川陈皮素(NOB)为传统中药陈皮中提取到的一种多甲氧基黄酮类化合物,脂溶性好,易于吸收和进入中枢。研究表明,NOB可减轻缺血再灌注脑血管损伤,抑制脑内炎症反应,具有神经营养活性〔3〕,但NOB对脑慢性脑缺血的认知改善及其神经血管单元保护机制研究报道较少见。本实验利用慢性低灌注模型,观察NOB对慢性低灌注环境下海马区神经血管单元的影响及机制。
1 资料及方法
1.1实验动物 8周龄SPF级昆明小鼠,重20~30 g,购自广东省实验动物中心,饲养于广东药科大学实验动物中心SPF饲养室,自由摄食和饮水,12 h光暗交替,相对湿度55%,温度为22~24℃。适应1 w后进行实验。
1.2分组与处理 随机将小鼠分为假手术组、模型组、NOB低剂量组〔(25 mg/(kg·d)〕、高剂量组〔50 mg/(kg·d)〕各10只。造模前12 h禁食,用10%水合氯醛(300 mg/kg)腹腔注射麻醉,卧位固定,参照文献方法〔4〕,沿颈正中切口切开皮肤,分离肌肉,暴露颈总动脉,结扎双侧颈总动脉,假手术组不结扎,药物组于造模前3 d开始给予药物腹腔注射,术后继续给药2 w,其余各组给予等量生理盐水。实验完成后,同前法麻醉,打开颅骨,迅速取出脑组织,置于冷的D-hank液中,冰上分离海马,去除表面血管膜,置液氮中速冻,-80℃保存。
1.3药品与试剂 NOB、水通道蛋白(AQP)4酶联免疫吸附试验(ELISA)试剂盒及 Laminin ELISA试剂盒均购自上海江莱生物科技有限公司,Claudin-5 ELISA试剂盒自购武汉华美生物工程有限公司,海马区神经元生长相关蛋白(GAP)-43、突触素(SYN)多克隆抗体、辣根过氧化物酶(HRP)标记羊抗兔免疫球蛋白(Ig)G购自Abcam公司,RNA提取试剂盒、cDNA合成试剂盒、RNA聚合酶链反应(PCR)试剂盒均购自宝生物工程公司,其他常用试剂购自广州赛哲生物科技股份有限公司。
1.4旷场实验〔5〕实验敞箱为40 cm×40 cm×40 cm大小,箱底部分为16格区域,将小鼠面朝墙置于箱角暗区,让其自由探索环境10 min,每只接受1次测试,测试结束后,清水清洗场地并擦干,箱顶用摄像仪记录内小鼠活动总路程及中央区停留时间。
1.5Y迷宫实验 ①新异臂探索实验:用隔板挡住新异臂,小鼠由起始臂末端放入,让其自由活动10 min,训练结束放回笼,1 h后进行测试,测试时取出新异臂隔板,让其自由活动5 min,记录其活动情况;②电刺激测试:Y迷宫以亮灯臂为安全区 (不通电),其他区均为非安全区 (电击区) 。安全区随机变换,亮灯延迟5 s进行电击,以立即逃往安全区为一次正确反应,连续9次正确反应即为学会。实验中,将小鼠置于迷宫中适应3 min,记录其学会所需的训练次数,24 h后进行记忆保持能力的检测,以正确反应次数占总检测次数的百分比表示 (正确反应次数/总检测次数×100%)。
1.6脑海马组织分离及蛋白提取 根据文献方法〔6〕,小鼠麻醉后,迅速取出脑组织,冰上分离两侧海马,用冰的磷酸盐缓冲液(PBS)清洗后液氮速冻研碎,加入蛋白裂解液中裂解,4℃、12 000 r/min离心10 min,取上清,Bradford法测定蛋白含量。
1.7Western印迹法测定蛋白表达 采用Bio-Rad小型垂直电泳转印系统(美国),将提取的海马组织蛋白按5∶1比例加入4×十二烷基硫酸钠(SDS)缓冲液,100℃沸水变性3~5 min,10%SDS-聚丙烯酰胺凝胶电泳(PAGE)2 h,半干法转膜35 min,5%脱脂奶粉封闭1 h,分别加入小鼠抗SYN、小鼠抗GAP-43、小鼠抗AQP-4及 Claudin-5,β-Tublin为对照,4℃过夜,磷酸盐吐温缓冲液(PBST)洗3次×10 min,HRP-抗小鼠IgG室温孵育1 h,同前法漂洗,膜上加电化学发光(ECL)荧光显影液,暗室曝光,室温显影、定影,冲洗胶片,用Image J program进行灰度分析。
1.8统计学方法 采用SPSS16.0软件进行单因素方差分析、最小显著差异检测,如方差不齐,经秩和转换后按前法进行。
2 结 果
2.1旷场实验测试 模型组自由活动总时间较假手术组稍下降,NOB组自由活动情况有增加,但无显著性差异(P>0.05)。模型组中心区活动时间与假手术组相比明显降低(P<0.05),NOB组与模型组相比中心区活动时间延长,但仅NOB高剂量组差异显著(P<0.05)。见表1。
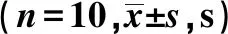
表1 各组自由活动时间的
与模型组比较:1)P<0.05;下表同
2.2Y迷宫刺激实验测试 与假手术组相比,模型组达学会所需训练次数明显增加,训练后正确率明显下降(P<0.05)。NOB组与模型组相比,所需训练次数减少,训练后正确率下降,仅高剂量组差异显著(P<0.05),见表2。提示NOB高剂量对学习能力及记忆力均有改善作用。
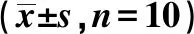
表2 各组Y迷宫训练学会次数及正确反应率
2.3各组海马区神经元可塑性相关蛋白表达 与模型组比较,假手术组GAP-43及SYN蛋白表达显著高,NOB高、低剂量可显著增加海马区GAP-43及SYN蛋白的表达(P<0.05),其中NOB高量组对蛋白表达的促进作用更显著。见表3,图1。

表3 各组海马GAP-43及SYN蛋白表达
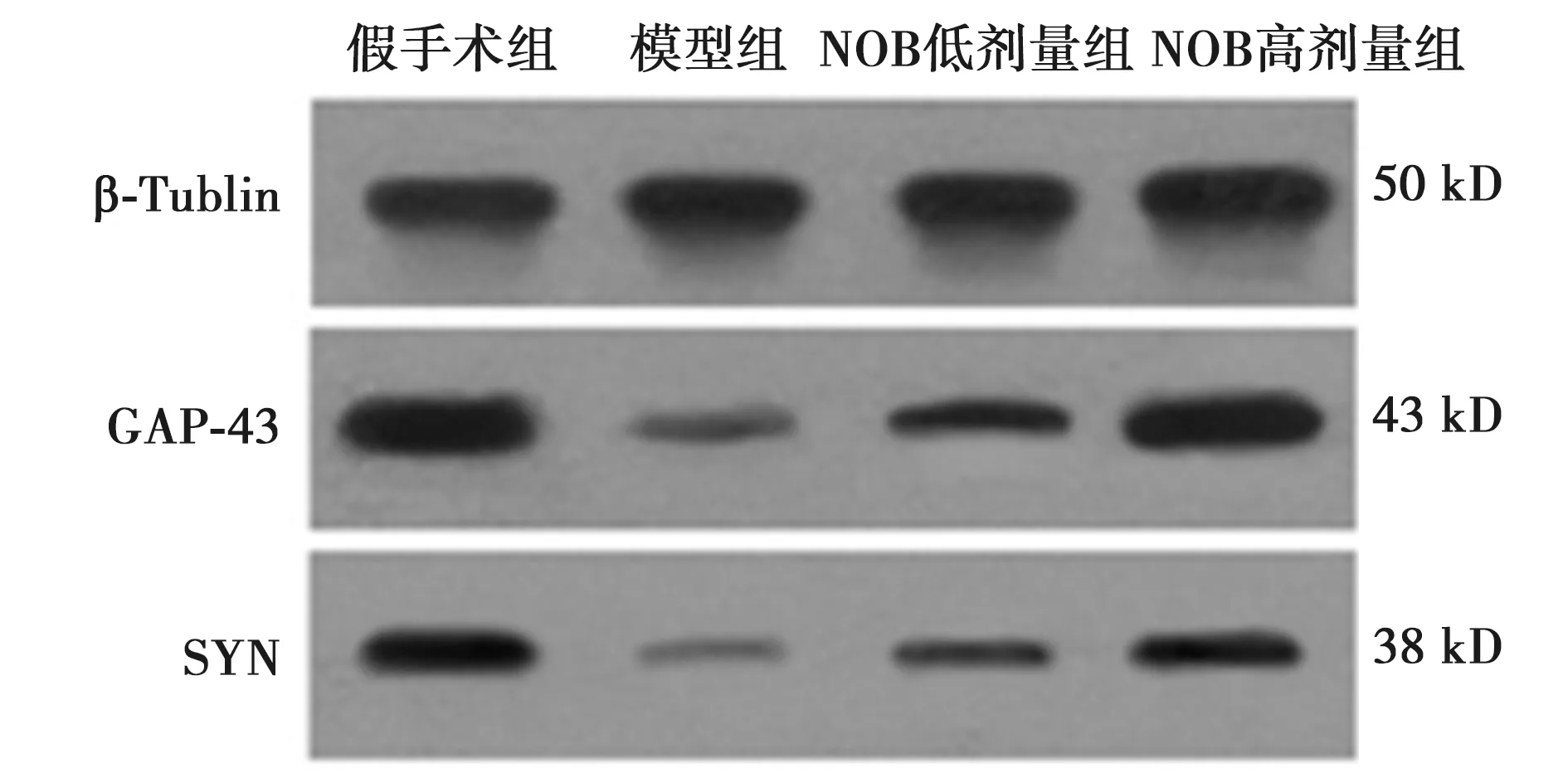
图1 各组海马GAP-43及 SYN蛋白表达
2.4各组海马区血脑屏障功能变化 与模型组比较,假手术组AQP-4、Claudin-5蛋白表达显著高,NOB高、低剂量组均可显著增加海马区AQP-4及Claudin-5蛋白的表达(P<0.05),其中,高剂量组对蛋白表达的增加作用更显著。见表4,图2。

表4 各组海马AQP-4及Claudin-5蛋白表达
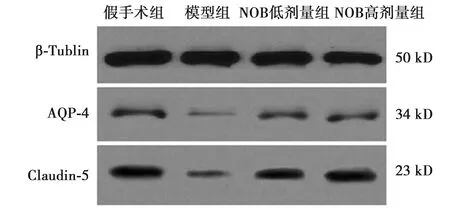
图2 各组海马AQP-4及Claudin-5蛋白表达
3 讨 论
本研究发现CCH不影响小鼠的自主活动情况,但可降低小鼠的探索能力和学习记忆能力,而NOB可明显改善这一现象。
神经血管单元是脑结构和功能的基本单位,脑内神经元与胶质细胞、血管组成的微环境的改变都可影响脑的功能〔7〕。 海马是与认知记忆相关的重要脑区,海马神经细胞突触可塑性的改变是认知记忆减退的主要原因。GAP-43及 SYN蛋白与突触可塑性密切相关,GAP-43高表达于突触发生的神经元突触前膜,与突触联系的建立及突触的损伤修复过程关系密切〔8〕。SYN蛋白位于突触小泡囊泡膜上,SYN基因敲除小鼠在行为学实验中表现出明显的学习记忆功能损伤〔9〕。本实验结果显示,CCH可使GAP-43及SYN蛋白表达下调,而NOB可通过增加海马区GAP-43及SYN蛋白的表达来调节神经突触可塑性,改善慢性脑缺血的学习记忆损伤。
AQP-4在脑内广泛分布于海马齿状回、脑血管表面及神经元与突触接触的胶质细胞,在血管周围胶质细胞上呈极性分布的AQP-4表达多与水分子流动及脑水肿有关。研究发现,海马区AQP-4的表达与神经可塑性相关,脑片离体培养的研究发现,AQP-4敲除可引起海马区θ波诱导的长时程增强受损及下调谷氨酸转运体1的表达,减少星形胶质细胞对谷氨酸的重摄取,使谷氨酸兴奋性突触过度激活,使突触可塑性受损,并影响相关学习记忆行为〔10,11〕。本实验结果表明NOB对CCH的学习记忆损伤的改善作用,可能与海马AQP-4增高相关的海马神经可塑性表达有关。
Claudin-5蛋白是脑内构成内皮细胞紧密连接的主要蛋白,血脑屏障(BBB)通透性与Claudin-5的表达密切相关。动物研究表明,缺血后内皮间结构受损可使其表达下降,影响BBB的通透性,是神经血管系统屏障功能紊乱的标志蛋白〔12,13〕。本研究显示,NOB可抑制CCH模型海马Claudin-5的下调,改善由慢性脑缺血引起的BBB的功能紊乱。
总之,NOB可能通过影响神经血管单元的多个靶点,提高神经可塑性,调节神经血管系统功能,在慢性脑缺血脑损伤中发挥脑保护作用。
