大豆肽改善阿尔茨海默病小鼠学习记忆行为的抗氧化应激和抗凋亡机制
2020-04-29刘卫云程志国徐宛玲崔明辰徐松涛李盘欣金少举马永超
刘卫云 程志国 徐宛玲 崔明辰 徐松涛 李盘欣 金少举 马永超,
(1承德护理职业学院,河北 承德 067000;2河北省滦平县小营乡卫生院;3漯河医学高等专科学校生物化学教研室 河南省肿瘤发生与防治创新型科技团队;4河南省南街村(集团)有限公司)
阿尔茨海默病(AD)又称“老年痴呆”,是一种以记忆障碍、认知功能损伤为特征,甚至出现行为怪异、人格异常等病理表现的中枢神经系统退行性疾病〔1〕。AD发病机制及病理过程复杂,研究报道,海马神经元细胞凋亡和过氧化应激是其发病的重要原因,因此,阻滞或干预神经元凋亡或过氧化应激是防治AD的主要策略之一〔2~4〕。大豆肽(SP)是大豆经酶解或微生物发酵而得,一般由2~10个氨基酸组成的小分子肽,容易消化吸收,含有人体所需的多种必需氨基酸,是中老年人、肿瘤患者及胃肠功能不佳者等的常用营养补品〔5〕。此外,SP还具有抗氧化、调节免疫、增强体力、缓解疲劳、降血脂及抗肿瘤等生理、药理活性,但国内外尚无SP防治AD的研究报道〔6~9〕。本研究通过小鼠侧脑室注射β-淀粉样蛋白(Aβ)25~35法建立AD动物模型,并给予不同剂量的SP进行干预,观察其对AD小鼠学习记忆能力、海马神经元凋亡及氧化应激的影响,同时检测海马组织细胞色素(Cyt)C、Caspase-3、B细胞淋巴瘤(Bcl-2)、Bcl-2相关X蛋白(Bax)等凋亡相关因子的表达水平,探讨SP防治AD的抗氧化应激和凋亡分子机制。
1 材料与方法
1.1主要试剂及仪器 SP由河南省南街村(集团)有限公司提供;盐酸多奈哌齐(批号:20170531), 5 mg/片,国药准字H20070181,购自卫材(中国)药业有限公司;Aβ25~35,5 mg/支,批号17-03-16,购自北京博奥森生物技术有限公司(使用方法:将2 mg Aβ25~35用生理盐水溶解为1 mg/ml浓度的储备液,用0.22 μmol/L滤膜过滤除菌后置于37 ℃培养箱中孵育7 d,使之老化为纤丝状凝聚态备用);超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)及总抗氧化能力(T-AOC)试剂盒,购自南京建成生物工程研究所;Tunel细胞凋亡检测试剂盒、Beyozol(总RNA抽提试剂)、BeyoRTTMIII cDNA合成试剂盒、Easy-LoadTMPCR Master Mix(2×)、DNA Molecular Weight Marker、琼脂糖、放射免疫沉淀法(RIPA)蛋白裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂盒、彩色预染蛋白质分子量标准、超敏电化学发光显色液、聚偏氟乙烯(PVDF)膜、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)快速配制试剂盒购自由碧云天生物技术有限公司提供;兔抗CytC、Caspase-3、Bax、Bcl-2及β-actin抗体、羊抗兔免疫球蛋白(Ig)G辣根过氧化物酶(HRP)标记二抗购自武汉博士德生物工程有限公司;PCR实验引物由生工生物工程(上海)股份有限公司设计与合成。 WMT-100 Morris水迷宫分析系统购自成都泰盟软件有限公司;752N型紫外可见分光光度计购自上海光学仪器厂;FA2104B电子分析天平购自上海精密仪器仪表有限公司;H2500R台式高速冷冻离心机购自长沙湘仪离心机仪器有限公司;BX43显微镜购自奥林巴斯(中国)有限公司;PCR仪、垂直电泳槽、水平电泳槽、化学发光凝胶成像系统等购自美国Bio-Rad公司。
1.2动物及分组 SPF级健康ICR小鼠,4周龄,18~22 g,雌雄兼用,购自北京维通利华实验动物技术有限公司,许可证号:SCCK(京)2016-0006。将小鼠分笼饲养于动物室,每笼10只,室温(22±2)℃,湿度50%~60%,常规饲料喂养,自由饮水。实验分组前,小鼠进行7 d的水迷宫游泳训练,第7天进行筛选,对找到平台潜伏期大于60 s和游泳水平较差的小鼠予以剔除。将筛选合格的60只小鼠随机分为阴性对照组(生理盐水)、模型组(生理盐水)、阳性药对照组(多奈哌齐 5 mg/kg)及SP 600、300及150 mg/kg剂量组,每组10只。各组先预防性灌胃(0.1 ml/10 g体重)给予相应的药物,每天1次,持续7 d。第8天,除阴性对照组侧脑室注射无菌生理盐水10 μl,其他各组均侧脑室注射老化的Aβ 25~35溶液10 μl复制AD动物模型,然后再继续给药14 d。
1.3Morris水迷宫实验测试定位航行逃避潜伏期及空间探索能力 给药结束前4 d,用Morris水迷宫实验测试定位航行逃避潜伏期(1次/d,共4 d)及空间探索能力(最后1 d测)。具体操作方法如下,(1)定位航行试验:将水迷宫圆形水池(直径120 cm,高度60 cm)注入蒸馏水,控制水深12 cm,用白色素将水染白至不透明,设置水温恒定于23~25℃。将圆形水池均分为4个象限,每象限边缘中心即为入水点,将一圆形跳台(直径6 cm,高度10 cm)置于第4象限中心位置,将小鼠从4个入水点面向池壁放入水池中,记录60 s内找到跳台的时间,即为定位航行逃避潜伏期,若超过60 s未能找到跳台,则记录逃避潜伏期为60 s,同时人为将小鼠放在平台上停留休息30 s。(2)空间探索能力检测实验:定位航行实验结束后,移除隐藏在水中的平台,任选一入水点将小鼠放入水池中,记录其60 s内穿越原跳台位置的次数及原跳台所在象限停留时间。实验期间,保持实验室环境安静,水迷宫水池周围光线及物体保持不变,以减少外界环境干扰引起的实验误差。
1.4小鼠脑组织SOD、MDA、GSH-Px及T-AOC水平的检测 水迷宫实验结束后,将小鼠颈椎脱臼处死,用生理盐水进行心脏灌流至肝脏发白,于冰盘上快速取出脑组织,取左侧脑组织约100 mg制成10%匀浆,按照试剂盒说明书检测脑组织匀浆SOD、MDA、GSH-Px及T-AOC水平。
1.5Tunel法测定小鼠海马神经元凋亡 取1.4中小鼠右侧脑组织,于4%多聚甲醛溶液中固定,然后常规脱水、包埋及切片,按照Tunel细胞凋亡检测试剂盒说明书操作步骤观察海马神经元凋亡情况。
1.6RT-PCR法检测海马组织CytC、Caspase-3、Bax及Bcl-2 mRNA表达水平 从1.4中取出的脑组织分离适量海马组织,加入RNA抽提试剂进行总RNA提取,然后根据RT-PCR实验操作步骤进行逆转录和PCR实验。各待测基因引物序列如下,CytC上游引物:5'-TGCCTTCTTCGGAAACTGGG-3', 下游引物:5'-CCGAACAGACCGTGGAGATT-3',产物358 bp;Caspase-3上游引物:5'-TTGCCAGAAGATACCGGTGG-3',下游引物:5'-TCGAATTCCGTTGCCACCTT-3',产物195 bp;Bax上游引物:5'-TCTCCGGCGAATTGGAGATG-3',下游引物:5'-CTCACGGAGGAAGTCCAGTG-3',产物253 bp;Bcl-2上游引物:5'-ATAGCTGTTGCCCACTCGAC-3',下游引物:5'-ATCTATGCCCAACAGGCCAC-3',产物218 bp;β-actin Forward primer:5'-TTACAGGAAGTCCCTCACCC-3', 下游引物:5'-ACACAGAAGCAATGCTGTCAC-3',产物110 bp。将实验所得PCR产物于琼脂糖凝胶上进行电泳,以β-actin基因条带为内参,分析待测基因mRNA相对表达水平。
1.7Western印迹法检测小鼠海马组织CytC、Caspase-3、Bax及Bcl-2蛋白表达水平 从1.4中剥离的脑组织,取适量海马组织,置于匀浆器中,加入1.0 ml RIPA蛋白裂解液,于冰上充分匀浆裂解约30 min,移入1.5 ml EP管中, 4℃ 12 000 r/min离心20 min,取上清用BCA法测定各样本提取物总蛋白浓度并调整一致,然后按照Western印迹步骤依次进行蛋白电泳、转膜、抗原封闭、一抗二抗孵育及电化学发光显色等步骤,以β-actin条带灰度值为内参,分析待测蛋白相对表达值。
1.8统计学分析 采用SPSS19.0软件行方差分析。
2 结 果
2.1SP对AD小鼠定位航行逃避潜伏期的影响 各组随着训练时间的延长,其定位航行逃避潜伏期都有逐渐缩短的趋势(P>0.05)。与阴性对照组比较,第2、3及4天模型组定位航行逃避潜伏期均明显延长(P<0.01)。与模型组比较,SP 600 mg/kg组、阳性药对照组逃避潜伏期于第2、3及4天显著缩短(P<0.05,P<0.01),SP 300 mg/kg组逃避潜伏期于第3及4天显著缩短(P<0.05),但SP 150 mg/kg组虽然逃避潜伏期有所缩短,但无统计学差异(P>0.05)。见表1。
2.2SP对AD小鼠空间探索能力的影响 与阴性对照组比较,模型组穿越原跳台位置次数明显减少,在原跳台所在象限停留时间明显较短(P<0.01);与模型组比较,阳性药对照组、SP 600、300 mg/kg组可明显增加穿越原跳台位置次数和所在象限停留时间(P<0.05,P<0.01)。见表2。

表1 SP对AD小鼠定位航行逃避潜伏期的影响
与阴性对照组比较:1)P<0.01;与模型组比较:2)P<0.05,3)P<0.01;下表同
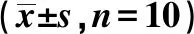
表2 SP对AD小鼠空间探索能力的影响
2.3SP对AD小鼠脑组织SOD、MDA、GSH-Px及T-AOC水平的影响 与阴性对照组比较,模型组脑组织SOD、GSH-Px及T-AOC水平显著降低,MDA含量增多(P<0.01)。与模型组比较,阳性药对照组、SP 600 mg/kg组脑组织SOD、GSH-Px及T-AOC水平升高,MDA含量减少(P<0.05,P<0.01);SP 300 mg/kg组脑组织GSH-Px及T-AOC水平升高,MDA含量减少(P<0.05,P<0.01)。见表3。
表3 SP对AD小鼠脑组织SOD、MDA、GSH-Px及T-AOC水平的影响
2.4SP对AD小鼠海马神经元凋亡的影响 阴性对照组小鼠海马神经元排列整齐,胞膜完整,未见凋亡细胞;模型组海马可见多量散在染色凋亡神经元,细胞核固缩,呈棕褐色浓染;SP 600 mg/kg组海马区可见少量染色凋亡神经元,较模型组明显减少。见图1。
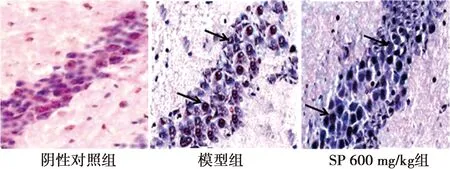
图1 SP对AD小鼠海马神经元凋亡的影响(TUNEL染色,×400,箭头为凋亡细胞)
2.5SP对AD小鼠海马组织CytC、Caspase-3、Bax及Bcl-2 mRNA表达水平的影响 与阴性对照组比较,模型组海马组织CytC、Caspase-3及Bax mRNA表达水平显著上调,Bcl-2 mRNA表达水平显著下调(P<0.01);与模型组比较,SP 600 mg/kg组海马组织CytC、Caspase-3及Bax mRNA表达水平显著下降,Bcl-2 mRNA表达水平显著上调(P<0.01)。见图2,表4。
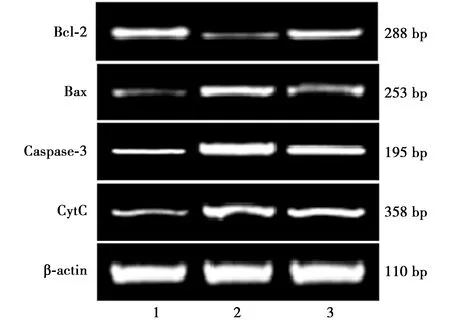
1:阴性对照组 2:模型组 3:SP 600 mg/kg组;下图同图2 SP对AD小鼠海马组织CytC、Caspase-3、Bax及Bcl-2 mRNA表达水平的影响

表4 SP对AD小鼠海马组织CytC、Caspase-3、Bax及Bcl-2 mRNA表达水平的影响
2.6SP对AD小鼠海马组织CytC、Caspase-3、Bax及Bcl-2蛋白表达水平的影响 与阴性对照组比较,模型组海马组织CytC、Caspase-3及Bax蛋白表达水平显著上调,Bcl-2蛋白表达水平显著下调(P<0.01);与模型组比较,SP 600 mg/kg组海马组织CytC、Caspase-3及Bax蛋白表达水平显著下降,Bcl-2蛋白表达水平显著上调(P<0.05,P<0.01)。见表5,图3。

表5 SP对AD小鼠海马组织CytC、Caspase-3、Bax及Bcl-2蛋白表达水平的影响

图3 SP对AD小鼠海马组织CytC、Caspase-3、Bax及Bcl-2蛋白表达水平的影响
3 讨 论
AD是临床上常见的与年龄高度相关的中枢退行性疾病,往往伴有人格和情感的异常,严重影响患者的生活质量〔10〕。研究表明,AD主要是由于Aβ沉积、老年斑(SP)形成等诱发神经细胞氧化损伤、凋亡或死亡〔11,12〕。本研究表明SP对AD小鼠的学习、记忆和认知功能有一定的改善作用。
研究报道,氧化应激反应过强会产生多量的活性氧簇及脂质过氧化产物等,导致神经元胞膜或细胞器受损,从而影响神经元功能甚至诱发神经细胞凋亡或死亡〔13,14〕。氧化应激与凋亡共同参与了AD的发生发展,Aβ在脑组织发生缠结和不可逆沉积形成SP,从而活化氧自由基和炎症因子等,引发过氧化应激和炎症反应,细胞内SOD、GSH-Px等抗氧化酶活性下降,清除自由基及脂质过氧化产物(MDA等)能力降低,神经元线粒体膜通透性增加,大量CytC被释放入胞质中,活化Caspase-3,神经细胞凋亡被启动,促凋亡因子(Bax等)被激活,抗凋亡因子(Bcl-2等)被抑制,最终激活Caspase级联反应导致神经元凋亡,导致神经元功能障碍或死亡,使机体出现学习、认知和记忆等中枢功能退化等临床症状〔15~18〕。本研究结果提示,SP防治AD与其抑制氧化应激及抗细胞凋亡有关。
