血清25(OH)D3缺乏程度与酒精性肝硬化患者病情的相关性分析
2020-04-29肖琴琴朱金朋马晨旭田蕾
肖琴琴,朱金朋,马晨旭,田蕾
锦州医科大学附属第一医院,辽宁锦州121000
随着生活水平的提高和生活方式的改变,全球范围内饮酒人数日益增多,在我国部分地区嗜酒者比例高达42.76%[1]。过量饮酒可引发酒精性肝病(ALD),酒精性肝硬化(ALC)是ALD的终末阶段,全球范围内因肝硬化死亡的人数大于100万,其中死于ALC的人数约49.33万[2]。目前ALC尚无特效治疗药物,尽早诊断并评估病情严重程度对改善患者预后具有重要意义[3]。近年来部分研究显示ALC患者血清25(OH)D3水平降低,且病情越严重的ALC患者血清25(OH)D3水平降低越明显[4],但是关于血清25(OH)D3缺乏程度与ALC患者病情严重程度之间的相关性报道较少。为此,我们进行了如下研究。
1 资料与方法
1.1 临床资料 选择2017年6月~2019年10月锦州医科大学附属第一医院收治的ALC患者60例作为ALC组,患者均符合2010年修订《酒精性肝病诊疗指南》中的ALC诊断标准[5]。排除标准:①合并病毒性及其他类型的肝硬化患者;②合并肝内外胆道感染、恶性肿瘤、慢性肾病、胃肠道手术者;③近期服用维生素D补充剂者。ALC组均为男性,年龄(54.58±8.76)岁,BMI(20.54±2.69)kg/m2;酒精性肝硬化肝脏储备功能量化评估分级标准(Child-Pugh分级)[6]:A级15例,B级19例,C级26例;终末期肝病模型(MELD)评分[7]:<5分22例,5~14分23例,>14分15例;肌酐(Cr)为64.40(53.73,82.58)μmol/L,空腹血糖(GLU)为6.34(5.66,7.91)mmol/L,平均红细胞体积(MCV)为(96.20±16.41)fL。选取同期无肝脏病史、乙醇摄入量限定<140 g/周的健康志愿者60例作为对照组,均为男性,年龄(53.38±8.72)岁,BMI(23.28±3.91)kg/m2,Cr为71.85(61.98,81.05)μmol/L,GLU为5.36(4.77,5.78)mmol/L,MCV为(94.11±7.84)fL。两组年龄、Cr、MCV比较P均>0.05,BMI、GLU比较P均<0.05。本研究通过医院伦理委员会批准,患者及其家属均签署知情同意书。
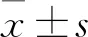
1.2 血清25(OH)D3水平检测 采用ELISA法。两组抽取晨起空腹静脉血,离心后分离血清,采用ELISA法检测血清25(OH)D3水平,严格按照25(OH)D3专用试剂盒(上海罗氏公司)说明书进行操作。参照既往文献[8,9]的方法,将血清25(OH)D3水平分为充足(>30 ng/mL)、不足(20~30 ng/mL)、中度缺乏(10~19 ng/mL)、重度缺乏(<10 ng/mL)。
2 结果
2.1 两组血清25(OH)D3水平比较 ALC组血清25(OH)D3水平为(12.06±7.14)ng/mL,对照组为(28.80±6.04)ng/mL,两组比较P<0.01。ALC组血清25(OH)D3水平充足0例、不足11例(18.3%)、中度缺乏22例(36.7%)、重度缺乏27例(45.0%),对照组分别为29例(48.3%)、24例(40.0%)、7例(11.7%)、0例。秩和检验分析结果显示,ALC组血清25(OH)D3重度缺乏的比例更高(Z=-8.215,P<0.05)。
2.2 ALC患者血清25(OH)D3缺乏程度与肝功能Child-Pugh分级的关系 Child-Pugh A级的ALC患者血清25(OH)D3水平不足7例(46.7%)、中度缺乏5例(33.3%)、重度缺乏3例(20.0%),Child-Pugh B级的ALC患者分别为2例(10.5%)、11例(57.9%)、6例(31.6%),Child-Pugh C级的ALC患者分别为2例(7.7%)、6例(23.1%)、18例(69.2%)。Gamma法分析结果显示,ALC患者肝功能Child-Pugh分级与血清25(OH)D3缺乏程度呈正相关关系(Gamma=0.620,P<0.05)。
2.3 ALC患者血清25(OH)D3缺乏程度与MELD评分的关系 MELD评分<5分的ALC患者血清25(OH)D3水平不足7例(31.8%)、中度缺乏9例(40.9%)、重度缺乏6例(27.3%),MELD评分5~14分的ALC患者分别为3例(13.0%)、11例(47.9%)、9例(39.1%),MELD评分>14分的ALC患者分别为1例(6.7%)、2例(13.3%)、12例(80.0%)。Gamma法分析结果显示,ALC患者MELD评分与血清25(OH)D3缺乏程度呈正相关关系(Gamma=0.547,P<0.05)。
2.4 ALC病变严重的危险因素分析 二元Logistic回归分析在校正年龄、BMI、MCV、Cr及GLU等混杂因素后的结果显示,血清25(OH)D3水平降低是ALC发生的危险因素之一(OR=0.852,95%CI:0.788~0.920,P<0.05),见表1。有序Logistic回归分析在校正BMI、GLU等混杂因素后的结果显示,血清25(OH)D3重度缺乏是ALC病情加重的危险因素(OR=0.16,95%CI:0.04~0.70,P<0.05),见表2。

表1 二元Logistic回归分析结果

表2 有序Logistic回归分析结果
3 讨论
维生素D是一种脂溶性类固醇激素前体,在人体内主要以25(OH)D3形式存在。血清25(OH)D3稳定性高、半衰期长,是能够反映人体内维生素D水平的最佳指标[10]。研究表明,维生素D除了能够促进钙磷吸收及维持骨代谢平衡外,在抑制炎症反应、抑制纤维化和免疫调节中同样具有重要作用[11]。近年来研究发现,维生素D可通过与肝细胞的维生素D受体(VDR)结合,而发挥抗炎、抗纤维化等生物学效应[12]。慢性肝病(尤其是ALC)患者血清25(OH)D3水平明显降低已得到充分证实[8],本研究结果亦显示ALC组血清25(OH)D3水平显著低于对照组,且ALC组患者血清25(OH)D3重度缺乏的比例更高,同时通过二元Logistic回归分析在校正了混杂因素后结果显示,血清25(OH)D3降低是ALC发生的危险因素。与Rafael等[13]的研究结果一致。
维生素D缺乏是ALC病理过程的原因还是结果目前尚不确定。一方面,由于含有维生素D的天然食物很少,导致血清25(OH)D3降低的主要原因是日照不足,血清25(OH)D3降低导致肝脏和肾脏对维生素D的羟基化功能障碍以及血浆维生素D结合蛋白水平下降。与健康人群相比,ALC患者暴露在阳光下的时间更少、营养摄入更差、肝功能更差。因此,维生素D缺乏可能是ALC进展的结果。另一方面,血清25(OH)D3缺乏可能参与ALC病情进展的机制主要包括代谢机制和遗传机制。在代谢机制方面,血清25(OH)D3缺乏一方面加重乙醇诱导肝细胞膜的破坏及还原性谷胱甘肽的消耗[14],从而加速肝细胞变性坏死;另一方面增强了乙醇引起的脂质过氧化反应,以及诱导甘油三酯在肝脏内合成和沉积的诱导效应,使体内产生各种趋化因子、黏附分子,从而加重肝脏的脂肪变性及纤维化。在遗传机制方面,25(OH)D3缺乏一方面可以影响控制机体氧化应激水平的相关基因表达[15],导致肝脏的抗氧化应激能力降低;另一方面VDR基因的多态性可影响VDR与25(OH)D3的结合能力,使其结合能力减弱,肝脏免疫调节能力降低,从而与乙醇产生协同作用,进一步促使肝硬化病情加重。因此,在ALC的病理过程中,血清25(OH)D3水平降低可能既是原因也是后果。
本研究结果显示,血清25(OH)D3缺乏程度与ALC肝功能Child-Pugh分级和MELD评分之间存在显著正相关关系,尤其在Child-Pugh C级及MELD评分>14分的患者中,血清25(OH)D3重度缺乏的比例显著增加;表明ALC患者病情越重,其血清25(OH)D3水平越低。Finkelmeier等[16]研究表明,血清25(OH)D3重度缺乏(<10 ng/mL)是ALC患者1年病死率升高的危险因素。本研究通过有序Logistic回归分析发现,血清25(OH)D3重度缺乏是ALC病情加重的危险因素。Savi等[10]研究发现,ALC患者在补充维生素D后肝功能Child-Pugh分级得到改善。Ulrich等[9]对ALC患者补充维生素D并使血清25(OH)D3水平达到10 ng/mL,结果发现患者的生存率显著高于未补充维生素D的患者。因此,提高ALC患者血清25(OH)D3水平可能是治疗ALC并提高患者生存率的有效方法,但具体补充方案目前尚未明确,需要进一步的基础及临床研究。
综上所述,ALC患者的血清25(OH)D3水平降低,其缺乏程度与患者病情严重程度有关,血清25(OH)D3<10 ng/mL是ALC病情加重的危险因素之一。由于ALC患者的营养状态一直以来是一个容易被忽略的问题,故在ALC的诊治过程中应注意监测血清25(OH)D3水平,并给予适当补充,以期延缓ALC病情进展,从而改善患者预后。
