miR-590-3p对结直肠癌细胞顺铂耐药的影响及其机制
2020-04-29徐明唐澍刘琦黄姝娟
徐明,唐澍,刘琦,黄姝娟
郴州市第一人民医院,湖南郴州423000
结直肠癌(CRC)是全世界发病率最高的癌症,手术切除、化学治疗和放射治疗是其主要治疗手段,但患者5年生存率较低[1,2]。顺铂(DDP)是CRC治疗的常用化疗药物,DDP耐药是导致CRC治疗失败的重要原因[3,4]。miR-590-3p是一种与肿瘤发生相关的新型微小RNA(miRNA),可在不同肿瘤中作为促癌因子或者抑癌因子,参与肿瘤的发生发展[5]。研究表明,miR-590-3p在CRC组织中表达升高,并可促进CRC细胞的增殖和侵袭能力[6]。但是,miR-590-3p是否参与肿瘤细胞DDP耐药目前鲜见报道。2017年3月~2019年8月,本研究观察了miR-590-3p对CRC细胞DDP耐药的影响,并探讨其可能的机制。现报告如下。
1 材料与方法
1.1 材料 细胞:CRC细胞系SW480、SW620、HCT116和正常结肠上皮细胞系NCM460均购自美国ATCC细胞库。主要试剂:胎牛血清(FBS)、胰蛋白酶均购自美国Gibco公司,蛋白裂解液购自北京索莱宝科技有限公司;ULtraRT one step RT-PCR Kit购自北京百奥莱博科技有限公司,蛋白浓度检测试剂盒和上样缓冲液均购自上海碧云天生物技术有限公司,CCK-8试剂购自美国GlpBio公司,Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物技术有限公司;miR-590-3p inhibitor、miR-590-3p mimic、NC质粒、pGLO-LRIG1-野生型(wt)质粒和pGLO-LRIG1-突变型(mut)质粒均购自上海吉玛制药技术有限公司,MDR1、Bax和Bcl-2抗体均购自美国Proteintech公司。miR-590-3p、富含亮氨酸的重复序列和免疫球蛋白样结构域蛋白1(LRIG1)、内参U6和GAPDH引物均由美国Invitrogen有限公司设计合成。
1.2 miR-590-3p高表达细胞筛选 采用实时荧光定量PCR法。将CRC细胞系SW480、SW620、HCT116和正常结肠上皮细胞系NCM460快速复苏,重悬至含有10% FBS的细胞培养基中,在37 ℃、5% CO2的全湿培养箱中进行培养。待细胞融合至95%左右时,进行传代培养。取传代培养的各种细胞,加入TRIzol试剂进行裂解,采用氯仿异丙醇试剂提取的方法提取细胞总RNA,并检测RNA浓度及纯度合格。按照ULtraRT one step RT-PCR Kit试剂盒说明书配制25 μL的反应体系:2×ULtraRT one step Buffer 12.5 μL,上、下游引物各1 μL,ULtraRT one step EnzymeMix 0.5 μL,RNA 1 μL,用无RNA酶的双蒸水补足至25 μL。采用7500PCR仪进行PCR扩增反应,miR-590-3p上游引物5′- AAAGATTCCAAGAAGCTAAGGGTG-3′(24 bp),下游引物5′-CCTAACTGGTTTCCTGTGCCTA-3′(22 bp);内参U6上游引物5′- CTCGCTTCGGCAGCACA-3′(17 bp),下游引物5′-AACGCTTCACGAATTTGCGT-3′(20 bp)。PCR反应条件:95 ℃预变性2 min,94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,共40个循环,72 ℃终延伸5 min。采用2-ΔΔCt法计算miR-590-3p相对表达量。结果显示,CRC细胞系SW480、SW620、HCT116中miR-590-3p相对表达量分别为9.84±0.79、10.62±0.87、3.95±0.26,正常结肠上皮细胞系NCM460为1.00±0.01;3种CRC细胞中miR-590-3p相对表达量均高于NCM460细胞,其中SW620细胞miR-590-3p相对表达量最高(P均<0.05)。选取miR-590-3p表达最高的CRC细胞系SW620用于后续实验。
1.3 DDP耐药的SW620细胞(DDP/SW620细胞)筛选及验证
1.3.1 DDP/SW620细胞筛选 采用持续接触、浓度递增的方法筛选DDP/SW620细胞[7],最终筛选出加入18 μg/mL DDP的培养基中稳定生长的SW620细胞。用含有2 μg/mL DDP的培养基培养该DDP/SW620细胞,并用于后续实验。
1.3.2 DDP/SW620细胞验证 采用CCK-8法。取SW620、DDP/SW620细胞,以1.5×103/孔接种至96孔板,细胞贴壁后分别加入不同浓度的DDP(0、0.156 25、0.312 5、0.625、1.25、2.5、5、10、20、40、80、160 μg/mL),作用48 h。更换含有10 μL CCK-8试剂的培养基100 μL,设置空白对照孔,孵育1 h,检测490 nm波长处的光密度(OD)值。细胞存活率=加药孔OD值/空白对照孔OD值,计算两种细胞的DDP半数抑制浓度(IC50)。
1.4 SW620、DDP/SW620细胞miR-590-3p表达检测 取生长状况良好的SW620、DDP/SW620细胞,参照1.2步骤,采用实时荧光定量PCR法检测miR-590-3p相对表达量。
1.5 miR-590-3p对DDP/SW620细胞DDP耐药的影响观察
1.5.1 细胞分组转染及验证 将DDP/SW620细胞以1.5×103/孔接种至96孔板,随机分为miR-590-3p inhibitor组和NC组。细胞贴壁8 h时,按照脂质体2000说明书分别转染miR-590-3p inhibitor、NC质粒,置于37 ℃、5% CO2的全湿培养箱中培养,12 h更换新鲜培养基。转染6 h,参照1.2步骤,采用实时荧光定量PCR法检测miR-590-3p相对表达量。
1.5.2 细胞DDP耐药观察 两组转染6 h,分别加入不同终浓度的DDP(0、0.156 25、0.312 5、0.625、1.25、2.5、5、10、20、40、80和160 μg/mL),作用48 h。参照1.3.2步骤,采用CCK-8法检测细胞存活率,计算DDP的IC50。
1.6 miR-590-3p对其靶基因的调控作用观察 采用TargetScan7.1软件(http://www.targetscan.org/)预测miR-590-3p的靶基因为LRIG1,LRIG1启动子区与miR-590-3p具有结合位点。①双荧光素酶报告实验:将DDP/SW620细胞以1.5×103/孔接种至96孔板,随机分为四部分,按照脂质体2000说明书分别转染pGLO-LRIG1-wt+NC质粒、pGLO-LRIG1-wt+miR-590-3p mimic质粒、pGLO-LRIG1-mut+NC质粒、pGLO-LRIG1-mut+miR-590-3p mimic质粒。转染48 h,根据双荧光素酶报告基因检测试剂说明书检测细胞荧光素酶活性。②实时荧光定量PCR法:将DDP/SW620细胞以1.5×103/孔接种至96孔板,随机分为两部分,分别转染miR-590-3p mimic质粒和NC质粒。转染48 h,参照1.2步骤,采用实时荧光定量PCR法检测LRIG1 mRNA相对表达量。LRIG1上游引物5′-CTGGACGCGGAGCCTAAAC-3′(19 bp),下游引物5′- TGTAGGTTCGGCAAGTCCTCA-3′(21 bp);内参GAPDH上游引物5′-GGTCTCCTCTGACTTCAACA-3′(20 bp),下游引物5′-GTGAGGGTCTCTCTCTTCCT-3′(20 bp)。
1.7 细胞凋亡率检测 采用流式细胞术。两组转染6 h,加入终浓度为10 μg/mL的DDP,作用48 h。采用Annexin V-FITC/PI染色试剂盒进行细胞染色,染色5~15 min,上流式细胞仪检测细胞凋亡率。
1.8 细胞LRIG1、耐药相关基因MDR1和凋亡相关蛋白Bax、Bcl-2蛋白表达检测 采用Western blotting法。两组转染6 h,加入终浓度为10 μg/mL的DDP,作用48 h。收集细胞,加入细胞裂解液,裂解完全后高速离心获取上清总蛋白。检测蛋白浓度,加入5×上样缓冲液煮沸变性;50 μg蛋白加样进行SDS-PAGE凝胶电泳分离,蛋白电湿转移至PVDF膜上;5%脱脂奶粉封闭,室温孵育PVDF膜1 h。分别加入LRIG1、MDR1、Bax、Bcl-2、内参GAPDH一抗(稀释比例分别为1∶500、1∶1 000、1∶500、1∶1 000、1∶1 000),4 ℃孵育过夜;加入二抗(稀释比例均为1∶8 000),室温孵育1 h。增强型化学发光试剂曝光、显影,采用Image J软件分析条件灰度值。LRIG1、MDR1、Bax、Bcl-2蛋白相对表达量以目的蛋白与内参蛋白条带灰度值的比值表示。
2 结果
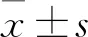
2.1 DDP/SW620细胞验证结果 SW620、DDP/SW620细胞经不同浓度DDP作用后的细胞存活率见图1。SW620、DDP/SW620细胞DDP的IC50分别为(1.28±0.17)、(5.68±0.38)μg/mL,二者比较P<0.05。

图1 SW620、DDP/SW620细胞经不同浓度DDP作用后的细胞存活率(CCK-8法)
2.2 SW620、DDP/SW620细胞miR-590-3p表达比较 SW620、DDP/SW620细胞miR-590-3p相对表达量分别为1.00±0.01、19.54±0.41,二者比较P<0.05。
2.3 两组miR-590-3p相对表达量比较 miR-590-3p inhibitor组和NC组miR-590-3p相对表达量分别为0.33±0.04、1.00±0.00,两组比较P<0.05。
2.4 两组DDP的IC50比较 miR-590-3p inhibitor组和NC组经不同浓度DDP作用后的细胞存活率见图2。miR-590-3p inhibitor组和NC组DDP的IC50分别为(2.46±0.31)、(5.50±0.75)μg/mL,两组比较P<0.05。
2.5 miR-590-3p对LRIG1的靶向调控作用观察结果 ①双荧光素酶报告实验结果:转染pGLO-LRIG1-wt+NC质粒、pGLO-LRIG1-wt+miR-590-3p mimic质粒的DDP/SW620细胞荧光素酶活性分别为1.00±0.01、0.28±0.03,二者比较P<0.01;转染pGLO-LRIG1-mut+NC质粒、pGLO-LRIG1-mut+miR-590-3p mimic质粒的DDP/SW620细胞荧光素酶活性分别为1.00±0.05、0.90±0.20,二者比较P>0.05。②实时荧光定量PCR检测结果:转染miR-590-3p mimic质粒和NC质粒的DDP/SW620细胞LRIG1 mRNA相对表达量分别为0.31±0.04、1.00±0.05,二者比较P<0.05。

图2 两组经不同浓度DDP作用后的细胞存活率(CCK-8法)
2.6 两组细胞凋亡率比较 miR-590-3p inhibitor组和NC组细胞凋亡率分别为14.87%±0.39%、3.28%±0.17%,两组比较P<0.05。见图3。

图3 两组细胞凋亡情况(流式细胞术)
2.7 两组LRIG1、MDR1、Bax、Bcl-2蛋白表达比较 miR-590-3p inhibitor组LRIG1、Bax蛋白相对表达量均高于NC组,MDR1、Bcl-2蛋白相对表达量均低于NC组(P均<0.05)。见表1。

表1 两组LRIG1、MDR1、Bax、Bcl-2蛋白相对表达量比较
注:与NC组比较,*P<0.05,#P<0.01。
3 讨论
CRC早期患者经根治性手术切除后预后相对较好,患者5年生存率为60%左右,但由于CRC早期症状不明显,约20%的患者确诊时伴有转移并处于疾病晚期,从而丧失手术机会;同时,CRC早期患者在根治性手术治疗后5年内复发率为30%左右,目前对于转移和复发的患者主要采取化疗,但患者多存在化疗耐药,导致转移和复发患者5年生存率仅为14.2%[2]。miRNA是一类长18~22个核苷酸的非编码小RNA,大量研究已经证实miRNA在肿瘤发生发展过程中发挥重要作用,同时参与肿瘤细胞增殖、侵袭、转移和耐药等生物学行为,是抗肿瘤治疗的相关靶点[5]。研究报告,miR-590-3p在卵巢癌和胃癌等肿瘤中具有促进肿瘤恶性进展的作用[8,9]。而miR-590-3p在乳腺癌和骨肉瘤等肿瘤组织中呈低表达,具有抑制肿瘤细胞增殖、侵袭和转移的作用[10,11]。因此,miR-590-3p在不同肿瘤发生过程中发挥不同的生物学功能。Feng等[6]报道,miR-590-3p在CRC细胞和组织中表达上调,并可促进细胞增殖和球体形成。Sun等[12]发现,miR-590-3p在CRC组织中表达升高,并与患者TNM分期、远处转移和总体生存率低有关,过表达miR-590-3p可促进CRC细胞的增殖、侵袭和迁移。
目前,关于miR-590-3p是否参与肿瘤细胞耐药的研究比较少。文献报道,miR-590-3p与神经胶质瘤和胆囊癌细胞的放射抗性相关[13,14]。芯片数据库显示,miR-590-3p可能是影响CRC患者放化疗敏感性的miRNA之一[15]。但是,关于miR-590-3p是否参与CRC细胞DDP化疗耐药鲜见报道。本研究结果显示,CRC细胞系SW480、SW620、HCT116中miR-590-3p相对表达量均高于正常结肠上皮细胞系NCM460,表明CRC细胞中miR-590-3p表达升高。本研究中SW620细胞miR-590-3p相对表达量最高,因此选择该细胞建立DDP耐药细胞株;结果显示,DDP/SW620细胞中miR-590-3p相对表达量及DDP的IC50均高于SW620细胞,而沉默miR-590-3p表达后DDP/SW620细胞DDP的IC50降低,表明miR-590-3p可促进CRC细胞发生DDP耐药。
miRNA可通过与靶信使RNA(mRNA)的3′UTR互补结合,选择性靶向mRNA而调节基因表达[5]。LRIG1是一种跨膜蛋白,可拮抗上皮组织中的表皮生长因子受体信号传导,属于抑癌基因[16]。研究报道,LRIG1参与CRC细胞西妥昔单抗(CTX)耐药,其在CTX抗性CRC细胞中表达升高,在CTX治疗敏感患者中LRIG1表达与CRC病情严重程度呈负相关关系[17]。在人神经胶质瘤细胞中,miR-590-3p可通过靶向LRIG1基因,促进细胞的放射抗性[13]。本研究采用TargetScan7.2预测软件和双荧光素酶报告实验均证实在CRC细胞中LRIG1是miR-590-3p的靶基因。本研究结果显示,抑制miR-590-3p表达后DDP/SW620细胞LRIG1蛋白表达升高;这提示miR-590-3p可能通过靶向LRIG1参与CRC细胞发生DDP耐药,但是其具体的分子机制仍需深入研究。
化疗药物促进肿瘤细胞凋亡是抗肿瘤治疗的重要机制之一[18]。肿瘤细胞耐药的主要机制与跨膜蛋白的过表达密切相关,这些蛋白质可以直接降低细胞内化疗药物的浓度。MDR1也称为P-糖蛋白,是第一个被确认为人类哺乳动物ABC转运蛋白的蛋白,其高表达可促进肿瘤的多药耐药[19]。Bcl-2是重要的抗凋亡相关蛋白,是Bcl-2家族中最重要的基因,其通过降低凋亡蛋白酶激活而促进细胞存活。同时Bcl-2可被促凋亡蛋白Bax调控,放化疗主要是通过调节Bcl-2、Bax表达,促进肿瘤细胞凋亡,从而发挥抗肿瘤作用[20]。本研究发现,miR-590-3p inhibitor组细胞凋亡率、Bax蛋白表达均高于NC组,MDR1、Bcl-2蛋白表达均低于NC组,表明干扰miR-590-3p表达可促进细胞凋亡、降低耐药相关基因MDR1及抗凋亡蛋白Bcl-2表达。
综上所述,miR-590-3p可促进CRC细胞发生DDP耐药,其机制可能与负性调控LRIG1进而促进MDR1表达及减少细胞凋亡有关。
