双酶法提取甜瓜籽多肽的工艺研究
2020-04-28王思琪傅晶依丁修庆刘佳鑫赵珺
王思琪,傅晶依,丁修庆,刘佳鑫,赵珺
(长春大学食品科学与工程学院,吉林 长春 130022)
甜瓜因其味甘,性寒,具有清热解暑,除湿止渴、利尿的功效,在我国广受消费者喜爱,产量巨大。甜瓜籽即甜瓜的种子,据研究表明[1],甜瓜籽中含有37.12%脂肪、24.08%蛋白质、24.50%糖类,0.01%维生素E 和一定量的矿物质,特别是钾、镁、磷[2]。但目前对甜瓜籽的利用极少,在一定程度上存在着浪费。研究发现,甜瓜籽蛋白质中多肽含量较高,氨基酸种类齐全,其中,赖氨酸的含量最高,含硫氨基酸次之,且通过酶水解可以有效改善蛋白的功能性质[7],而目前国内外对甜瓜籽多肽的研究较少。
多肽是通过动植物蛋白酸解、酶解或微生物发酵获得的生物活性多肽,是由氨基酸组成的小分子物质[3-4]。研究表明,多肽具有抗氧化、抗病毒、降血压、免疫调节等众多生理活性。此外,多肽还有易溶于水、易吸收、无毒副作用等特点[5-6],近年来,受到了国内外研究者的广泛关注。
本研究采用双酶协同酶解法从甜瓜籽中提取多肽,并进行条件优化,为甜瓜籽的高效利用及其高值化产品的开发提供理论参考。
1 材料和方法
1.1 材料与试剂
甜瓜籽:天一种业提供;NaOH、HCl、甲醛:国药集团化学试剂有限公司。碱性蛋白酶(8 U/g)、胰蛋白酶(2.5 U/g):上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
数显水浴锅(HH-S2)、电子天平(PL203):金坛市天竟实验仪器厂;台式高速离心机(H-2050R-1)、pH计(PHS-25):长沙高新技术产业有限公司;精密定时电动搅拌器(JJ-1):金坛市荣华仪器制造有限公司。
1.3 试验方法
1.3.1 脱脂甜瓜籽粉的制备
将500 g 甜瓜籽干燥至恒重后粉碎为粉末,用正己烷浸泡24 h 脱脂,将脱脂甜瓜籽粉末于50 ℃烘干,然后过80 目筛,得到脱脂甜瓜籽粉,存于室内阴凉干燥处备用[1]。
1.3.2 双酶法制备甜瓜籽多肽
取脱脂甜瓜籽粉加入蒸馏水,在90℃下变性10min,冷却至25 ℃后同时加入胰蛋白酶和碱性蛋白酶进行酶解,期间设定底物浓度、加酶量、酶的质量比、酶解温度、酶解pH 值、酶解时间。酶解结束后在90 ℃高温下灭酶10 min,最后5 000 r/min 离心20 min,获得多肽水解液。
1.3.3 单因素试验
影响水解度的因素有很多[8],本试验着重研究底物浓度、加酶量、酶的质量比、酶解温度、酶解pH 值、酶解时间等条件下对水解度的影响。单因素试验因素和水平如表1 所示。

表1 单因素试验因素和水平Table 1 Factors and levels in the single factor design
1.3.4 响应面分析试验
在单因素试验的基础上,得出pH 值、温度、加酶量这3 种因素对水解度的影响显著,因此利用Design-Expert8.5 软件进行响应面优化设计,以水解度为响应值,以pH 值、温度、加酶量为因变量,设计三因素三水平响应面分析试验,试验因素和水平如表2 所示。
1.3.5 水解度的测定
取多肽水解上清液8.0 mL,置于烧杯中,加入60 mL 蒸馏水,加氢氧化钠调节pH 值至8.2,再加入10 mL 中性甲醛溶液(pH 值为 8.1),用 0.1 mol/L 的NaOH 溶液滴定至pH 值为9.2,记录消耗NaOH 溶液的体积V(mL)。同时取未酶解的相同浓度甜瓜籽肽液8.0mL,按上述方法做空白试验,记录所消耗的NaOH溶液体积V0(mL)。水解度计算公式如下:
DH/%=C×(V-V0)×0.014/N×100
式中:C 为 NaOH 溶液浓度,mol/L;V 为酶解液消耗 NaOH 溶液体积,mL;V0为未酶解液消耗 NaOH 溶液体积,mL;0.014 为氮毫克适当量;N 为底物样品中总氮含量[9]。
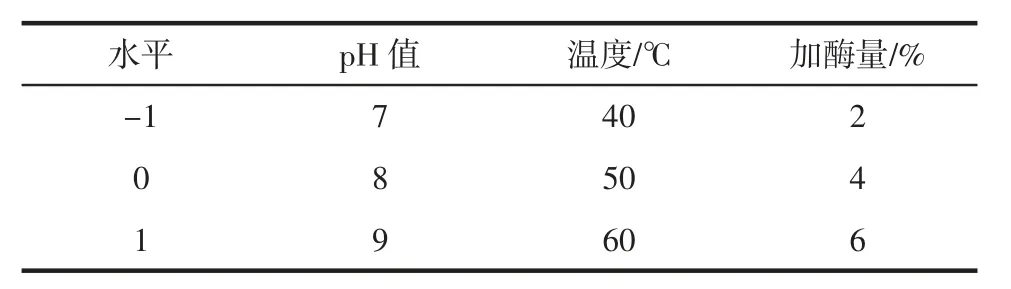
表2 响应面试验因素及水平Table 2 Factors and levels in the response surface design
2 结果与讨论
2.1 单因素试验结果
2.1.1 底物浓度对水解度的影响
底物浓度对水解度的影响见图1。

图1 底物浓度对水解度的影响Fig.1 Effect of substrate concentration on the degree of hydrolysis
由图1 可知,在加酶量为3 %、酶解时间为150 min、酶解温度为 50 ℃、酶解 pH 值为 7.5,酶比为5∶5(质量比)时。随着底物浓度由2%逐渐增大到3%时,水解度逐渐增高,达到最大值10.94%,随着底物浓度的继续增加,水解度呈下降趋势,这是因为高浓度的底物对反应速率起着抑制作用[10]。底物浓度过高时,高浓度蛋白质分散在体系中,束缚了体系中水的流动性,限制了酶分子扩散,从而减小了酶与底物接触的可能性,导致反应的水解度下降,而当底物浓度过低时,会减少蛋白酶和底物的碰撞机率[11],使水解反应受到抑制,因此,最佳的底物浓度为3%。
2.1.2 加酶量对水解度的影响
加酶量对水解度的影响见图2。

图2 加酶量对水解度的影响Fig.2 Effect of enzyme amount on the degree of hydrolysis
由图2 可知,在底物浓度为3%、酶解温度为50 ℃、酶解时间为150 min、酶解pH 值为7.5,酶比为5∶5(质量比)时。随着加酶量由2%增加到4%时,水解度达到了最大值11.45%,当加酶量大于4%时,水解度降低呈平稳趋势。这是因为当酶与底物作用位点达到了一个饱和点[12],增加酶的用量使底物浓度降低,减少酶与底物结合的机会,所以,继续添加酶对于水解度的影响不大。从酶解效果及成本的角度综合考虑,4%为最佳加酶量。
2.1.3 酶解时间对水解度的影响
酶解时间对水解度的影响见图3。

图3 酶解时间对水解度的影响Fig.3 Effect of enzymatic hydrolysis time on the degree of hydrolysis
由图3 可知,在底物浓度为3%、加酶量为4%、酶解温度为 50 ℃、酶解 pH 值为 7.5,酶比为 5∶5(质量比)时。反应时间由60 min 延长到180 min,水解度不断升高,180 min 时达到最大值12.24%,但当反应时间继续延长后,水解度呈下降趋势。这是因为大分子的蛋白质在复合酶的作用下,首先水解成多肽[13],但是随着时间延长,更多肽链进一步被水解为游离氨基酸,导致多肽含量下降,多肽水解度趋于下降[14]。综合考虑,180 min为最佳的酶解时间。
2.1.4 酶解温度对水解度的影响
酶解温度对水解度的影响见图4。

图4 酶解温度对水解度的影响Fig.4 Effect of hydrolysis temperature on the degree of hydrolysis
由图4 可以看出,在底物浓度为3 %、加酶量为4 %、酶解时间为180 min、酶解pH 值为7.5、酶比为5∶5(质量比)时。当温度由 40 ℃升至 50 ℃时,水解度达到最高值12.68%。当温度持续升高时,水解度开始降低。这是因为温度过高,酶失去了活性,酶解效果下降,导致水解度降低[15]。因此确定50 ℃为最佳的酶解温度。
2.1.5 酶解pH 值对水解度的影响
酶解pH 值对水解度的影响见图5。

图5 酶解pH 值对水解度的影响Fig.5 Effect of pH on the degree of hydrolysis
由图5 可以看出,在底物浓度为3 %、加酶量为4 %、酶解时间为180 min、酶解温度为50 ℃、酶比为5∶5(质量比)时。随着体系 pH 值由 7.0 增大至 8.0,水解度达到最大值13.40%。随着pH 值持续增加,水解度呈下降趋势。原因是继续增大pH 值会使溶液呈碱性,导致酶失活[16],酶解速率下降,因此制备的最佳pH值为8。
2.1.6 酶的质量比对水解度的影响
酶的质量比对水解度的影响见图6。
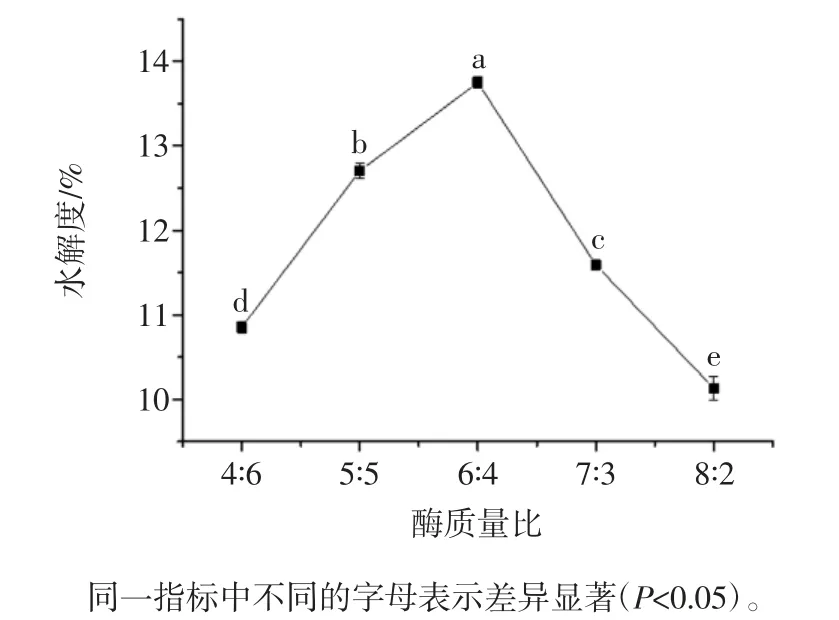
图6 酶的质量比对水解度的影响Fig.6 Effect of enzyme mass ratio on the degree of hydrolysis
由图6 可以看出,在底物浓度为3 %、加酶量为4 %、酶解时间为180 min、酶解温度为50 ℃、酶解pH值为8 时。随着胰蛋白酶用量逐渐增大时,水解度也随之增大,当胰蛋白酶和碱性蛋白酶的质量比为6∶4时,水解度为13.78%,达到最大值。当胰蛋白酶用量持续增大时,水解度开始下降,这是因为蛋白酶对所作用的反应底物有严格的选择性,一种蛋白酶仅能作用于蛋白质分子中特定的肽键,而不能作用于所有的肽键,继续增加胰蛋白酶的量不会对水解度产生影响。因此,最适的胰蛋白酶和碱性蛋白酶质量比为6∶4。
2.2 响应面优化设计试验结果
利用Design-Expert 8.5 软件的中心组合设计[17],以pH 值、温度和加酶量为响应变量,水解度为响应值进行响应面试验,结果如表3 所示,对表3 数据进行多元二次回归拟合,建立提取工艺参数回归模型。回归方程为:
Y=14.07+0.628 1A+0.355 7B+0.913 2C-0.181 2AB-0.343 7AC-0.431 2BC-0.747 6A2-0.938 5B2-0.793 5C
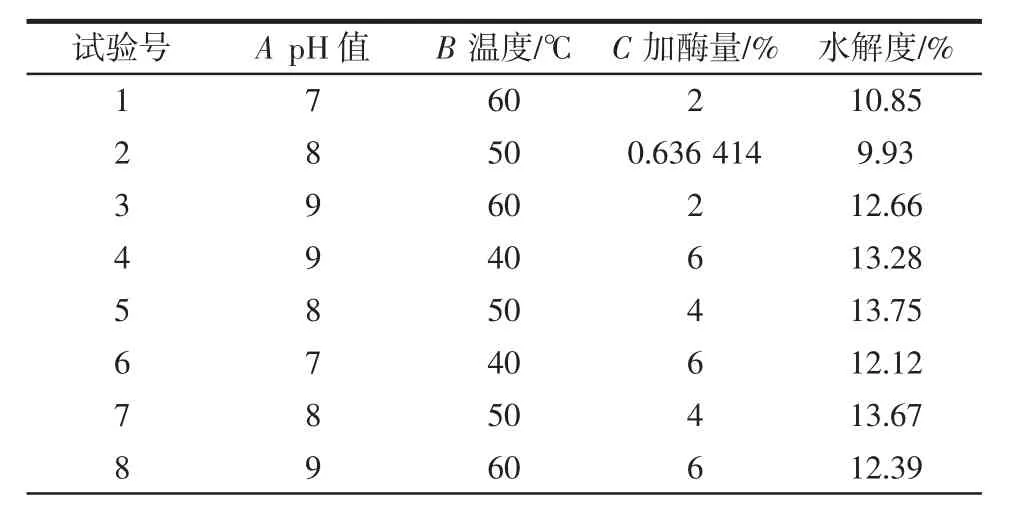
表3 中心组合试验设计与结果Table 3 Center combined design and experimental results
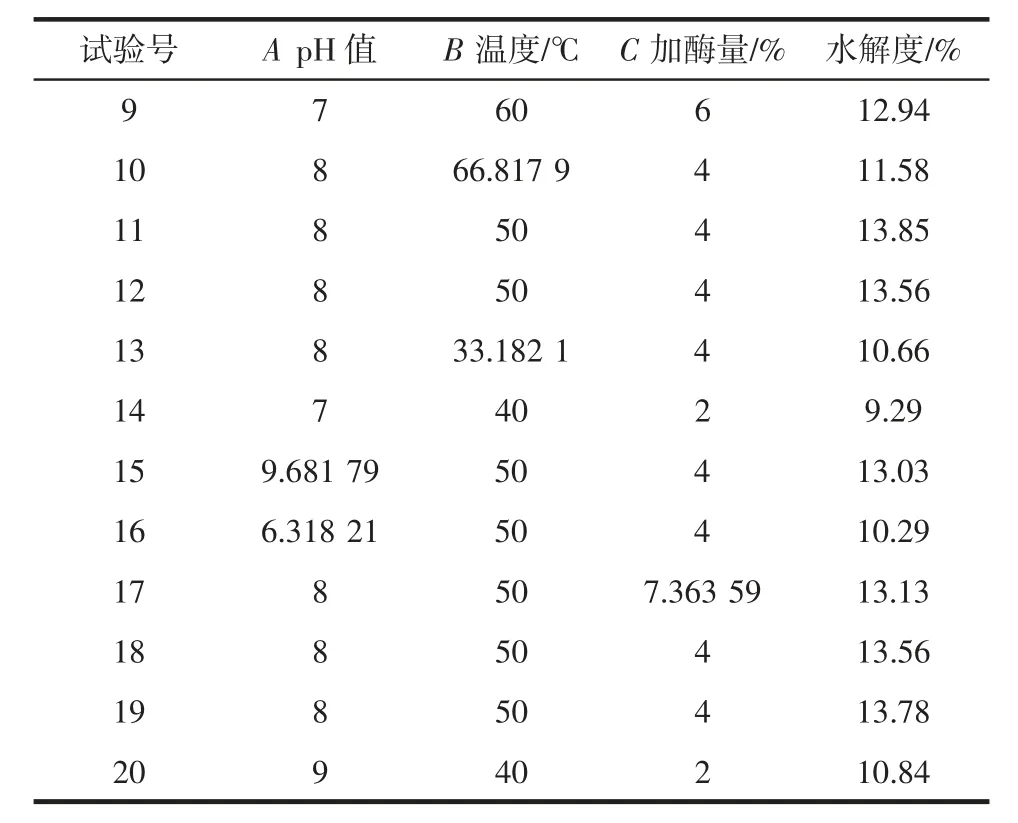
续表3 中心组合试验设计与结果Continue table 3 Center combined design and experimental results
优化后方差分析表见表4。
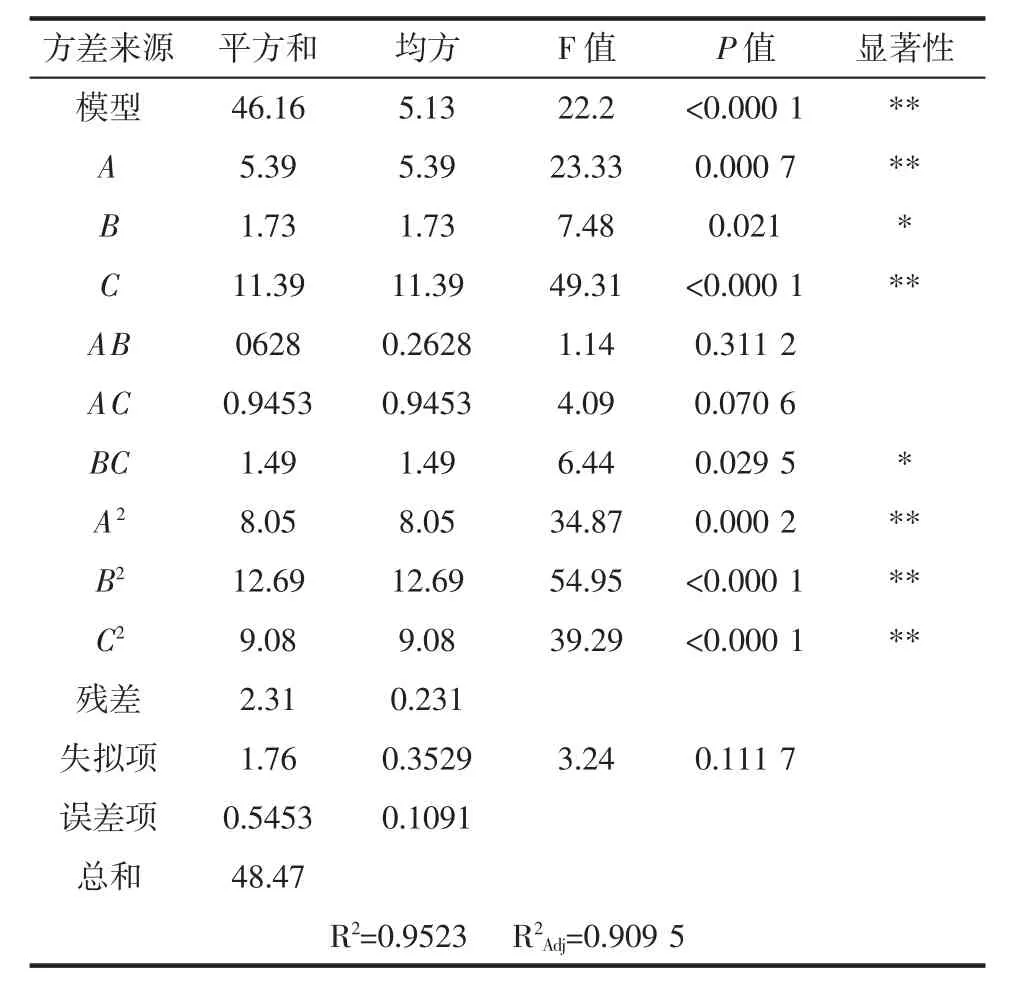
表4 优化后方差分析表Table 4 Variance analysis after optimization
由表4 可知,二次回归模型的F 值为22.2,P<0.000 1,表明模型达到了极显著水平;失拟项P =0.111 7>0.05,说明失拟项差异不显著,试验无失拟因素存在,能充分反映实际情况,回归模型是适合的;通过对模型的可信度进行分析,决定系数R2为0.952 3,说明方程拟合度良好。试验模型的校正系数为R2Adj为0.909 5,试验结果有90.95%受试验结果的影响,因此此结果可靠。根据方差分析表中的F 值可得,影响水解度因素的主次顺序为加酶量>pH 值>温度,即加酶量对水解度的影响最大,pH 值次之,最后是温度。由回归方程和方差分析还可知,模型中一次项pH 值、加酶量对水解度的影响达到极显著水平(P<0.01);模型中交互项温度和加酶量对水解度的影响达到显著水平(P<0.05);模型中二次项 A2、B2、C2对水解度的影响达到极显著水平(P<0.01)。
水解度的等高线图与响应面3D 图谱见图7~图9。
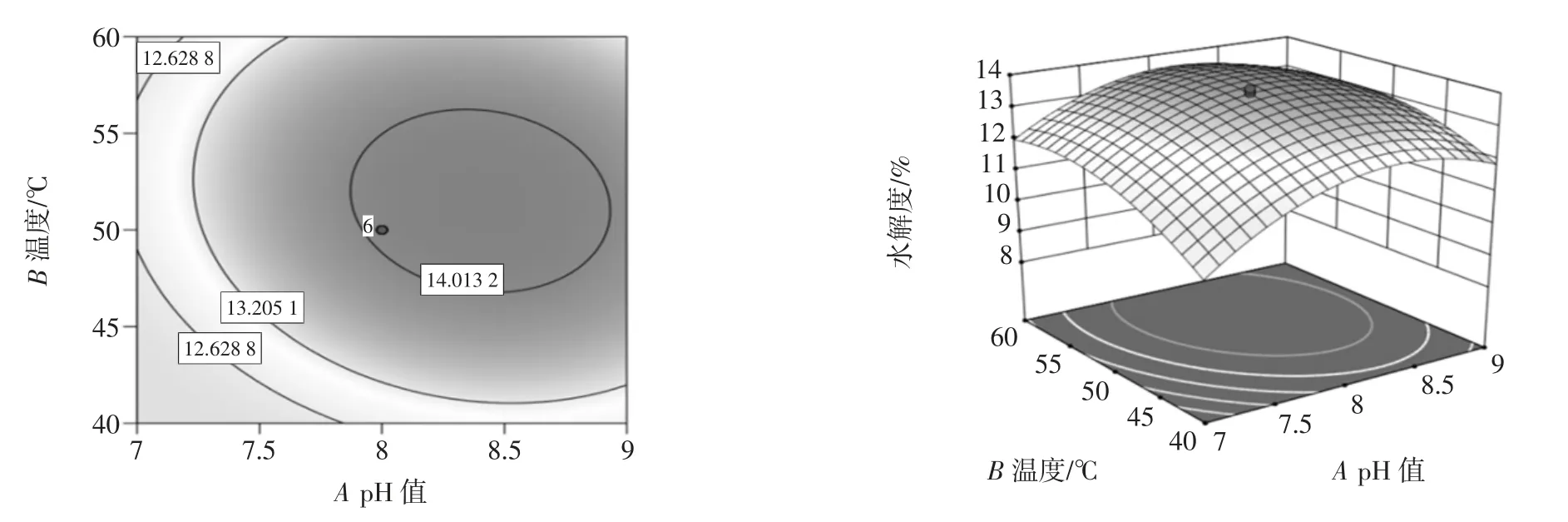
图7 温度和pH 值对水解度影响的等高线图和响应面图Fig.7 Contour diagram and response surface diagram of the influence of temperature and pH on the degree of hydrolysis

图8 加酶量和pH 值对水解度影响的等高线图和响应面图Fig.8 Contour diagram and response surface diagram of the influence of enzyme amount and pH on the degree of hydrolysis
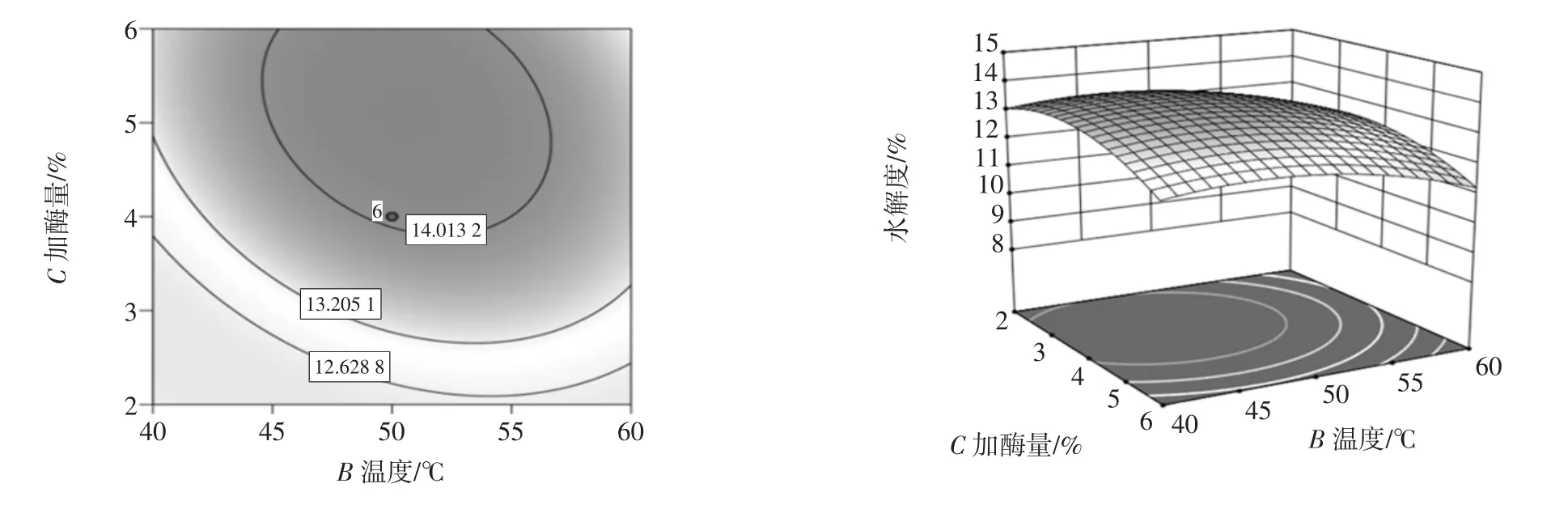
图9 加酶量和温度对水解度影响的等高线图和响应面图Fig.9 Contour diagram and response surface diagram of the influence of enzyme amount and temperature on the degree of hydrolysis
响应面坡度越陡峭,说明试验条件的改变对响应值越显著[18-19],该因素对水解度的影响越大;反之,则表明因素对水解度的影响越小[20-21]。由图可知温度与加酶量的交互作用对水解度的影响较大,其次为pH值和加酶量的交互作用,而pH 值与温度的交互作用最不显著。
优化所得的最佳工艺为:pH 值为8、酶解温度为50 ℃、加酶量为4%,在此条件下的预测值为13.77%。
2.3 验证试验
为验证响应面法所得结果的可靠性,对模型优化的工艺条件进行验证。在pH 值为8、酶解温度为50 ℃、加酶量为4%的条件下进行3 次试验。因为试验可能存在着误差,得到的平均水解度为13.85%,与预测值相差极小。因此说明此模型能较好的预测水解度,此优化工艺条件可靠。
3 结论
以甜瓜籽为原料,探究从甜瓜籽中提取多肽的最佳工艺研究,分别研究了底物浓度、加酶量、酶解时间、酶解温度、pH 值、双酶质量比对水解度的影响。通过单因素和响应面优化设计试验,得到了在底物浓度为3%、加酶量为4%、酶解时间为180 min、酶解温度为50 ℃、pH 值为 8、双酶质量比为 6∶4 的工艺条件下,水解度达到最大值13.85%。此试验为甜瓜籽的开发利用提供了理论基础,为企业创造社会经济效益提供了途径,具有广阔的开发利用前景。
