SP110基因过表达慢病毒载体的构建与包装
2020-04-27贾鹏霞刘丙雨李新月张万江吴江东马雅静
贾鹏霞,刘丙雨,李新月,张万江,程 江,吴江东,马雅静
结核病是由结核分支杆菌(mycobacterium tuberculosis,MTB)感染引起的慢性传染性疾病,目前仍是危害人类健康的重要疾病之一,研究结核病的发生发展显得尤为重要。2005年,有学者通过动物实验发现了一种能调节结核病先天免疫力的新基因—细胞内病原体抗性基因1(intracelluar pathogen resistance1,Ipr1)[1]。而在人体中与Ipr1蛋白最接近的同源蛋白就是核体蛋白SP110b,故研究者们提出SP110基因可能是与人体结核病易患性相关的一个新候选基因。随着分子生物学技术的不断进步,目前调整基因表达水平的手段逐渐成熟。利用慢病毒载体导入外源性基因的方法因具有转染效率高且能稳定表达等优点备受学者青睐。本研究通过合成SP110基因片段并通过PCR法进行链接获得SP110全长序列,经测序验证成功后与穿梭质粒LV5构成重组质粒,再与包装质粒(pGag/Pol、pRev、pVSV-G)重组形成稳转系统,共转染293T细胞,包装产生慢病毒,为进一步探讨SP110基因在结核病发生发展中的作用提供工具。
1 材料与方法
1.1 材料
1.1.1 主要材料 293T细胞株由本实验室保存;dsDNA oligo由上海吉玛公司合成;慢病毒穿梭质粒LV5和包装质粒pGag/Pol、pRev、pVSV-G购于上海吉玛制药技术有限公司;限制性内切酶Not I和Nsi I(日本TaKaRa公司);大肠杆菌感受态DH5α由本实验室制作;DNA连接酶(美国NEB公司);96孔板(天根生化科技有限公司)。
1.1.2 实验试剂 RNAi-Mate(上海吉玛制药技术有限公司)、DMEM培养基(天根生化科技有限公司);双抗(青霉素/链霉素原液)购自天津市灏洋生物制品科技有限责任公司;E.Z.N.A.胶回收试剂盒和E.Z.N.A.TM质粒提取试剂盒(美国Omega公司)。
1.2 实验方法
1.2.1 THP-1细胞培养 人单核巨噬细胞THP-1用含10%胎牛血清、青霉素/链霉素(100 U/mL)的RPMI 1640培养基,置于37 ℃、5%CO2孵箱培养,根据细胞的生长情况进行传代,当培养至对数期时收集细胞用于后续实验。运用Trizol法提取THP-1细胞中的总RNA,在ThermoNanodrop浓度分析仪上测定总RNA浓度,然后利用cDNA合成试剂盒,逆转录合成cDNA,-20 ℃储存备用。
1.2.2 SP110基因获取 美国国家生物技术信息中心NCBI数据库获得人源性SP110基因全长编码序列,根据Gen Bank设计目的基因引物SP110-Not I-F:5′-AGGGTTCCAAGCTTAAGCGGCCGCGCCACCATGTTCACCATGACAAGAGCCATG;SP110-Nsi I-R:5′-GATCCATCCCTAGGTAGATGCATTCACTTGCTATTTAACTCTCTCTTGAGATTTATTCTTGGA(上海吉玛制药技术有限公司合成),目的基因上下游引物分别加上LV5载体上Not I和Nsi I两侧同源序列,用于载体的亚克隆。用1.2.1中已合成的cDNA为模板经过PCR扩增(PCR循环参数:95 ℃ 30 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,72 ℃ 5 min)反应完成后,利用Agarose电泳并切胶回收Homo SP110基因片段。
1.2.3 V-SP110重组质粒构建扩增和鉴定 使用限制性内切酶NotⅠ和NsiⅠ线性化LV5载体(37 ℃酶切2 h),电泳,用DNA凝胶回收试剂盒回收载体LV5,利用ClonExpress®Entry One Step Cloning Kit,将扩增好的片段,重组克隆到线性化的LV5载体中,轻轻混匀各组分,置于37 ℃反应30 min,反应完成后立即将反应管置于冰水浴中,冷却5 min。连接后的重组质粒转化大肠杆菌感受态细胞DH5α,经含有氨苄青霉素抗性的LB琼脂培养基筛选后,挑取单克隆并扩大培养以进行质粒酶切鉴定,DNA测序鉴定获取重组质粒V-SP110。
1.2.4 重组慢病毒及阴性对照慢病毒的包装和浓缩 转染前1 d将生长状态良好的293T细胞用胰酶消化重悬接种于15 cm细胞培养皿中,加入18 mL含10% FBS的DMEM培养液,混匀后37 ℃ 5% CO2培养过夜,待细胞密度达到60%时,将重组慢病毒质粒V-SP110和pGag/Pol、pRev、pVSV-G混匀再加入300 μL RNAi-Mate,混匀,室温放置20~25 min;除去15 cm培养皿中的培养液,加入8 mL无血清的DMEM培养液;将转染混合物逐滴加入15 cm培养皿中,轻轻地前后摇晃培养皿以混匀复合物,在37 ℃ 5% CO2培养箱中温育4~6 h;吸弃转染液,加入18 mL含10% FBS的DMEM培养液。继续培养72 h后将培养皿中细胞上清液吸到50 mL离心管中,4 ℃,4 000 r/min,4 min低速离心后,将离心管上清液倒入50 mL注射器内用0.45 μm过滤器过滤;滤液在离心机中进行超速离心,4 ℃,20 000 r/min,2 h后收集浓缩液-80 ℃冻存。重组慢病毒命名为LV5-SP110,用上述相同方法将LV5与pGag/Pol、pRev、pVSV-G经RNAi-Mate共转染到293T细胞,并包装成能表达GFP的慢病毒颗粒,命名为:LV5-NC作为阴性对照。
1.2.5 病毒滴度测定 293T细胞在10 cm培养皿中培养至80%~90%融合时,弃去培养液,用3 mL D-Hank’s solution洗涤细胞2次;加1 mL Trypsin-EDTA solution,混匀后,小心吸去胰酶溶液,37 ℃放置3~5 min;再加入2 mL含10% FBS的DMEM培养液,吹打使细胞形成单细胞悬液;按3×104/孔的浓度接种96孔板,混匀后于37 ℃ 5% CO2培养24 h;将慢病毒原液10 μL,用10% FBS的DMEM培液10倍稀释3~5个梯度(加入终浓度为5 μg/mL的Polybrene);吸去96孔板中的培养液,每孔加入100 μL稀释的病毒液,同时设立空白对照组,于37 ℃ 5% CO2培养24 h;吸弃96孔板中的稀释病毒液,每孔加入100 μL 10% FBS的DMEM培液,于37 ℃ 5% CO2继续培养72 h;通过荧光显微镜或FACS计数荧光细胞,结合稀释倍数计算病毒滴度。
2 结果
2.1 PCR扩增SP110序列测序 经PCR扩增SP110序列测序目的基因序列全长1 650 bp,测序结果所示片段为95~1 744 bp,经过DNASTAR软件比对证明扩增片段与目的基因序列一致(图1)。
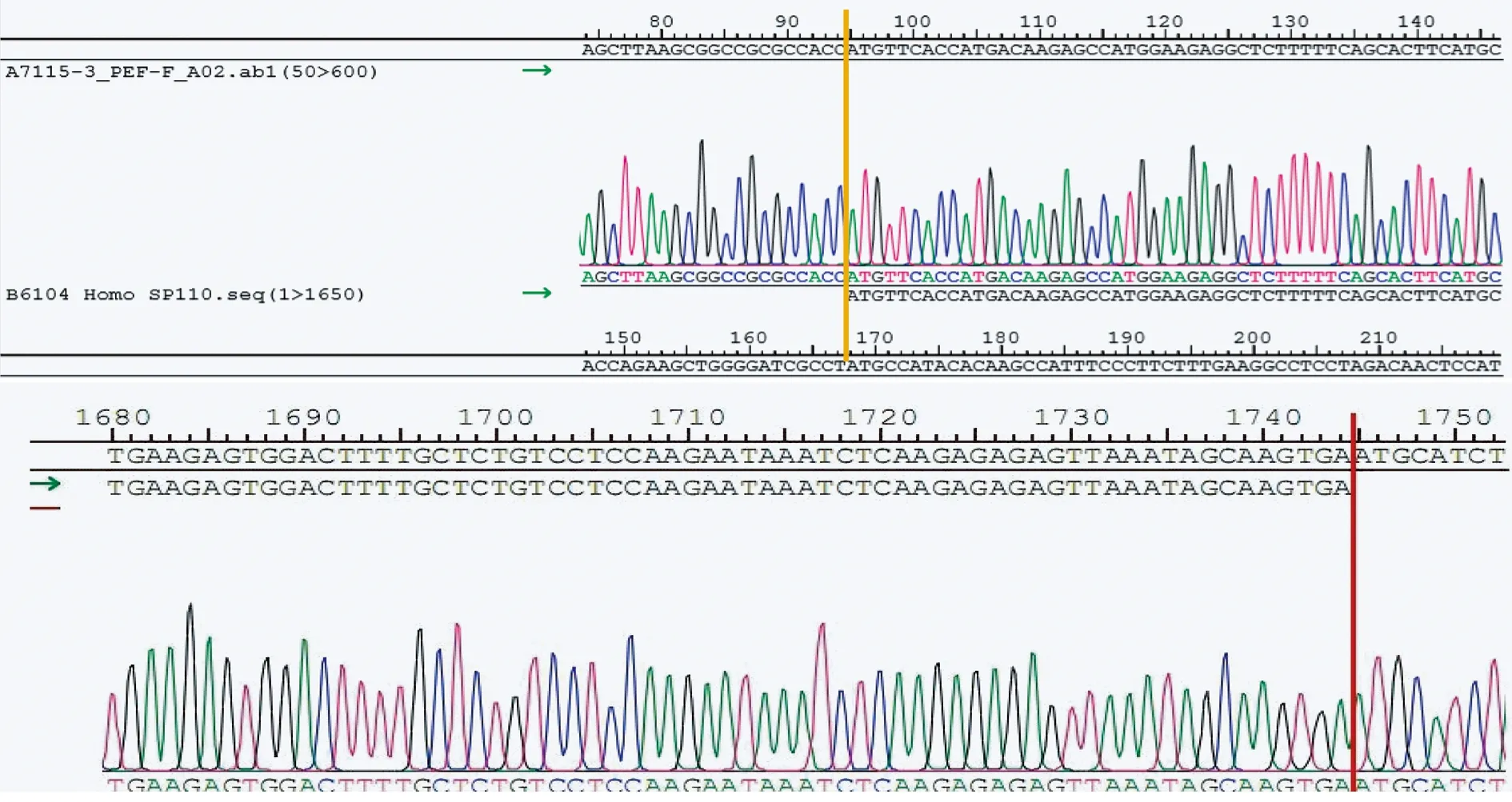
黄色截取部分为正测序结果,红色部分为反测序结果图1 SP110基因测序结果
2.2 重组质粒LV5-SP110的鉴定 将PCR产物与经NotⅠ和NsiⅠ内切酶线性化的LV5载体连接、转化感受态细胞DH5α,提取质粒酶切鉴定,酶切后产生了如图2所示约1 650 bp的片段,片段大小与SP110基因cDNA大小一致。本研究所用慢病毒载体质粒LV5(EF-1aF/GFP&puro)图谱如图3所示。
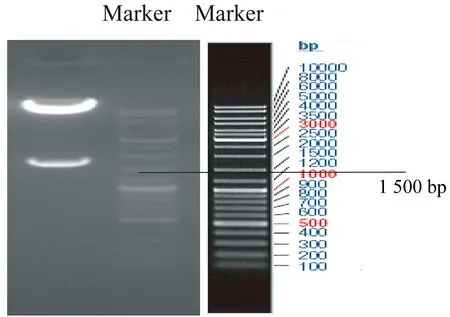
图2 Not I和Nsi I双酶切鉴定结果
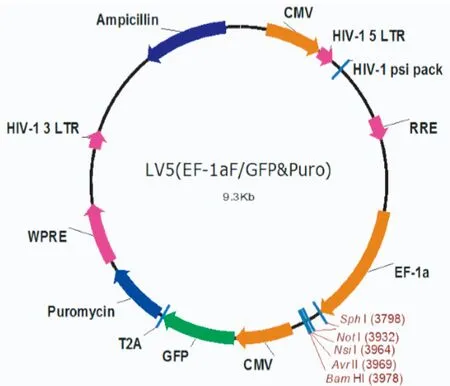
图3 LV5(EF-1aF/GFP&puro)的图谱
2.3 测序鉴定重组质粒LV5-SP110 酶切鉴定正确的质粒取10 μL送上海生工基因测序。测序结果与预期SP110基因序列完全一致,测序证实获取重组质粒V-SP110。结合上述图1,图2结果证明成功构建慢病毒载体。
2.4 经293T细胞包装后慢病毒滴度测定结果 病毒滴度釆用逐孔稀释法检测,利用1、0.1和0.01 μL的慢病毒悬液分别感染293T细胞(3×104/孔),72 h后观察细胞荧光情况(图4)。其中GFP阳性细胞比率为33.3%。经计算,慢病毒滴度为104×33.3%/(0.01×10-3mL)=1.0×108TU/mL。慢病毒滴度为1.0×108TU/mL。

A:重组慢病毒LV5-Homo SP110

B:阴性对照慢病毒LV5-NC图4 慢病毒在不同稀释浓度下感染293T细胞的结果
3 讨 论
结核病是由MTB感染引起的人畜共患慢性传染病,MTB感染者约占世界人口的1/3,其中10%最终发展为结核病患者,结核病是单一致病菌致死率最高的疾病,而我国是结核病的高发国家,大量研究已证实结核病的发生、发展与宿主遗传因素和环境因素密切相关。MTB在人体内以细胞免疫为主,巨噬细胞是MTB主要的宿主细胞和效应细胞,其活性和功能对MTB的免疫应答和感染后的转归至关重要。Kramnik等[2]以抗结核的小鼠和结核易感的小鼠为模型研究遗传因素与MTB易感性的关系,结果在小鼠1号染色体上鉴定出一个对结核有重要影响的基因座并将其命名为结核超易感基因座1(super susceptibility to tubercu losis 1,sst1)。随后Pan等[1]用同源导入的方法将上述2种品系小鼠的sst1序列区域进行置换得到转基因小鼠发现结核易感小鼠对结核病有了抵抗力。这些转基因小鼠感染MTB后,肺损伤显著降低,存活时间也明显长于对照组小鼠。且转基因小鼠巨噬细胞不仅能限制MTB的扩增,细胞的死亡途径也由坏死转变为凋亡途径。经过深入的研究发现上述对结核有抵抗力的主要因素为sst1序列中表达的Ipr1基因[3-5]。体外抗菌实验表明Ipr1基因的表达增强了巨噬细胞杀伤胞内吞噬的MTB的能力。其表达可能主要是增强巨噬细胞抗MTB感染固有免疫机制的有关基因的表达,特别是TLR2/TLR4及与其信号转导有关的分子以及IFN-γR1、TNFR1的表达,促进巨噬细胞的活化及杀伤胞内吞噬的MTB。研究者指出Ipr1基因表达的上调能有效提高巨噬细胞抗结核感染的固有免疫能力,而在人类基因组中又存在与小鼠Ipr1基因高度同源的基因SP110b[6-8],因此,推测Ipr1和SP110可能具有相同的功能,即通过参与激素受体、病原体、干扰素信号间的信息交流介导机体抗胞内寄生菌感染的固有免疫[2]。
SP110基因作为人类结核病易感性相关的一个新的候选基因目前相关研究甚少,其在结核病发展过程中的作用尚不明确,本研究在分子生物学基础上,采用改变基因表达水平的方法利用慢病毒载体导入外源性基因构建SP110过表达的慢病毒载体,并进行病毒包装,为进一步研究SP110在结核病的发生发展中的作用机制及功能奠定基础。随着分子生物学技术的发展,慢病毒载体作为工具备受学者青睐,慢病毒载体是将人类免疫缺陷Ⅰ型病毒(HIV1)的全部HIV1编码基因删除进而改造成的病毒载体系统,能高效地将目的基因导入真核生物细胞中并随着细胞不断分裂持久且稳定地表达目的基因[9-12]。本研究采用上海吉玛公司提供的慢病毒表达系统,即1个穿梭质粒(LV5)和3个包装质粒(pGag/Pol、pRev、pVSV-G)。其中,穿梭质粒中包含目的基因的慢病毒骨架及其包装产生相应基因组RNA的所有顺式作用元件,可以稳定表达目的基因。另外,3个辅助包装质粒可以提供病毒包装所需的反式作用因子,采用“自我灭活”修饰,阻止子代病毒自我复制,从而确保慢病毒具备良好的生物安全性。为了使SP110基因能够在THP-1细胞中稳定表达,本研究构建了SP110过表达慢病毒,利用PCR扩增得到目的基因SP110,利用DNA连接酶将线性化的LV5载体和目的基因SP110连接,通过转化、质粒提取,重组慢病毒质粒酶切鉴定和DNA测序最终鉴定重组质粒V-SP110构建成功。在包装质粒辅助下,利用293T细胞成功包装成SP110过表达的慢病毒载体(LV5-SP110)和相应的对照载体(LV-NC),为研究其分子机制奠定了良好的实验基础。
