长链非编码RNA DRAIC调控miR-181通过STAT信号通路对卵巢癌迁移和侵袭的影响
2020-04-27李晗宇
李晗宇,陈 飞
卵巢癌是全世界女性中发病率较高且死亡率最高的一类妇科肿瘤性疾病,也是女性恶性肿瘤中相关死亡率最常见的原因[1]。尽管目前手术和化疗治疗方式都取得了一定的进展,但卵巢癌患者的总体存活率仍然很低[2]。最近的研究表明,许多长链非编码RNA(long non-coding RNA,lncRNA)在多种细胞过程中都具有重要作用,如增殖,分化,凋亡,细胞生物行为以及疾病发病机制,导致对细胞基因调控网络的影响,干扰其进程[3]。LncRNA DRAIC是一种广泛表达的lncRNA,首次被发现是非小细胞肺癌中高转移潜能和预后不良的因子[4]。最近,lncRNA DRAIC与多种人类肿瘤相关,包括肺癌、肝癌、肾癌、结直肠癌、胃癌和乳腺癌[5]。生物信息学分析表明lncRNA DRAIC与miR-181(一种有效的肿瘤抑制因子)结合,然后靶向miR-181的表达[6]。本研究探讨lncRNA DRAIC调控miR-181通过STAT信号通路对卵巢癌迁移和侵袭的影响。
1 材料和方法
1.1 细胞株 人卵巢癌细胞株SKOV3、COC1、CAOV3和A2780购买于中国科学院上海分院。卵巢癌细胞株均培养在含10%胎牛血清和1%双抗的RPMI-1640培养基中,所有细胞均在5% CO2,37 ℃条件下培养,每隔3 d换液1次,待细胞铺满培养瓶底进行传代,以下所有试验均取处于对数生长期的细胞。
1.2 材料和试剂 RPMI-1640培养基和0.25胰酶(0.25 Trypsin EDTA)购买于美国Gibco公司;胎牛血清(fetal bovine serum,FBS)和双抗(Penicillin-Streptomycin Solution)购买于美国海克隆公司;PBS磷酸盐缓冲液购买于中国碧云天生物公司。DRAIC-siRNA购买于上海吉玛有限公司。氯仿、乙醇、异丙醇购买于重庆川东化工公司。Trizol裂解液、Premix ExTaqVersion2.0和SYBR Premix Ex Taq购买于日本Takara公司。PCR引物由上海Sangon Biotech公司合成。Transwell基质胶购买于美国BD公司;Transwell小室购买于美国康宁公司。
1.3 方法
1.3.1 细胞转染 PBS缓冲液将细胞清洗干净,胰酶消化细胞2 min,转移至无菌15 mL离心管,离心并计数细胞,以每孔4×105个细胞接种于96孔板中,掌握过夜细胞融合率达70%左右,细胞分为DRAIC-siRNA组和NC组2组,无血清培养基将Lipofectamine 2000按3 μL/L进行稀释,37 ℃孵育20 min,用无血清培养基分别将DRAIC-siRNA和NC按50 μM浓度稀释,常温下孵育5 min,最后与Lipofectamine 2000等体积分别混匀,分别加入2组细胞中,37 ℃孵箱继续培养;12 h后,观察转染细胞状态,并将无血清培养基更换为完全培养基,继续培养,48h后,提取细胞RNA,验证转染效率。
1.3.2 实时荧光定量PCR分析 提取卵巢癌细胞总RNA,并逆转录合成相应cDNA。DRAIC上游引物序列为:5′-ATCTTTAGCTGGAGTTCGA-3′,下游引物序列为:5′-AAGGCTTGAGGGCGAGCGAT-3′;miR-181上游引物序列为:5′-ATCGTAGGTCGAGCGGAGC-3′,下游引物序列为:5′-GGGATGCGATTTGCGAGCT-3′。内参照GAPDH的上游引物的序列为5′-TTGGTATCGTGGAAGGACTCA-3′,下游引物序列为5′-TGTCATCATATTTGGCAG-GTT-3′。反应条件为:95 ℃预变性10 min,95 ℃15 s,60 ℃15 s,45个循环,获取荧光信号温度为60 ℃。普通cDNA实时荧光定量PCR检测,采用2-△△Ct方法进行统计。
1.3.3 平板克隆细胞实验 首先消化并计数细胞,以5 000/孔细胞数接种于96孔板中,每组3个复孔,37 ℃孵箱培养;待细胞贴壁,观察细胞状态,吸出培养基,避光条件下,分别加入不同慢病毒转染的细胞中,37 ℃孵育24 h;检测不同组细胞的克隆形成数目,并统计分析。
1.3.4 Transwell侵袭实验 将5×104个细胞置于上室,并加入Matrigel基质胶。将具有10%FBS(20 ng/mL)的培养基置于下室中。在37 ℃下孵育24 h后,小心地去除上膜表面上的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净过后,于倒置显微镜下计数。
1.3.5 荧光素酶报告基因测定 根据Clément等[7]研究方法,构建含DRAIC基因野生型3′UTR、突变型3′UTR片段,两端均设计XbaⅠ酶切位点,插入荧光素酶报告基因质粒(pGL3-promoter,Promega)构建pGL3-3′UTR WT、pGL3-3′UTR MUT。取生长状态良好的293T细胞,质粒转染后48 h据Promega公司操作说明,裂解细胞,加入荧光素酶底物,检测荧光素酶活性。
1.3.6 裸鼠体内成瘤实验 取10只4~6周龄裸鼠,分为DRAIC-siRNA组和NC组,每组5只。将1×106浓度的转染NC序列和DRAIC-siRNA的卵巢细胞分别注射到2组裸鼠的左侧腋下。饲养8周后检测裸鼠肿瘤异种移植物的体积和质量生长情况。异体移植物大小根据以下公式测量:体积=1/2(最短直径)2×(最长直径)。
1.3.7 Western Blot实验 细胞分为NC组、DRAIC-siRNA组和miR-181-mimic组,从卵巢癌细胞SKOV3中提取总蛋白,将总蛋白的等分试样行10% SDS-PAGE,然后电转至PVDF膜上。分别使用抗JAK1、STAT2、p-JAK1、p-STAT2和GAPDH抗体进行孵育,4 ℃过夜,次日PBS洗涤后,加入Ⅱ抗,室温孵育PBS充分洗涤后进行ECL显影,拍照并统计相对表达量。
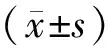
2 结果
2.1 LncRNA DRAIC和miR-181在卵巢癌细胞株中的表达情况 通过实时荧光定量PCR检测lncRNA DRAIC在卵巢癌细胞株中的表达,结果显示SKOV3中lncRNA DRAIC的表达(2.51±0.26)高于其他COC1(2.31±0.21),CAOV3(1.03±0.13)和A2780(1.93±0.12)细胞株(P<0.05),同时对miR-181在卵巢癌细胞株中的表达进行检测,SKOV3中miR-181的表达(2.55±0.31)高于CAOV3(0.76±0.11)和A2780(1.62±0.13)细胞株(P<0.05),稍低于COC1细胞株(2.72±0.24)。图1。后续实验选取卵巢癌SKOV3细胞株作为研究对象。
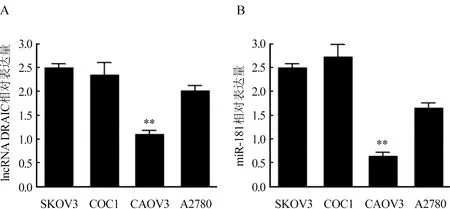
图1 lncRNA DRAIC和miR-181在卵巢癌细胞株中的表达
2.2 双荧光素酶实验检测lncRNA DRAIC和miR-181之间的关系 通过生物信息学检测lncRNA DRAIC与miR-181之间的相互关系,结果显示(图2A),lncRNA DRAIC和miR-181在卵巢癌细胞中可能有相似结合的位点,表明lncRNA DRAIC与miR-181之间可能有调控关系。通过使用DRAIC-siRNA转染卵巢癌细胞后,miR-181-WT的表达水平明显降低[(1.02±0.11)vs(0.38±0.05),P<0.05],而miR-181-MUT的表达水平变化不大[(1.02±0.11)vs(0.96±0.08),P>0.05],图2B。
2.3 LncRNA DRAIC对卵巢癌细胞增殖行为的影响 通过平板克隆细胞实验检测lncRNA DRAIC对卵巢癌细胞株SKOV3增殖能力的影响。首先使用特异的干扰RNA(DRAIC-siRNA)抑制卵巢癌细胞中lncRNA DRAIC的表达,在转染DRAIC-siRNA 48 h和60 h后,SOKV3细胞的增殖能力明显低于对照组(*P<0.05,**P<0.01),图3。
2.4 LncRNA DRAIC对卵巢癌细胞侵袭行为的影响 Transwell实验结果如图4所示,抑制lncRNA DRAIC后,和NC组相比,DRAIC-siRNA组的侵袭细胞数目[(186.4±12.4) vs (73.6±8.6),P<0.05]显著降低。
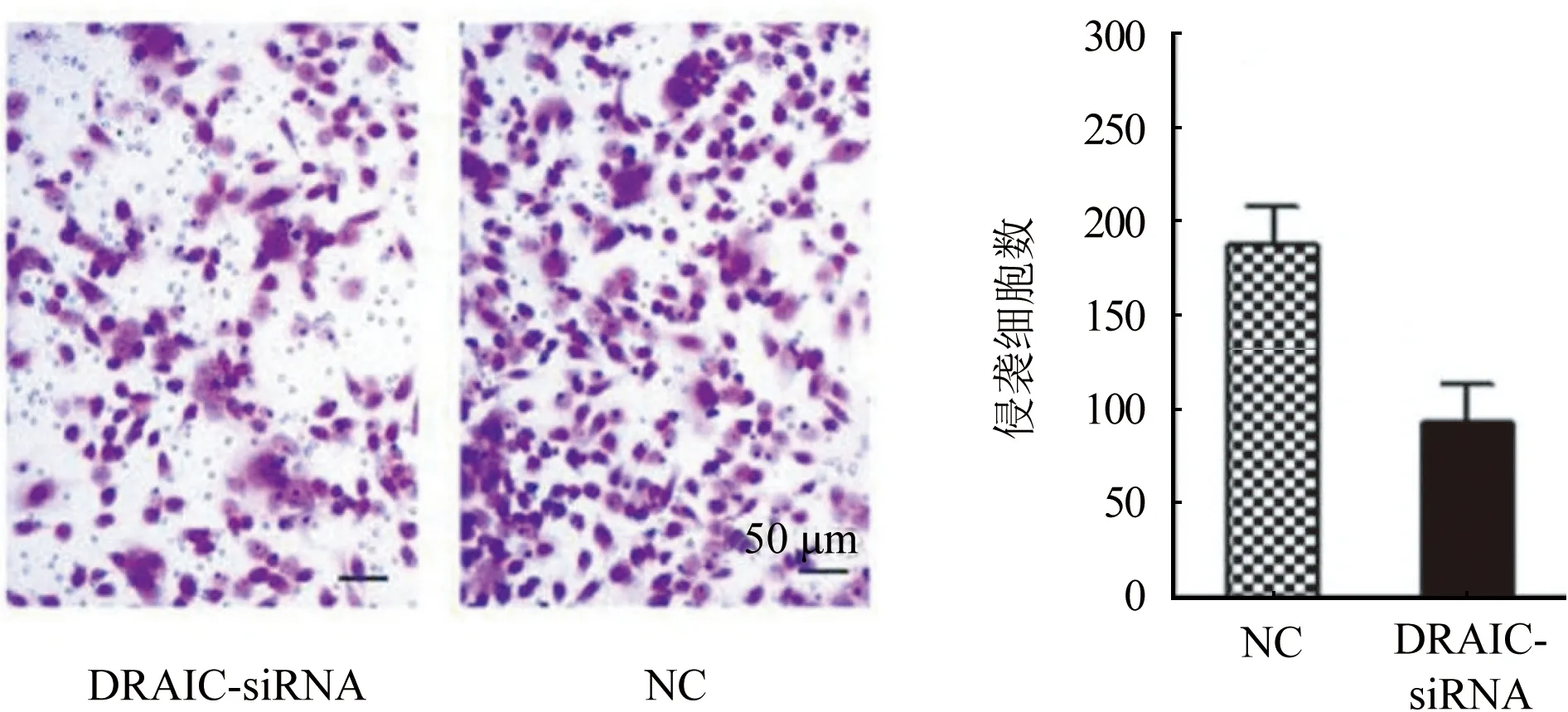
图4 lncRNA DRAIC对卵巢癌细胞侵袭行为的影响
2.5 LncRNA DRAIC对卵巢癌细胞迁移行为的影响 划痕愈合实验结果如图5所示,抑制lncRNA DRAIC后,和NC组相比,DRAIC-siRNA组的细胞迁移距离比例[(2.53±0.24) vs (1.21±0.09),P<0.05]显著降低。
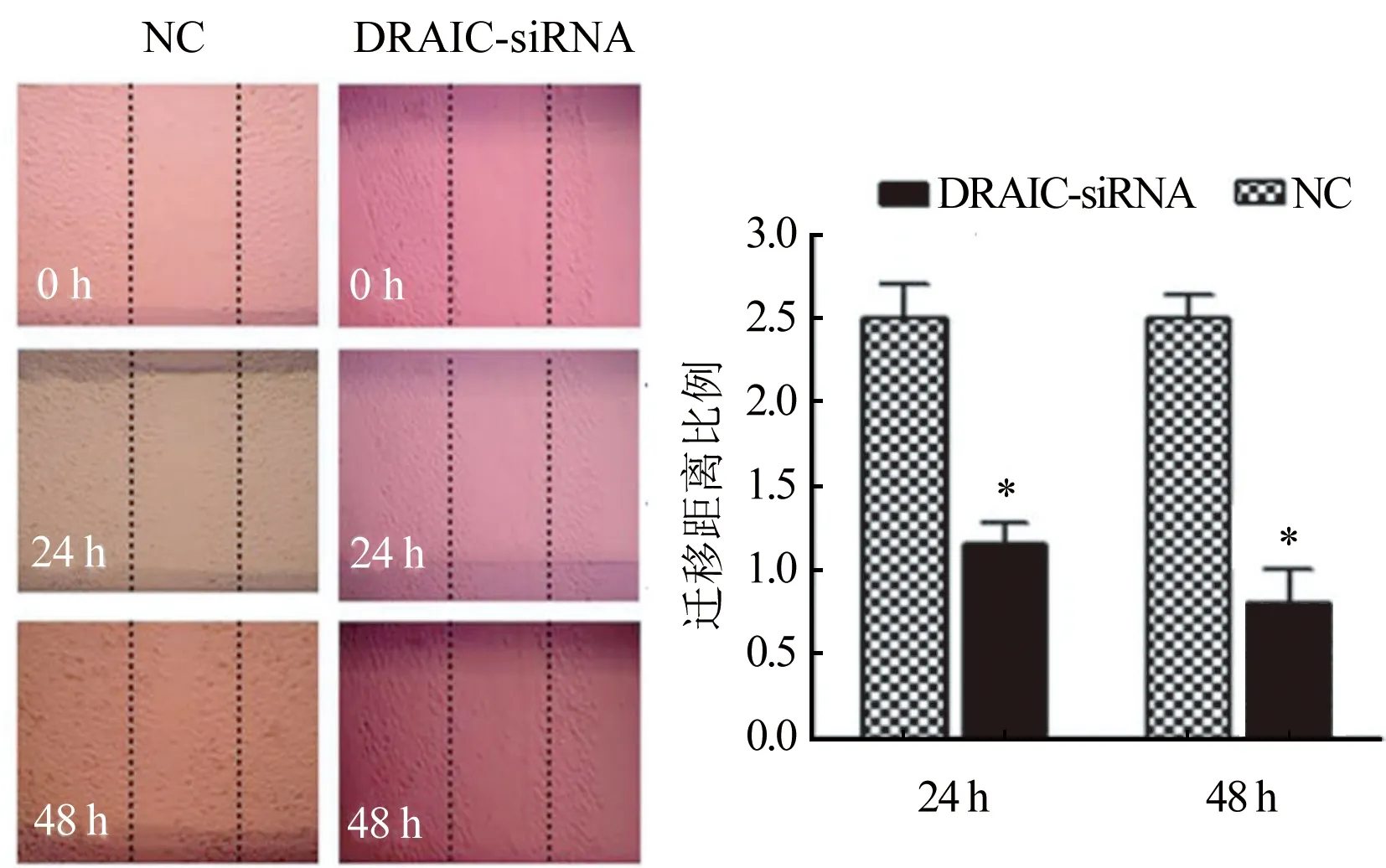
图5 lncRNA DRAIC对卵巢癌细胞迁移行为的影响
2.6 LncRNA DRAIC对卵巢癌细胞裸鼠成瘤能力的影响 通过裸鼠异种移植肿瘤生长测定,DRAIC-siRNA组平均肿瘤体积明显小于NC组[(1.135±0.09)cm3vs (2.13±0.13)cm3,P<0.05],而且DRAIC-siRNA组平均肿瘤重量也显著低于对照组[(1.52±0.12)g vs (1.89±0.21)g,P<0.05]。图6。
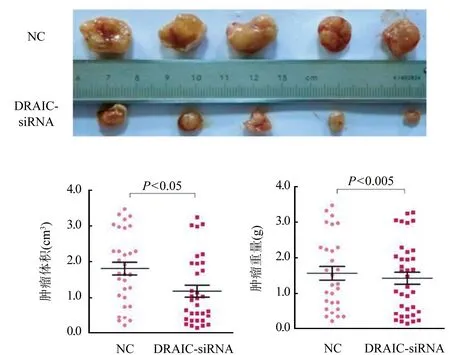
图6 lncRNA DRAIC对卵巢癌细胞裸鼠成瘤能力的检测
2.7 LncRNA对JAK1/STAT2信号通路激活的影响 Western Blot实验结果显示,与NC组相比,DRAIC-siRNA组的磷酸化p-JAK1和p-STAT2蛋白表达水平相应下调,而同时过表达miR-181-mimic后,磷酸化p-JAK1和p-STAT2蛋白表达水平相应的恢复,表明抑制DRAIC可以在一定程度上抑制JAK1/STAT2信号通路的激活,而同时增加miR-181的表达后对JAK1/STAT2的抑制效果相对缓解,同时非磷酸化的JAK1和STAT2蛋白表达未受明显的影响。图7。
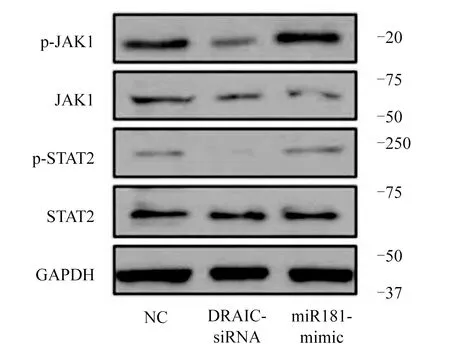
图7 lncRNA对JAK1/STAT2信号通路激活的影响
3 讨论
LncRNA DRAIC可以以不同细胞类型特异性方式进行动态变化。在成年小鼠组织中,lncRNA DRAIC在有限的细胞类型中表达,例如消化组织的上皮层。相比之下,lncRNA DRAIC在人类更广泛的细胞类型中表达[8]。最近研究发现,lncRNA DRAIC的生物学作用主要与缺氧、病毒感染以及人胚胎干细胞分化有关[9]。据报道lncRNA DRAIC的水平在不同的癌症类型中呈现动态调节。例如,血浆lncRNA DRAIC水平可作为非小细胞肺癌的探索指标[10];lncRNA DRAIC在结直肠癌中的表达上调,并与肿瘤的分化、浸润、转移和TNM分期有关[11];此外,高表达lncRNA DRAIC是结直肠癌预后不良的独立预后指标[12];lncRNA DRAIC还参与了肝细胞癌,慢性淋巴细胞白血病和前列腺癌的疾病进展[13]。然而,它在卵巢肿瘤发生中的作用尚未明确。
本研究证实lncRNA DRAIC是人类卵巢癌细胞的致癌调节剂,针对卵巢癌lncRNA DRAIC的治疗靶点研究具有潜在应用前景。本研究发现由lncRNA DRAIC介导的生物网络对卵巢癌致癌作用贡献很大,在这个复杂的网络中,上游lncRNA DRAIC影响转录miR-181,进而激活JAK1/STAT2信号通路,JAK1/STAT2在卵巢癌细胞样本中参与程度没有明显差异,而磷酸化的JAK1/STAT2的表达水平受lncRNA DRAIC和miR-181影响明显。本研究结果表明miR-181受lncRNA DRAIC的调控表达活性降低,抑制miR-181有助于调控JAK1/STAT2靶标信号通路的激活,同时包括许多致癌基因的表达失调。本研究证实lncRNA DRAIC在卵巢癌细胞系中表达较高,这与之前相关研究的结果数据一致[14]。本研究结果表明lncRNA DRAIC可能在体外和体内控制卵巢癌细胞生长中发挥作用。更重要的是,在体内移植实验中,lncRNA DRAIC水平的降低显著地抑制了肿瘤生长。结果证实可能通过下调这种潜在的生物标志物来提供有效抑制肿瘤的治疗方法,这将为卵巢癌患者的临床治疗和预后提供更有效途径。
本研究存在一定的不足,只在lncRNA DRAIC序列中鉴定了一个miR-181结合位点,但当在不同条件下使用报告基因和内源基因作为检测源时,它显示出明显的荧光活性水平不同,目前已经证明lncRNA DRAIC的作用位点和含有功能性miR-181的结合位点相近,但仍未证实通过生物信息学分析预测的更准确的结合位点,有必要进一步进行生物信息学分析以揭示可能具有强碱基对的miR-181的位点与目标基因的结合。
综上所述,我们的研究表明卵巢癌细胞中特异性lncRNA DRAIC作为一种miRNA分子的调节剂,可以调控miR-181以干扰卵巢癌的基因的表达并进一步保持卵巢癌细胞的生物学功能,为卵巢癌的分子诊断和治疗提供了新的研究途径和方向。
