土荆芥种子总黄酮提取条件的优化和抗肿瘤活性评价
2020-04-27郝俊玫王亚男钱瑞华李海赢武靖松马丹炜
郝俊玫,王亚男,钱瑞华,李海赢,武靖松,马丹炜
四川师范大学生命科学学院,成都 610101
土荆芥(C.ambrosioides)为藜科一年或多年生草本植物[1],广泛分布于世界温带至热带地区,在我国南方和北方的大部分地区均有分布[2]。土荆芥全株含有丰富的挥发油、黄酮、生物碱等,具有抗菌、抑虫、抗肿瘤和抗氧化等功效[3,4]。在抗肿瘤方面,土荆芥叶醇提物可抑制腹腔内艾氏固体瘤和腹水瘤的形成,显著提高荷瘤小鼠存活率[5];全株醇提物可抑制MCF-7细胞增殖[6];在土荆芥的不同器官中,所含黄酮类物质成分差异较大,从种子中提取的次生代谢产物含量高于根和茎[7,8]。
在植物次生代谢物质的提取方面,提取溶剂对提取物的成分影响较大,对其抗肿瘤活性方面影响也较大。Zeng等[9]研究长根静灰球不同溶剂提取物的体外抗肿瘤作用,发现正丁醇提取物对MDA-MB-231细胞活力有较明显的抑制作用;不同溶剂海芋提取物抗肿瘤效果也不尽相同,乙酸乙酯和丙酮提取物有较好的细胞毒活性,而海芋的环己烷、石油醚、乙醇和水提物对各种细胞株的IC50剂量都比较大[10]。有关不同溶剂对土荆芥提取物成分及其抗肿瘤活性成分的影响报道较少,本研究选用不同极性有机溶剂石油醚、乙酸乙酯、正丁醇以及蒸馏水单独或依次为溶剂,采用微波超声波组合合成/萃取仪提取四川产土荆芥种子总黄酮,采用HPLC法测定其槲皮素和山奈酚的含量,MTT法评价其抗肿瘤活性,以期筛选土荆芥种子总黄酮最佳提取条件,为四川产土荆芥作为潜在抗肿瘤药物的开发利用提供参考依据。
1 材料与方法
1.1 实验材料
土荆芥于2016年9月下旬在四川省成都市净居寺的废弃荒地采集,经四川师范大学生命科学学院马丹炜教授鉴定为藜科藜属植物土荆芥(C.ambrosioides)。将采集的土荆芥植株置于阴凉通风处,晒干后收集其种子,磨碎放于密封袋中备用。
人正常肝L02细胞、人宫颈癌Hela细胞、人肝癌HepG2、Hep3b细胞、SMMC-7721和人结肠癌HT29细胞均由四川大学华西医院生物治疗国家重点实验室提供。
1.2 仪器与试剂
祥鹄电脑微波超声波组合合成/萃取仪(北京祥鹄科技发展有限公司);Algilent Technologies高效液相色谱仪(安捷伦科技有限公司);
石油醚、乙酸乙酯、正丁醇(成都科龙化工试剂厂);槲皮素、山奈酚(西安天美生物科技公司);噻唑蓝(MTT,Biosharp生物公司);5-氟尿嘧啶(中国食品药品检定研究院);鬼笔环肽(上海翊圣生物科技有限公司)。
1.3 土荆芥种子总黄酮的制备与纯化
称取40 g土荆芥种子,按料液比1∶6加入溶剂,浸泡1 h,微波为300 Hz,超声波为275 Hz,微波与超声波比例为1∶2。其它条件如表1所示,得到S1~S7提取物。采用D101大孔吸附树脂纯化S1~S7提取物,收集液再次用旋转蒸发仪减压蒸馏,并进行真空干燥。

表1 土荆芥种子总黄酮提取方法
注:S1:石油醚提取物;S2:乙酸乙酯提取物;S3:正丁醇提取物;S4:蒸馏水提取物;S5:石油醚-乙酸乙酯依次提取物;S6:石油醚-乙酸乙酯-正丁醇依次提取物;S7:石油醚-乙酸乙酯-正丁醇-蒸馏水依次提取物,下同;“+”使用该溶剂提取;“-”表示不使用该溶剂提取。
Note:S1:Petroleum ether extract;S2:Ethyl acetate extract;S3:Butyl alcohol extract;S4:Distilled water extract;S5:Petroleum ether-ethyl acetate sequential extract;S6:Petroleum ether-ethyl acetate-butyl alcohol sequential extract;S7:Petroleum ether-ethyl acetate-butyl alcoho-distilled water sequential extract.
1.4 土荆芥种子总黄酮含量测定
1.4.1 标准溶液制备和标准曲线的确定
按Qian等[3]的方法配置标准溶液,按照紫外-可见分光光度法,在波长510 nm测定其吸光度。以吸光度为纵坐标(Y),浓度为横坐标(X),作标准曲线图。
1.4.2 样品总黄酮含量测定
分别称取纯化后的S1~S7提取物各0.2 g,配制浓度为2 mg/mL的母液。量取上述各样品母液1 mL,同“1.4.1”中芦丁标准溶液的配制方法,按照紫外-可见分光光度法,在波长510 nm处测定其吸光度值,并根据线性回归方程计算各样品中总黄酮类物质含量[3]。
1.5 土荆芥种子总黄酮中槲皮素和山奈酚含量测定
1.5.1 标准品溶液的配制和线性曲线的确定
以甲醇为溶剂,配制浓度为200 μg/mL的槲皮素标品母液和300 μg/mL的山奈酚标品母液,备用。两种标品溶液的配制见表2。
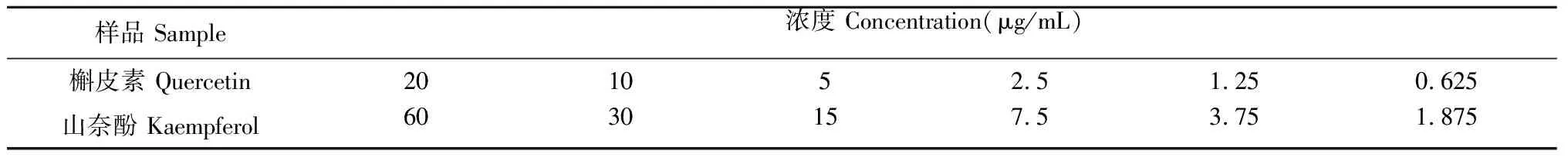
表2 槲皮素和山奈酚标品溶液浓度
将0.1%甲酸用抽滤泵经有机滤膜抽滤后放入超声波清洗仪中进行脱气,以相同的方法处理100%乙腈。然后分别用0.1 %甲酸、100%乙腈冲柱,流速为3.00 mL/min,再用100%乙腈冲基线至平滑。
按以下色谱条件进样:C18色谱柱(250 mm × 4.6 mm,5 μm);进样量为10 μL;柱温为25 ℃;乙腈-0.1%甲酸(35∶65)作为流动相,柱流量为1.0 mL/min;在波长为360 nm处进行检测。以峰面积为纵坐标(Y),对应浓度为横坐标(X),进行线性回归计算,得其回归方程[11]。
1.5.2 样品总黄酮溶液的配制
分别称取纯化后的S1~S7提取物,用溶液配制浓度为200 mg/mL的溶液。进样的色谱条件同“1.5.1”中槲皮素和山奈酚标准溶液的检测方法,在波长360 nm处测定其对应峰面积值,并根据线性回归方程计算各样品中槲皮素和山奈酚的物质含量[12]。
1.6 细胞培养
L02、SMMC-7721、HepG2、Hep3b、Hela和HT29细胞分别接种在加有10%新生牛血清的改良型1640培养基或DMEM培养基中,在5% CO2、37 °C培养箱中培养。取对数生长期细胞用于试验。
1.7 MTT法检测细胞增殖
制备上述6株细胞的细胞悬液,以浓度8×104个/mL、每孔100 μL接种于96孔板中。在37 ℃、5% CO2培养箱中培养过夜,每孔加100 μL新鲜培养基,按照表3加入2 μL不同浓度的土荆芥种子提取物溶液。各浓度重复5次,设置溶剂对照(1% DMSO)、阴性对照和阳性对照(80 μg/mL 5-氟尿嘧啶)。共培养24 h后,加入20 μL MTT培养4 h,除上清,加150 μL DMSO。酶标仪检测490 nm波长处的吸光度A值,计算细胞增殖抑制率(细胞增殖抑制率=[1-A处理组/A溶剂对照]×100%)。
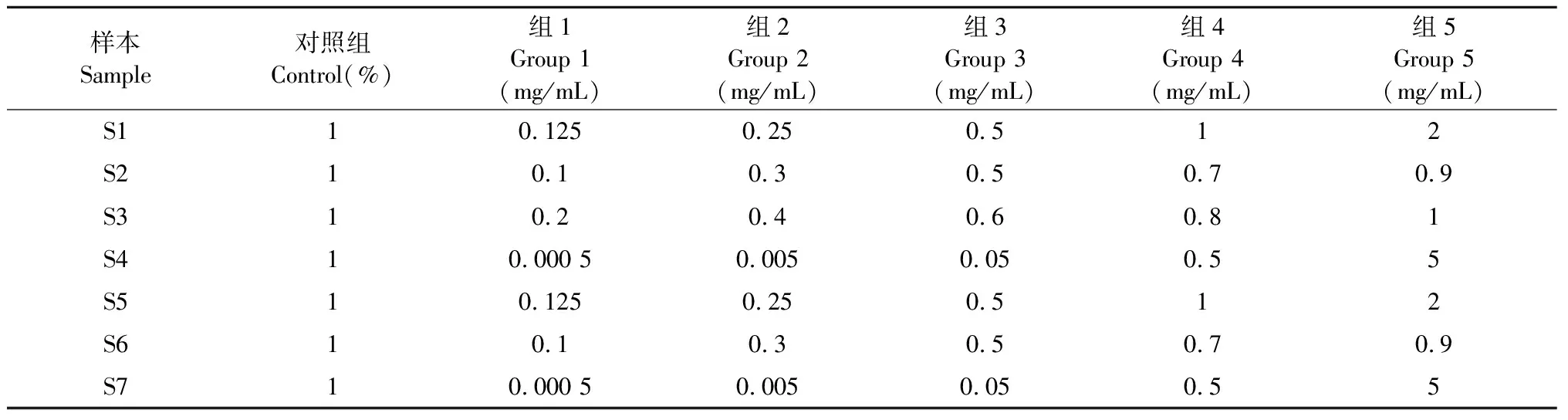
表3 各样本处理浓度
注:对照组:1% DMSO;S1~S7同表1。
Note:Control:1% DMSO;S1-S7 are the same as Table 1.
1.8 倒置显微镜观察细胞形态
制备浓度为4×105个/mL的SMMC-7721细胞的细胞悬液,以每孔1 mL接种在6孔板上。5% CO2、37 ℃培养箱中培养过夜后,每孔加1 mL新鲜培养基,并加入20 μL S6溶液,使其终浓度分别为0.1、0.3和0.7 mg/mL,并设置溶剂对照(1% DMSO)。培养24 h后,用倒置显微镜观察并拍照。
1.9 细胞集落形成试验
前期SMMC-7721细胞的培养和不同浓度S6溶液的处理方法同“1.8”,同时设置溶剂对照(1% DMSO)。各浓度的S6溶液作用SMMC-7721细胞后,孵育至明显观察到细胞集落,除上清,PBS清洗,2.5%戊二醛溶液固定20 min,PBS清洗3次,Giemsa染液染色30 min,PBS清洗6孔板直至完全脱色后,倒置显微镜观察,并拍照。
1.10 荧光显微镜观察细胞骨架
SMMC-7721细胞的培养和不同浓度S6溶液的处理方法同“1.8”,并设溶剂对照(1% DMSO)。各浓度的S6溶液作用SMMC-7721细胞24 h后,弃去培养基,用PBS清洗后,每孔加浓度为1%的Triton X-100/M缓冲液1 mL,在25 ℃下静置20 min;弃去Triton X-100/M缓冲液,再次用PBS清洗10 min,重复3次;2.5% 的戊二醛固定(4 °C、15 min),再次用PBS清洗3次;200 μM鬼笔环肽染色20 min,PBS重复清洗3次后,使用荧光显微镜观察并拍照。
1.11 统计分析
采用SPSS 20.0处理数据,单因素ANOVA方差分析显著性差异(P<0.05),使用Microsoft Excel 2003和GraphPad Prism 7.04作图。
2 结果与分析
2.1 土荆芥种子提取物总黄酮提取率及含量测定
选用不同极性溶剂,采用微波超声波辅助萃取土荆芥种子总黄酮,D101大孔吸附树脂纯化粗提物,最后得率见表4,S6的提取率最高为3.97%,S1的提取率最低为0.28%。黄酮的标准曲线见图1,其回归线方程为Y= 0.005 8X-0.000 4,R2=0.999 9,线性范围为0~50 μg/mL。S1~S7中总黄酮含量见表4,S6中总黄酮含量最高为96.39 mg/g。
2.2 土荆芥种子总黄酮中槲皮素和山奈酚含量分析
采用高效液相色谱仪对梯度稀释后的不同浓度槲皮素和山奈酚标品溶液进行分析,槲皮素和山奈酚标准曲线分别如图2(A)和2(B)所示,并根据浓度和峰面积计算线性回归方程,槲皮素标品的线性回归方程为Y=35.188 79X-2.886 93e-1,相关性R2=0.999 94,残留标准误差为3.036 39,出峰保留时间为6.940 min;山奈酚标品的线性回归方程为Y=14.957 23X-4.291 25,相关性R2= 0.999 94,残留标准误差为3.778 41,出峰保留时间为11.756 min。
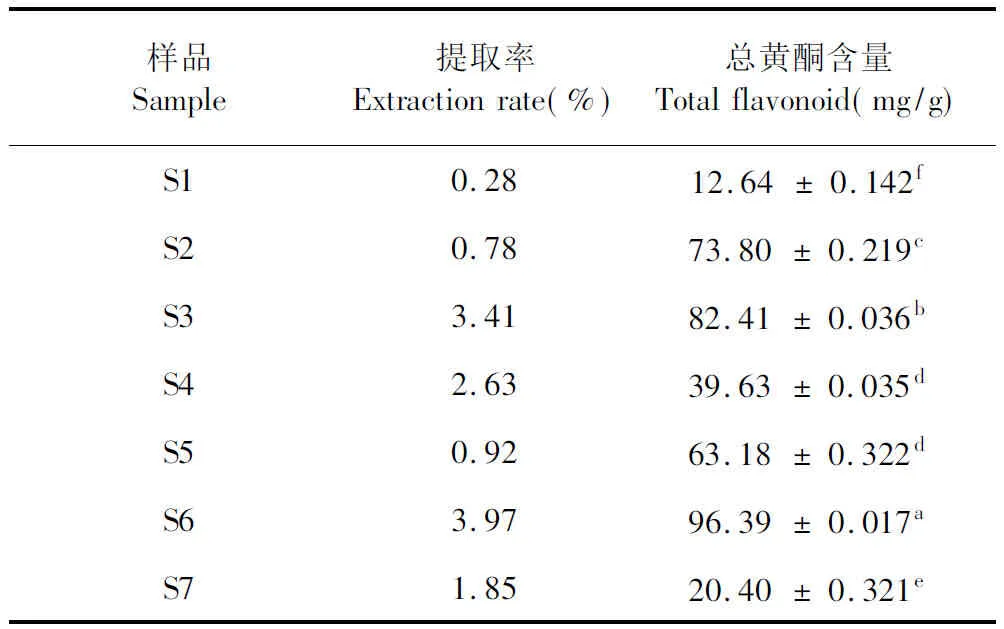
表4 不同溶剂土荆芥种子总黄酮的提取率及含量
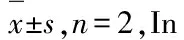

图1 黄酮标准曲线Fig.1 Standard curve of flavonoids
如表5结果所示,S1~S7中槲皮素和山奈酚的含量不同。S2中槲皮素含量最高为0.602 mg/g,S6中槲皮素含量次之,为0.531 mg/g,S5和S3中槲皮素含量分别为0.481和0.412 mg/g;S6中山奈酚的含量最高,为0.479 mg/g。而S1、S4和S7样品中未检测到槲皮素和山奈酚的成分。
2.3 土荆芥种子总黄酮对6株供试细胞增殖的抑制作用
MTT法检测S1~S7对各细胞的抑制效果及IC50值见图4和表6。综合来看,当分别用S1~S7作用于细胞24 h时,S1~S7均不同程度的抑制6株供试细胞的增殖,且具有浓度依赖性(P< 0.05)。其中S2、S5和S6抗肿瘤作用优于其余4种。S6对Hela、SMMC-7721和HepG2 细胞的增殖抑制效果较强,IC50值分别为0.37、0.43和0.66 mg/mL,对人正常肝细胞L02几乎没有抑制作用。因S2和S5的溶解效果较差,故本研究后续试验中均选S6即土荆芥种子石油醚-乙酸乙酯-正丁醇提取物(petroleum ether-ethyl acetate-n-butanol extract ofC.ambrosioidesseeds)进行抗肿瘤作用研究。

图2 槲皮素(A)和山奈酚(B)标准曲线Fig.2 Standard curve of quercetin (A) and kaempferol (B)

图3 槲皮素和山奈酚含量测定的高效液相色谱图Fig.3 High performance liquid chromatogram of determination of quercetin and kaempferol注:S1~S7同表1;A:槲皮素标品;B:山奈酚标品;C:S2;D:S3;E:S5;F:S6;1:槲皮素;2:山奈酚。Note:S1-S7 are the same as table 1;A:Standard product of quercetin;B:Standard product of kaempferol;C:S2;D:S3;E:S5;F:S6;1:Quercetin;2:Kaempferol.
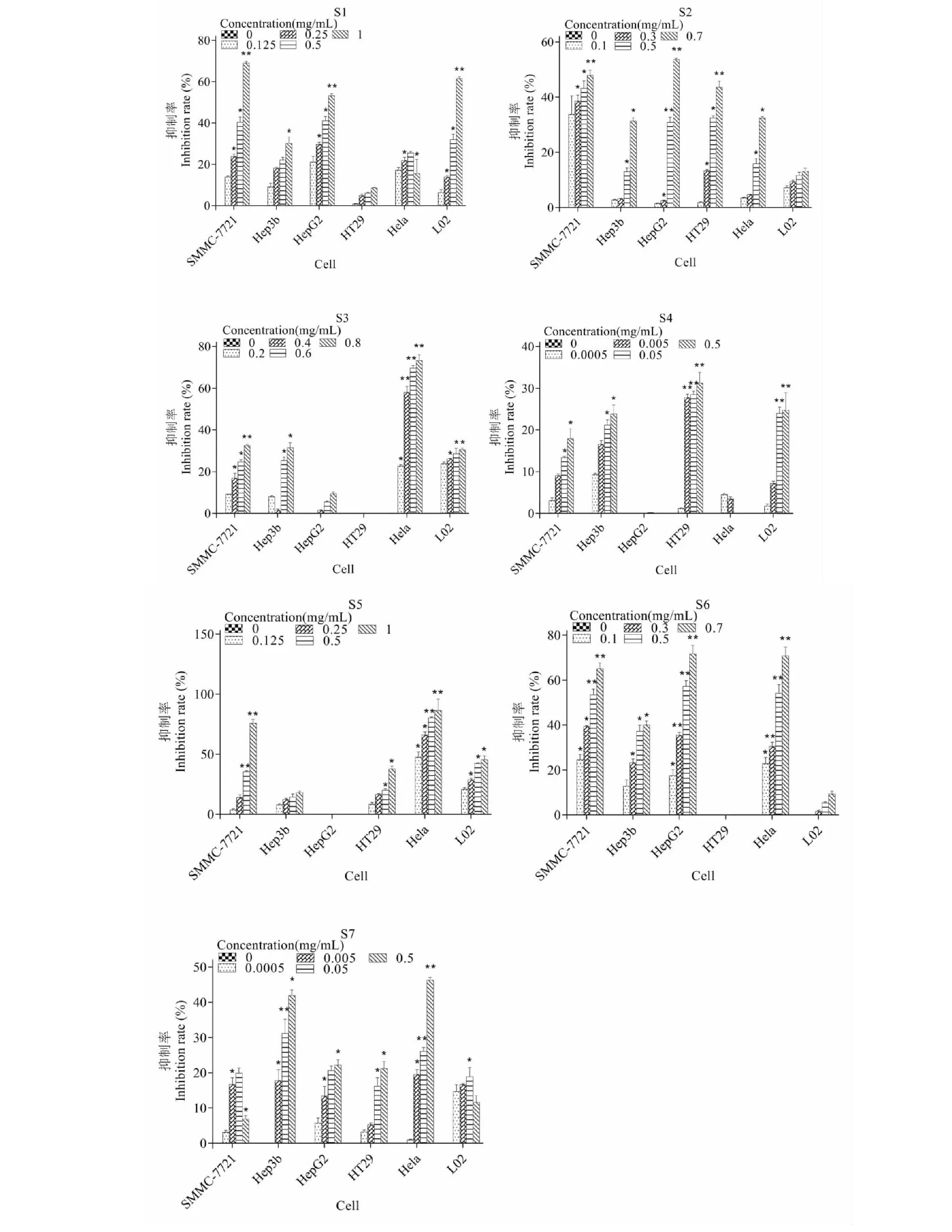
图4 S1~S7对L02、Hela、SMMC-7721、Hep3b、HepG2和HT29细胞增殖的影响Fig.4 Effects of S1-S7 on proliferation of L02,Hela,SMMC-7721,Hep3b,HepG2 and HT29 cells注:S1~S7同表1;0 mg/mL:1% DMSO对照;*表示显著差异(P<0.05);**表示差异极显著(P<0.01)。Note: S1-S7 are the same as table 1; Control of 1% DMSO; *represents difference P<0.05; **represents highly dominant difference P<0.01.
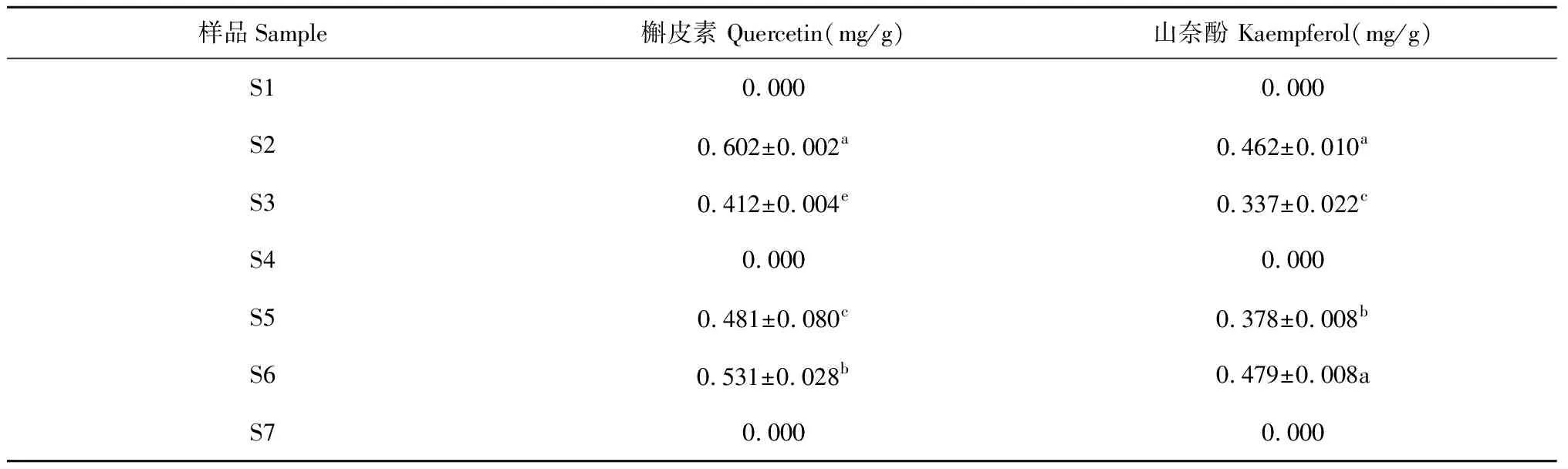
表5 土荆芥种子提取物中槲皮素及山奈酚含量
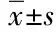


表6 S1~S7对6株细胞的IC50值(mg/mL)
注:S1~S7同表1;“-”表示无抗肿瘤作用。
Note:S1-S7 are the same as Table 1;“-” means no antitumor effect.
2.4 S6对SMMC-7721细胞形态变化的影响
溶剂对照组的SMMC-7721细胞呈舒展状贴壁生长,有明显的细胞分裂相出现(图5a);随着S6处理浓度的增大,SMMC-7721细胞形态、粘附性和折光性均发生变化,细胞粘附力下降,逐渐开始皱缩变圆,高剂量组大部分细胞悬浮死亡(图5b~d)。表明S6对SMMC-7721细胞具有显著的细胞毒性。
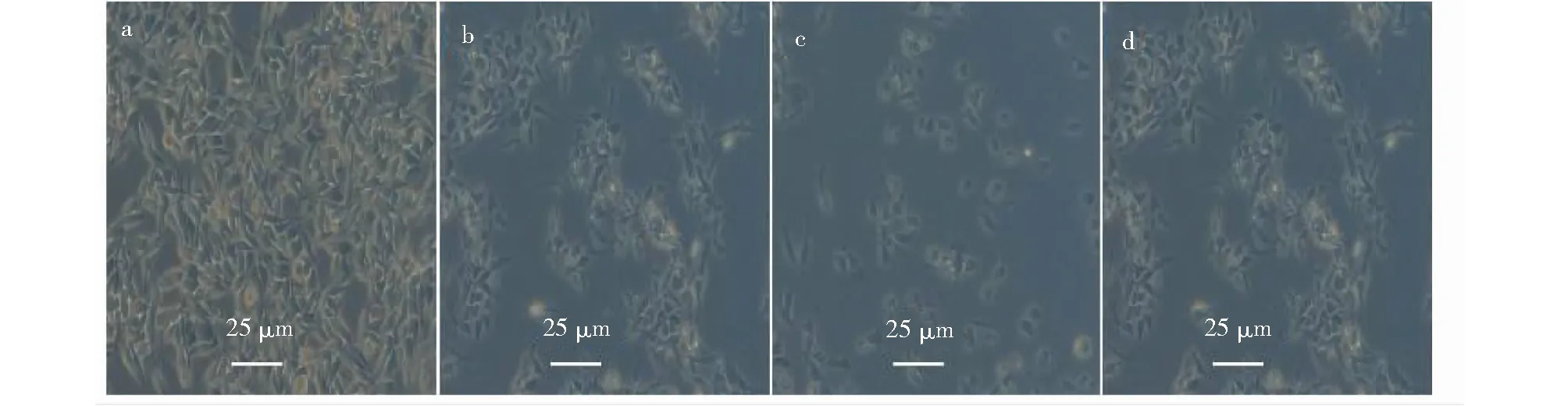
图5 S6对SMMC-7721细胞形态的影响Fig.5 Effect of S6 on the morphology in SMMC-7721 cells注:a:1% DMSO对照;b:0.1 mg/mL S6;c:0.3 mg/mL S6;d:0.7 mg/mL S6,下同。Note:a:control of 1% DMSO;b:0.1 mg/mL of S6;c:0.3 mg/mL of S6;d:0.7 mg/mL of S6,the same below.
2.5 S6对SMMC-7721细胞集落形成的影响
SMMC-7721细胞集落形成试验是通过观察结晶紫的染色程度来作为评判标准的,结果显示,S6浓度越高,结晶紫染色越浅,表明SMMC-7721细胞形成的集落数越少(图6),进一步说明S6对SMMC-7721细胞的生长具有抑制作用。

图6 S6对SMMC-7721细胞集落形成试验结果Fig.6 Clone formation assay of S6 in SMMC-7721 cells
2.6 S6对SMMC-7721细胞骨架结构的影响
鬼笔环肽染色结果如图7所示,与溶剂对照组相比(图7a),随着S6处理浓度的增加,细胞的荧光强度逐渐减弱(图7 b、c、d),且细胞体积皱缩变小,微丝在细胞内弥散分布,高浓度S6处理组(0.6 mg/mL)中出现排列紊乱的现象。

图7 S6对SMMC-7721细胞骨架的影响Fig.7 Effects of S6 on the cytoskeleton in SMMC-7721 cells
3 讨论与结论
天然产物黄酮类化合物的提取方法主要有索氏提取、有机溶剂萃取、超声波提取法、微波萃取法等,提取溶剂常以有机溶剂为主[13-15]。本研究选择不同极性有机溶剂石油醚、乙酸乙酯、正丁醇以及蒸馏水单独或依次为溶剂,采用微波超声波组合合成/萃取仪提取四川产土荆芥种子总黄酮,结果显示,经正丁醇提取的S3和S6总黄酮提取率明显较其他溶剂高(3.41%和3.97%),以石油醚为溶剂提取率最低(0.28%)。表明总黄酮的提取率可能与溶剂极性有关,黄酮类化合物多以极性稍大的苷元形式存在,一般易溶于强极性溶剂中[16],根据相似相溶的原理,溶剂极性越强,总黄酮的提取率可能越高,该结果与Shen等[17]研究极性越强的溶剂提取加拿大一枝花总黄酮得率越高的结果基本一致。而S4和S7中总黄酮提取率较低,可能是因许多黄酮类化合难溶或微溶于水[18]。槲皮素和山奈酚是多种植物黄酮的主要成分,且具有明显的抗肿瘤作用[19-21],本研究中对S1~S7中槲皮素、山奈酚的含量测定显示,不同溶剂总黄酮提取物中槲皮素和山奈酚的含量不同,S2中槲皮素含量最高,为0.602 mg/g,S6中山奈酚含量最高,为0.479 mg/g,表明较高极性溶剂乙酸乙酯和正丁醇提取的槲皮素和山奈酚含量较高,这与Gu[22]和Wang[23]等测定不同植物有机溶剂提取物中槲皮素和山奈酚含量的研究结果一致。
提取溶剂除对提取物的成分影响较大,对其抗肿瘤活性也会产生相应的影响。Duan等[24]发现血人参石油醚部位、醋酸乙酯部位、正丁醇部位、水部位及乙醇提取物均有一定抑制肿瘤生长的作用。其中以乙酸乙酯部位的作用最佳。本研究中对S1~S7抗肿瘤作用评价显示7种提取物的抗肿瘤作用也不尽相同。S6和S4对SMMC-7721细胞的IC50值分别为0.43和11.56 mg/mL,相差27倍,表明不同溶剂对提取物的抗肿瘤作用影响较大。同一种提取物对不同细胞的抑制效果也不尽相同,如S6对Hela和SMMC-7721细胞的抑制作用大于HepG2、Hep3b和L02细胞,但对HT29未检测到抑制作用。
在土荆芥种子总黄酮的提取中,综合不同溶剂提取物的总黄酮含量、溶解性和抗肿瘤作用,以S6(石油醚-乙酸乙酯-正丁醇)提取方案为最佳选择。进一步以SMMC-7721细胞为靶标研究显示,S6可导致该细胞粘附性和折光性下降,逐渐皱缩变圆至悬浮死亡,表明S6对SMMC-7721细胞具有明显的细胞毒性,同时集落形成实验显示其具有抑制细胞集落形成的能力;鬼笔环肽染色后显示,经S6处理后,细胞的荧光强度逐渐减弱,微丝在细胞内弥散分布,排列紊乱,表明S6可能影响细胞骨架重组,提示S6提取物对SMMC-7721细胞的毒性与细胞骨架有关。有关S6提取物的抗肿瘤作用机制有待进一步深入研究。
