茶籽皂苷对高脂血症大鼠肠道菌群的影响研究
2020-04-27刘芷君雷郑延曾文治程福建林全女杨江帆
林 玲,刘芷君,雷郑延,曾文治,程福建,林全女,杨江帆*
1福建农林大学园艺学院;2茶学福建省高校重点实验室,福州350002
高脂血症通常指血清中总胆固醇(total cholesterol,TC)和(或)总甘油三酯(triglycerides,TG)水平升高,是“三高”之一,致使不利于机体健康的相关物质大量积累,导致肝脏负担过重、血管血栓沉淀等,引发动脉粥样硬化、糖尿病等多种并发症[1,2]。2010年~2030年,我国心血管患者人数将因血清胆固醇水平的升高约增加920万,高胆固醇血症患者也日趋低龄化[3]。
近年来,随着“人类微生物组计划”、“肠道元基因组计划”等研究项目的开展,人类对肠道菌群的关注达到了空前的高度。肠道微生物群体与宿主、外界环境建立起一个动态的生态平衡,对维持人体健康起着重要的作用[4]。2016年《PNAS》报道,高脂饮食小鼠肠道菌群结构显著不同于正常小鼠[5],而高脂饮食是高脂血症的最主要诱因。肠道菌群在高脂血症的发生发展过程中扮演了重要的角色,使肠道菌群成为调节脂代谢异常的研究热点和新方向。目前有关茶籽皂苷对肠道菌群影响的报道寥寥无几,有关高脂血症肠道菌群影响的研究更是匮乏。而本课题组前期研究发现,茶籽皂苷能调节高脂饲料致大鼠高脂血症模型的血脂水平,减轻肝脏脂肪变性程度,同时还能改善高脂血症带来的氧化损伤和肝脏损伤,提高机体的抗氧化能力[6]。因此本文选用茶籽皂苷进行动物实验,通过16S rRNA测序技术的检测,进一步研究茶籽皂苷对高脂血症大鼠肠道菌群的影响,以期为茶籽皂苷调节血脂机理的研究奠定基础。
1 材料与方法
1.1 材料与仪器
茶籽皂苷(含量:71.21%,批号:180314001,湖南汉清生物技术有限公司);羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na,上海源叶生物科技有限公司);辛伐他汀片(批号:H20093421,湖北广济药业股份有限公司);无特定病原体(specific pathogen free,SPF)级雄性Wistar大鼠60只(体重:200±20g,生产许可证号:SCXK (沪)2012-0002,上海斯莱克实验动物有限责任公司);对硝基苯酚、水合氯醛(分析纯,阿拉丁试剂(上海)有限公司);高脂饲料(辐照,北京博爱科贸有限公司,配方:蛋黄粉10%、猪油5%、胆固醇5%、胆盐 0.5%、丙硫氧嘧啶0.2%、基础饲料79.3%);普通饲料(福建中医药大学实验动物中心);TransStart Fastpfu DNA Polymerase(北京全式金生物技术有限公司);AxyPrepDNA凝胶回收试剂盒(美国AXYGEN公司)。
KDC-2046低速冷冻离心机(安徽中科中佳科学仪器有限公司);TE601-L电子天平(德国赛多利斯公司)等。
1.2 实验方法
1.2.1 动物模型的建立与分组
本实验在福建中医药大学实验动物中心SPF级屏障动物实验室进行。大鼠饲养环境:室温22~26 ℃,相对湿度40%~70%,明暗交替条件为12 h/12 h。大鼠均在同一环境下随机分笼饲养,每笼5只,自由饮水摄食。
60只雄性Wistar大鼠适应性喂养1周后随机分为10只正常组和50只造模组,分别饲喂基础饲料、高脂饲料。4周后禁食12 h断尾取血,检测TC与正常组有显著差异(P<0.05),则造模成功[7]。如表1,将造模组按体重随机分为模型对照组、阳性对照组和茶籽皂苷低、中、高剂量组,每日上午定时连续灌胃给药四周,末次给药后24 h(禁食不禁水12 h),处死,收集大鼠盲肠的肠道内容物保存待测。所用灌胃药物均使用0.5% CMC-Na作为溶剂进行配制。
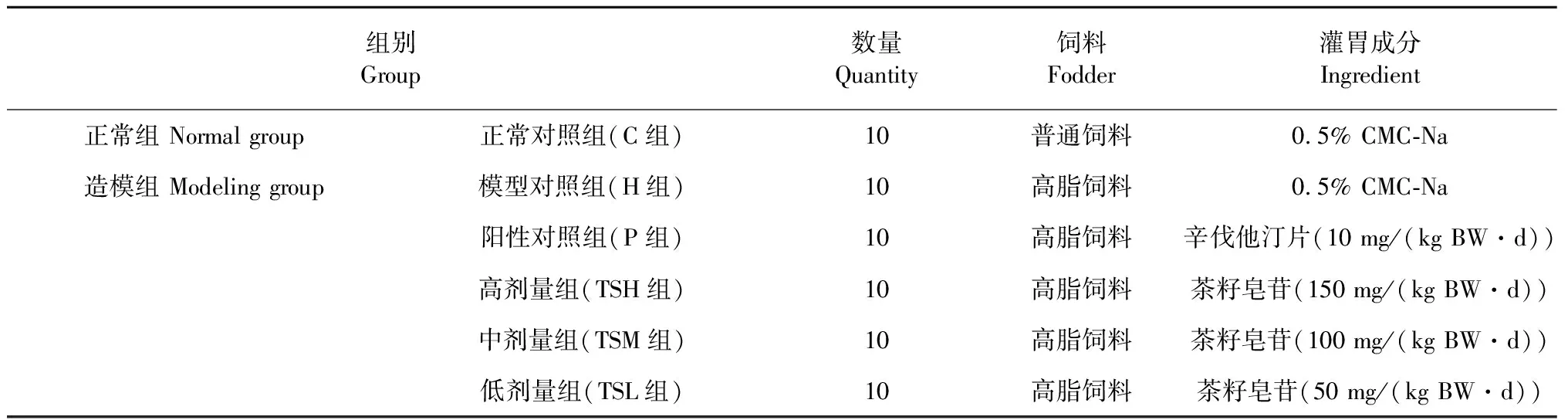
表1 动物分组与给药方法
1.2.2 肠道内容物DNA的提取和高通量测序
采用DNA 提取试剂盒抽提大鼠盲肠内容物DNA,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
将DNA样品在冰上融化后,离心并充分混匀,Nanodrop 2000检测样品质量,取30 ng按16S rRNA V3-V4测序区域,合成带有barcode的特异引物,进行PCR扩增。引物序列:515a(5′-GTGCCAGCMGCCGCGGTAA-3′)和806(5′-GGACTACHVGGGTWTCTAAT-3′);反应条件:94 ℃ 5 min;94 ℃ 30 s;50 ℃ 30 s;72 ℃ 60 s;72 ℃ 7 min;4 ℃ end,30个循环。使用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。Miseq文库构建(北京奥维森基因科技有限公司),并使用HiSeq2500 PE250 测序平台进行上机测序。
1.3 数据处理
原始数据下机后,结果以Fastq格式存储。Miseq测序得到的是Pair-End(PE)双端序列数据,对测得的Fastq数据进行质控处理,最终得到优质的Fasta数据:下机数据在去除barcode和primer并拼接后,经进一步去除嵌合体、短序列后得到优质序列。用uparse聚类法生成OTUs(对97%相似水平下的OTU进行生物信息统计分析),进一步采用RDP Classifier算法对OTU代表序列进行比对分析(数据库:silva(release128/132 http://www.arb-silva.de)),并在门(phylum)、科(family)、属(genus)三个水平注释其群落的物种信息。
2 结果与分析
2.1 模型建立
造模4周后,造模组血清TC(2.10±0.09 mmol/L)显著高于正常组(1.36±0.03 mmol/L),有统计学意义(P<0.01),说明高脂血症模型已成功建立[7]。
2.2 高通量测序基本数据分析
高通量测序处理后获得3 387 619条优质序列数,其中样本最大序列数为136 867条,最小序列数为28 656 条,每个样本的平均序列数为65 959.94 条,99.87%的序列长度分布在200~260 bp区间。由图1的稀释曲线可知,各组OTU 数量与测序数量正相关,且曲线随着测序量增多逐渐趋向平坦,说明测序深度已经基本覆盖到样品中的所有物种。

图1 大鼠肠道菌群的稀释曲线Fig.1 Rarefaction curves of rat intestinal microflora
花瓣图是一种表示样本/组间特有和共有OTU数目的展示方式,以每个花瓣代表一个样品,中间的core数字代表的是所有样品共有的OTU数目,花瓣上的数字代表该样品特有的OTU数目。聚类结果分析可知(如图2),六组大鼠共同拥有358个OTUs,各组也存在其特有的OTUs。
2.3 茶籽皂苷对高脂血症大鼠肠道菌群物种的丰度和多样性的影响
测定物种(observed species)指数表示该样品中含有的物种数目,数值越高表明样品丰度越高;香农(shannon)指数是用来估算样品中微生物多样性指数之一,shannon值越大,说明群落多样性越高。如图3所示,与C相比,H组大鼠的observed species指数显著降低(P<0.05),而茶籽皂苷各剂量组的丰度均低于C组但略高于H组,P组与H组相仿,表明高脂饮食可导致大鼠肠道菌群丰度显著降低,而茶籽皂苷可提升大鼠肠道菌群丰度。与C相比,H组大鼠的shannon指数极显著降低(P<0.01),P组与H组相仿,而茶籽皂苷各剂量组的多样性均低于H 组,表明高脂饮食可导致大鼠肠道菌群多样性极显著降低,但茶籽皂苷并不能抑制这种趋势,甚至加剧了趋势,这可能与茶籽皂苷的杀菌消炎功效相关,可能是其减少了一些菌群物种,但同时增加了某些菌群物种的数量,导致其丰度上升,多样性下降。但有趣的是,随着茶籽皂苷剂量的提高,大鼠肠道菌群的多样性有所提高,这其中的原理需要做进一步的研究探讨。

图2 大鼠肠道菌群的OTU分布花瓣图Fig.2 OTU distribution petal map of rat intestinal microflora注:花瓣图以每个花瓣代表一个样品,中间的core数字代表的是所有样品共有的OTU数目,花瓣上的数字代表该样品特有的OTU数目。Note:In the petal chart,each petal represents a sample,the core number in the middle represents the number of OTUs common to all samples,and the number on the petal represents the number of OTUs unique to the sample.

图3 茶籽皂苷对大鼠肠道菌群observed species指数和shannon指数的影响Fig.3 Effects of tea seed saponin on intestinal microflora observed species index and shannon index in rats
2.4 茶籽皂苷对高脂血症大鼠肠道菌群群落结构的影响
2.4.1 茶籽皂苷对门水平上高脂血症大鼠肠道菌群分布的影响
图4显示,在门水平上,六组大鼠的肠道菌群主要被划分为:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、螺旋体门(Spirochaetae)、放线菌门(Actinobacteria)等。其中Firmicutes、Bacteroidetes和Proteobacteria 这三个细菌门类的占绝对优势,占到了测序序列总数的85%以上。高脂饮食使大鼠肠道内的Firmicutes 与Actinobacteria的相对丰度极显著降低(P<0.01),Proteobacteria和Spirochaetae的相对丰度极显著升高(P<0.01),Bacteroidetes的相对丰度显著升高(P<0.05),这与Tomas、Wang等[5,8-16]的研究成果一致,而高脂饮食的同时摄入辛伐他汀和不同剂量茶籽皂苷对这一趋势均具有不同程度地调节效果。相对于H组,不同剂量茶籽皂苷均可极显著提高Firmicutes的相对丰度(P<0.01),P组有所提高,但无统计学意义;TSH组Actinobacteria 的相对丰度极显著提高(P<0.01),TSM组显著提高(P<0.05),TSL组和P组基本无变化;TSM组和TSH组Proteobacteria的相对丰度显著降低(P<0.05),而TSL组和P组Proteobacteria的相对丰度反而有所提高;辛伐他汀和不同剂量茶籽皂苷均可极显著降低Spirochaetae的相对丰度(P<0.01);P组和TSH组Bacteroidetes的相对丰度极显著降低(P<0.01),TSL组和TSM组显著降低(P<0.05)。上述结果表明,茶籽皂苷对由高脂饲料诱发的高脂血症大鼠的肠道菌群门水平上菌群结构具有较好的调节作用,且呈量效关系,茶籽皂苷高剂量组的调节效果最佳。但目前更多的研究倾向于研究肠道菌群的低分类水平菌群结构。
2.4.2 茶籽皂苷对科水平上高脂血症大鼠肠道菌群分布的影响
如图5所示,在科水平上,高脂饮食使毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)的相对丰度极显著降低(P<0.01),脱硫弧菌科(Desulfovibrionaceae)、紫单孢菌科(Porphyromonadaceae)的相对丰度极显著升高(P<0.01),这与Collins和Daniel等[17-21]的研究结果一致。Lachnospiraceae和Ruminococcaceae均属于梭菌目(Clostridiales)、厚壁菌门,与肥胖呈负相关;Desulfovibrionaceae 属于脱硫弧菌目(Desulfovibrionales)、变形菌门,会产生内毒素;Porphyromonadaceae属于拟杆菌目(Bacteroidales)、拟杆菌门,与体重存在正相关[20-22]。与H组相比,P组和TSH组Lachnospiraceae的相对丰度显著提高(P<0.05),TSL组和TSM组有所提高,但无统计学意义;TSL组和TSH组Ruminococcaceae 的相对丰度极显著提高(P<0.01),P组和TSM组有所提高,但无统计学意义;TSM组、TSH组和P组Desulfovibrionaceae的相对丰度极显著降低(P<0.01),TSL组并未抑制其升高的趋势;P组和TSH组Porphyromonadaceae的相对丰度极显著降低(P<0.01),TSL组和TSM组有所下降,但无统计学意义。研究表明,茶籽皂苷对高脂血症大鼠的肠道菌群科水平上菌群结构具有较好的调节作用,其中对Lachnospiraceae、Desulfovibrionaceae和Porphyromonadaceae调节作用且呈量效关系,茶籽皂苷高剂量组的效果最佳。

图4 茶籽皂苷对门水平上大鼠肠道菌群分布的影响Fig.4 Effects of tea seed saponin on relative abundance of intestinal microflora in rats at phylum level
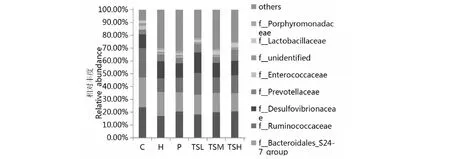
图5 茶籽皂苷对科水平上大鼠肠道菌群分布的影响Fig.5 Effects of tea seed saponin on relative abundance of intestinal microflora in rats at family level
2.4.3 茶籽皂苷对属水平上高脂血症大鼠肠道菌群分布的影响
如图6所示,在属水平上,H组大鼠的肠道菌群中属于硫酸盐还原菌类的脱硫弧菌属(Desulfovibrio)相对丰度极显著高于C 组(P<0.01),这与Liu等[23]的研究一致。研究发现,高脂血症患者体内长期存在代谢性炎症,而硫酸盐还原菌的代谢产物会破坏肠道屏障,诱导炎症的发生[24]。而灌胃辛伐他汀和不同剂量茶籽皂苷的高脂饮食诱导的高脂血症大鼠肠道内Desulfovibrio相对丰度得以控制,均极显著下降(P<0.01)。
高脂饮食使罗斯氏菌属(Roseburia)极显著下降(P<0.01),而Roseburia有益于治疗和预防肥胖相关疾病[25]。与H组相比,P组和TSH组Roseburia的相对丰度极显著提高(P<0.01),TSM组显著提高(P<0.05),TSL组也有所提高,但无统计学意义。
相较于C组,H组大鼠的粪杆菌真核菌属(Eubacterium_coprostanoligenes_group)极显著降低(P<0.01),已经发现Eubacterium_coprostanoligenes_group是降低胆固醇的微生物,与体重、TG呈负相关[26]。与H组相比,TSH组Eubacterium_coprostanoligenes_group的相对丰度极显著提高(P<0.01),恢复到C组相近水平, TSM组和P组也有所提高,但无统计学意义,TSL组没有改善效果。
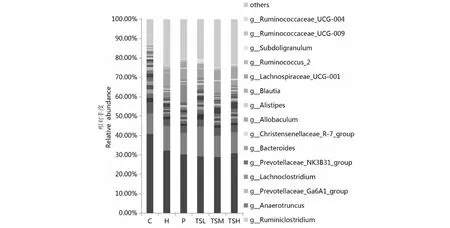
图6 茶籽皂苷对属水平上大鼠肠道菌群分布的影响Fig.6 Effects of tea seed saponin on relative abundance of intestinal microflora in rats at genus level
实验中,H组大鼠乳杆菌属(Lactobacillus)相对丰度低于C 组,与Xiong等[27]的研究一致。而灌胃中剂量和高剂量茶籽皂苷后的TSM组和TSH组高脂血症大鼠肠道内Lactobacillus相对丰度得以极显著提高(P<0.01),TSL组也有所提高,但无统计学意义,P组没有改善效果,甚至比H组更低。Lactobacillus具有降胆固醇的效果,作用于血清TC、TG、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)[28]。
瘤胃球菌属与代谢紊乱存在关联,其在高脂膳食宿主肠道内的相对丰度较低[29]。研究中,H组大鼠瘤胃球菌科_NK4A214_group(Ruminococcaceae_NK4A214_group)和瘤胃球菌科_UCG-014(Ruminococcaceae_UCG-014)的丰度比C组极显著降低(P<0.01),与H组相比,TSH组Ruminococcaceae_NK4A214_group和Ruminococcaceae_UCG-014的相对丰度极显著提高(P<0.01);TSM组和P组Ruminococcaceae_NK4A214_group的相对丰度显著提高(P<0.05),Ruminococcaceae_UCG-014的相对丰度也有所提高,但无统计学意义;TSL组Ruminococcaceae_NK4A214_group也有所提高,但无统计学意义,Ruminococcaceae_UCG-014没有改善效果。
上述结果表明,茶籽皂苷对高脂膳食引起的属水平上的肠道菌群失衡具有一定的调节作用,且呈量效关系,茶籽皂苷高剂量组的调节效果最佳。
2.5 茶籽皂苷对高脂血症大鼠肠道菌群结构差异性的影响
将属水平丰度排名在前二十的菌群根据物种注释及丰度信息进行相似性聚类,表示在热图上,通过颜色梯度及相似程度来反映各组大鼠属水平上肠道菌群群落组成的相似性和差异性。从图7可以看出,H组和C组大鼠属水平上的肠道菌群之间存在结构差异性,P组、茶籽皂苷各剂量组与H组之间也具有结构差异性。在六组大鼠中,TSH组与C组相对接近,表明茶籽皂苷能改善高脂血症大鼠肠道的菌群结构,其中以茶籽皂苷高剂量的改善效果为好。
从图8可以看出,其很明显地分成了六个小组,其中C组和H组存在显著差异,说明高脂饮食引起了大鼠肠道菌群结构的变化。药物治疗后,P组、TSH组与H组距离较远,TSL组、TSM组与H组相近。
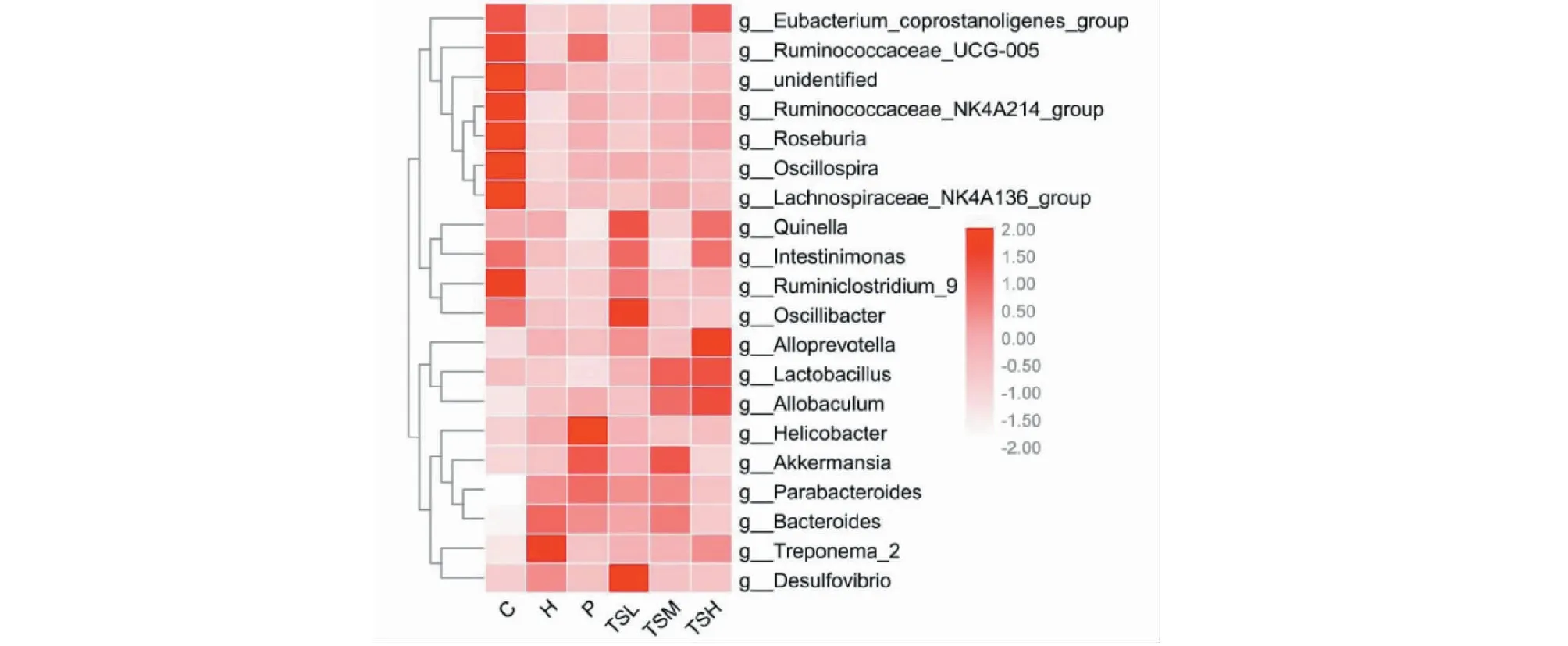
图7 大鼠肠道菌群的热图和聚类树Fig.7 Heatmap and clustering tree of rat intestinal microflora

图8 大鼠肠道菌群的PCA分析Fig.8 PCA analysis of rat intestinal microflora
3 小结
本研究采用16S rRNA测序技术探讨了茶籽皂苷对由高脂饲料诱发的高脂血症大鼠的盲肠菌群α-多样性以及门、科、属分类水平组成的影响。高脂饮食及高脂血症可因造成肠道内养料来源减少、改变氧化还原状态、破坏菌群赖以生存的微环境来影响肠道菌群的构成[30]。本研究发现,发现高脂血症大鼠肠道菌群丰度和多样性显著降低;门水平上,Firmicutes 与Actinobacteria 的相对丰度极显著降低,Proteobacteria、Spirochaetae和Bacteroidetes显著升高;科水平上,Lachnospiraceae、Ruminococcaceae极显著降低,Desulfovibrionaceae、Porphyromonadaceae极显著升高;属水平上,Desulfovibrio极显著升高,Roseburia、Eubacterium_coprostanoligenes_group、Ruminococcaceae_NK4A214_group和Ruminococcaceae_UCG-014极显著下降,Lactobacillus相对丰度低于C 组。同时,本试验还发现高脂血症的发生会引起肠道菌群结构性失调。以上证明了高脂血症的发生影响了肠道菌群的结构和相对丰度,而肠道菌群在高脂血症的发生发展过程中起着关键作用。
经过茶籽皂苷的调节,高脂血症大鼠肠道菌群的丰度得到提升,但多样性未得到改善。门水平上,TSH组Firmicutes和Actinobacteria的相对丰度极显著提高,Proteobacteria、Spirochaetae和Bacteroidetes显著降低;TSM组Firmicutes和Actinobacteria显著提高,Proteobacteria、Bacteroidetes和Spirochaetae显著降低;TSL组Firmicutes极显著提高,Spirochaetae和Bacteroidetes显著降低,Actinobacteria和Proteobacteria无显著性改变。科水平上,TSH组Lachnospiraceae和Ruminococcaceae 显著提高,Desulfovibrionaceae和Desulfovibrionaceae极显著降低;TSM组Lachnospiraceae、Ruminococcaceae和Porphyromonadaceae有所调节,但无统计学意义,Desulfovibrionaceae极显著降低;TSL组Lachnospiraceae和Porphyromonadaceae有所调节,但无统计学意义,Ruminococcaceae极显著提高,Desulfovibrionaceae升高的趋势未被抑制。属水平上,TSH组Desulfovibrio极显著下降,Roseburia、Eubacterium_coprostanoligenes_group、Ruminococcaceae_NK4A214_group和Ruminococcaceae_UCG-014极显著提高;TSM组Desulfovibrio极显著下降(P<0.01),Roseburia、Ruminococcaceae_NK4A214_group和Lactobacillus显著提高,Eubacterium_coprostanoligenes_group和Ruminococcaceae_UCG-014也有所提高,但无统计学意义;TSL组Desulfovibrio极显著下降,Roseburia和Ruminococcaceae_NK4A214_group也有所提高,但无统计学意义,Eubacterium_coprostanoligenes_group和Ruminococcaceae_UCG-014没有改善。
综上所述,本研究发现茶籽皂苷对由高脂饲料诱发的高脂血症大鼠的肠道菌群起到正向调节作用。而本课题组前期研究发现,茶籽皂苷能调节喂食高脂饲料致大鼠高脂血症模型的血脂水平,减轻肝脏脂肪变性程度,同时还能改善高脂血症带来的氧化损伤和肝脏损伤,提高机体的抗氧化能力[6]。因而,推测茶籽皂苷调解血脂的作用机制之一是通过改善肠道菌群结构进而调节脂质代谢来实现的。
