乌司他丁通过 miR-146a 调节 TLR4/NF-κB信号通路减轻失血性休克大鼠肾炎性损伤研究
2020-04-27王振杰徐志鹏邱兆磊郑传明
王振杰,陈 硬,宋 琦,徐志鹏,纪 忠,邱兆磊,郑传明,李 磊,程 峰
创伤失血性休克[1](traumatic hemorrhagic shock,THS)指因创伤致使机体大量失血,并出现有效循环血容量降低、器官灌注不足及细胞代谢失调等一系列病理生理过程。若不能得到及时救治,会引起机体微循环功能紊乱,重者则可致使病人死亡。据相关文献[2]报道,全球每年大约190万人死于失血性休克,其中,发生在美国的就有近6万人。急性失血造成的微循环功能障碍、细胞代谢紊乱及炎症反应失调是THS发展的可预防和控制的首要死亡原因[3-5]。其中如何进行有效的液体复苏、改善微循环及调节炎症反应是目前THS研究的关键问题之一。YAN等[6]研究发现,失血性休克后予以复苏后可能会引起持续性微循环障碍,导致多器官损伤,肾脏是受累器官之一。近年来,有日益增多的研究结果显示出miR-146a与机体内的炎症反应紧密相关,本团队前期研究结果[7]显示失血性休克大鼠的miR-146a表达在肺组织中上调,但其是否参与失血性休克大鼠肾组织炎性损伤的调控及其作用机制尚不明确。
Toll样受体4(TLR4)是炎症反应中信号传导通路的关键枢纽之一,可通过激活核转录因子(NF-κB)进行信号传递,刺激免疫细胞释放出大量的炎症介质,进而影响机体内的炎症均衡和免疫调节[8-9]。所以,调控TLR4/NF-κB信号通路或许是救治失血性休克的潜在途径。乌司他丁(ulinastatin,UTI)指存在于尿液中,后经高度提纯而分离出来的蛋白酶抑制剂,在稳定溶酶体膜、减轻内皮细胞损伤、调理炎症反应、改善免疫状态及缓解微循环功能障碍等方面具有重要的作用,现主要应用于脓毒症、急性循环衰竭及重症胰腺炎等常见临床危重症的治疗。醋酸钠林格液是现今限制性液体复苏的一线晶体液,且本课题组早期在关于限制性液体复苏的研究结果中已经得出了醋酸钠林格液相比0.9%氯化钠溶液和乳酸钠林格液等疗效更佳的结果[10-11]。CAO等[12]经研究认为,UTI能够影响TLR4/NF-κB的信号通路,达到抑炎并减轻肺组织急性损伤的作用。本课题组的前期实验中已发现UTI可上调THS大鼠中miR-146a表达,但是其影响TLR4/NF-κB信号通路及减轻肾炎性损伤方面的作用与调控miR-146a表达水平是否有关,仍需进一步验证。本实验旨在探讨醋酸钠林格液对THS大鼠行限制性液体复苏的基础上加用UTI,后检测各指标如miR-146a、炎症因子及TLR4和NF-κB在肾组织中的表达量,从而研究经UTI干预后的作用机制,以便为今后失血性休克的病人提供更精准的医治策略。
1 材料与方法
1.1 实验材料 24只雌雄不限的SD大鼠(均为SPF级),体质量为230~250 g。大鼠在(24±1)℃的室温及40%~60%的湿度中,经12 h光照与黑暗周期循环交替环境下饲养7 d后进行实验。Medlab-u/2cs生物信号采集处理系统、漩涡振荡器、恒温水浴锅及全功能化学发光及荧光生物图像分析系统等均购自中国,台式高速冷冻离心机和实时定量荧光PCR仪等均购自美国。乌司他丁和醋酸钠林格液分别产自中国天普公司和湖南康源制药有限公司。其他所有化学品均为试剂级。
1.2 动物分组与休克模型建立 实验依据随机数字表法将大鼠随机分成3组,即休克未复苏组(SR组)、醋酸钠林格液复苏组(AR组)和UTI联用醋酸钠林格液复苏组(UR组),每组各8只。建立创伤失血性休克及液体复苏的大鼠模型:应用2%戊巴比妥钠(剂量为0.25 mL/100 g)通过腹腔给称好体质量的大鼠注射,待麻醉满意后将其固定在操作台上,并予以备皮后,使用聚维酮碘消毒,再予以铺巾,充分暴露出腹股沟区皮肤,沿股静脉走形切开后使用玻璃分针仔细显现两侧的股动、静脉,并依次给予置管(管腔内注入少量2.5%枸橼酸钠稀释液,维持管腔畅通)。其中,右股动脉于Medlab-u/2cs系统连通,右股静脉的管道留予补充液体,左股动脉的管道留以缓慢放血,左股静脉的管道于微量泵相连。成功置管后,留置20 min给予大鼠适应。用2 mL的注射器(内含枸橼酸钠溶液0.2 mL)自大鼠左侧股动脉持续缓慢放血(速度为2 mL/3 min),待大鼠平均动脉压下降至35 mmHg左右,整个过程约需15 min。再经回输少量大鼠的自体血和/或间断缓慢放血保证平均动脉压约30~40 mmHg,持续60 min。SR组大鼠不复苏,静置4 h(如大鼠死亡,则死亡瞬间)后取其肾脏组织备检。AR组予以醋酸钠林格液进行限制性液体复苏,于大鼠的右股静脉管道内补充醋酸钠林格液(总复苏量∶总失血量=3∶1,过程约30 min),左股静脉在5 min内泵入2 mL 0.9%氯化钠溶液,复苏满意后,静观大鼠4 h后,取其肾脏组织。UR组是以AR组的基础上联用UTI,于左股静脉在5 min内泵入稀释于2 mL 0.9%氯化钠溶液中的UTI(10万U/kg),复苏满意后,静观大鼠4 h后,取其肾脏组织。在上述实验中,为了补偿大鼠经呼吸道和手术区域丧失的液体量,皆自大鼠左股静脉连通微量泵推注0.9%氯化钠溶液(5 mL·kg-1·h-1)。本实验已通过蚌埠医学院实验动物管理和相关伦理委员会的审查同意。
1.3 实验方法和观察指标
1.3.1 采用QT-PCR法检测大鼠肾组织中的miR-146a和炎症因子的mRNA表达水平 按Trizol法从肾组织中分离、提取RNA,并根据美国Invitrogen公司的逆转录试剂盒再将其反转录成cDNA,后通过QT-PCR进行扩增。miR-146a、IL-1、IL-4、IL-6、IL-10和TNF-α、GAPDH的引物序列详见表1。

表1 实时荧光定量PCR的引物序列
1.3.2 采用Western blotting检测各组肾组织中TLR4、NF-κB的蛋白相对表达量 取冻存的肾组织,经裂解收集和匀浆后,检测组织蛋白浓度(用BCA试剂盒),通过电泳后,转移到PVDF膜,并将其放置在5%脱脂奶粉的封闭液内,经摇床2 h后,添加一抗。在摇床上(4 ℃)经过孵育一夜之后,洗涤膜3次(用TBST),添加二抗(已提前标记),通过1 h孵育(室温)后,再次洗涤膜。使用增强化学发光法(ECL)扫描并统计分析膜上条带的密度,最后分析其目的蛋白和GAPDH灰度比值。
1.3.3 光镜下观察大鼠肾组织的病理变化 采用4%多聚甲醛用以固定大鼠的肾组织,后经石蜡处理,再对其进行切片,最后,按照HE染色,通过光镜分别观察3组大鼠肾组织的病理结构变化。
1.4 统计学方法 采用方差分析和q检验。
2 结果
2.1 肾组织中miR-146a和炎症因子的mRNA表达水平 3组在miR-146a mRNA方面进行比较,其在UR组中的表达水平较其他2组明显上升(P<0.01);在IL-1 mRNA方面表达的比较中,UR组较SR组有明显下降(P<0.01),与AR组对比,两者差异无统计学意义(P>0.05);在IL-4 mRNA表达水平的比较中,UR组中IL-4 mRNA表达水平较其他2组明显升高(P<0.01);在IL-6 mRNA表达的比较中,UR组中IL-6 mRNA的表达较SR组明显下降(P<0.01),与AR组比较,两者差异无统计学意义(P>0.05);在IL-10 mRNA表达的比较中,UR组中IL-10 mRNA表达水平较其他2组有明显提升(P<0.01);在TNF-α mRNA表达的比较中,UR组中TNF-α mRNA表达水平较其他2组有明显下降(P<0.01)(见表2)。
2.2 肾组织中的TLR4、NF-κB蛋白表达水平 与SR组和AR组对比,UR组的TLR4和NF-κB蛋白表达水平均明显降低(P<0.01);与AR组相比,UR组的TLR4和NF-κB蛋白表达水平亦明显降低(P<0.01)(见图1、表3)。
2.3 肾组织在病理学方面的改变 光镜下大鼠的肾组织:SR组的病理变化尤为显著,可见明显扩张的肾小管,其中有坏死、脱落的细胞,近曲小管上皮细胞肿胀明显,在小管间的血管有明显的扩张充血,且在间质内也存在较多浸润的炎性细胞。较SR组的肾组织病理改变,AR组变化稍轻,但仍可见管腔稍扩张的肾小管,上皮细胞有少许肿胀,小管间存在充血的血管,且间质内也有散在的炎性细胞。UR组的肾组织病理改变较其他2组都有明显减轻,其肾组织的结构无明显改变,间质内有零落的炎性细胞(见图2)。
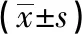
表2 3组肾组织中miR-146a和炎症因子的mRNA表达水平
q检验:与SR组比较*P<0.05;与*R组比较,△P<0.05
q检验:与SR组比较*P<0.05;与AR组比较△P<0.05
3 讨论
THS除创伤直接损伤重要脏器外,主要是由于创伤应激及低血容量造成微循环功能障碍和组织灌注不足,从而产生损伤相关分子模式,触发炎症呈“瀑布样”释放,以致机体的免疫炎症调控系统紊乱,加重组织器官损伤,引起多器官功能的衰竭[13-14]。近些年来,由于医学研究和生活方式的不断提升,THS引起的死亡率较前已稍有下降,但发病率依旧居高不下[15]。然而,目前与THS的相关研究多局限于复苏液体的选择,在微小RNA联合信号通路方面的研究鲜少。miR-146a是近年研究炎症、免疫和肿瘤等疾病的焦点之一,在今后的个体化治疗中有很好的应用前景[16]。HUANG等[17]研究发现miR-146a在肾缺血再灌注损伤中,具有保护肾脏功能有的作用。本课题组前期研究发现miR-146a在THS肺组织炎性损伤中表达升高,但其是否参与肾组织炎性反应的调控及其初步机制尚需进一步研究。
TLRs主要通过结合病原相关分子模式,活化诸如NF-κB、丝裂原活化蛋白激酶、c-Jun N端激酶、胞外信号调节激酶等,参与感染、免疫、炎症等多种疾病的病理生理过程[18-20]。TLR4是其目前研究最为前沿的族员之一,可激活NF-κB,使其磷酸化,释放出大量炎症介质,是导致机体出现“炎症级联反应”的重要起因[21-22]。ZUSSO等[23]研究发现,TLR4/NF-κB 信号通路可能是调节促炎因子(如TNF-α和IL-1等)释放的门控通道。另外,机体内产生抑炎因子(如IL-10等)也与其关系密切[24]。因此,许多研究者开始着手探索可以干预TLR4/NF-κB 信号通路的相关药物及治疗措施,并取得了一定的成果[25-27]。
醋酸钠林格液可用于补充创伤失血性休克大鼠的有效循环血量、调节水电解质平衡、缓解微循环障碍、减轻组织器官损伤,是失血性休克复苏的一线晶体液[28]。UTI是可以抑制蛋白酶作用的一种糖蛋白,有大量研究表明其具有调节炎症反应、改善免疫功能及清除氧自由基等作用,但研究其发挥抗炎作用的机制仍存在相当大的空间。本实验在大鼠身上复制THS及其液体复苏条件,从大鼠肾组织mRNA的表达中发现了UR组TNF-α、IL-1和IL-6的表达低于SR组和AR组;而IL-4、IL-10反而高于SR组和AR组。光镜下,肾组织切片的HE染色结果也显示出UR组的肾组织病理改变较其他2组有明显减轻,表明了UTI有益于进一步削弱THS大鼠导致的肾组织炎性损伤。同时,UR组较SR组、AR组的miR-146a mRNA表达水平有明显提升;但在TLR4、NF-kB蛋白表达方面则恰恰相反。有相关文献报道[29],miR-146a减轻小肠缺血/再灌注损伤可能与抑制TLR4/NF-κB通路有关。所以,我们推测UTI在减轻失血性休克肾组织炎性损伤方面可能与其通过miR-146a作用于TLR4/NF-kB信号通路有一定的联系。
综上所述,本实验通过病理学和miR-146a、TLR4/NF-κB信号通路及相关炎症因子在创伤失血性休克肾组织中表达水平的检测,证实了UTI可以在醋酸钠林格液的基础上进一步使THS肾组织免受炎性细胞浸润损伤。同时,我们推测UTI或许通过上调miR-146a在肾组织中的表达水平,抑制下游TLR4/NF-κB信号通路的传导,继而在THS中起保护作用,从而为THS的治疗积累一定的实验素材及理论数据。但鉴于THS的发展涉及很多信号机制,仍需进一步研究探索。
