内源性神经营养因子促进冷冻保存大鼠坐骨神经异体移植后神经再生的作用
2020-04-26张松黄英如石一峰刘云霄冼华
张松,黄英如,石一峰,刘云霄,冼华
1.重庆医科大学中医药学院针灸骨伤教研室,重庆市 400016;2.中医药防治代谢性疾病重庆市重点实验室,重庆市 400016
周围神经损伤常引起支配区域运动和感觉功能缺失,致残率高。近年来,随着基因治疗和组织工程等技术的发展,周围神经损伤的治疗取得长足的进步,但周围神经缺损的修复与重建仍未取得突破[1-2]。自体神经移植是临床修复周围神经缺损(尤其是长段缺损)的金标准,但存在供区能满足移植需要的神经有限、造成新的失神经损伤等缺点,限制了临床应用。同种异体神经具有与自体神经相同的组织结构,可以为周围神经缺损修复提供各种类型的神经移植物;而周围神经冷冻保存,能够为周围神经缺损提供充足的、即时需要的各种类型的神经移植物,从而使同种异体神经代替自体神经修复周围神经长段缺损成为可能[3-4]。
去细胞神经移植物可体外长期保存,具有较低的免疫原性,异体移植后能支持受者神经轴突再生[5-6]。施万细胞是周围神经的主要结构和功能细胞,能合成和分泌多种神经营养因子(neurotrophic factors,NTFs)和黏附分子,对周围神经损伤后的神经再生极为重要[7]。去除施万细胞的周围神经,修复神经缺损特别是长段神经缺损后受者神经再生能力可能有限[8-9]。有学者在去细胞神经移植物中添加施万细胞,异体移植后的神经再生和功能恢复明显优于单纯去细胞异体移植[10]。因此,周围神经冷冻保存时维持施万细胞的生物活性,对神经移植后的神经再生具有积极作用。我们的前期研究证实[11],周围神经冷冻保存能维持施万细胞的生物活性,异体移植后的排斥反应较弱,能支持移植后的神经再生。
内源性神经营养因子(endogenous neurotrophic factors,ENTFs)是一类调节神经元生长、存活和分化的多肽类物质,主要由施万细胞合成和释放,广泛存在于动物体内多种组织中[12]。周围神经损伤后,其远端发生Wallerian变性,施万细胞失去与轴突的连接,在转录因子c-Jun的作用下去分化,转变为具有促再生表型的修复施万细胞,分泌大量活性增强的ENTFs,从而修复受损神经元,加速轴突再生[13-15]。然而,在神经移植后的局部微环境中,由于施万细胞分泌的NTFs浓度过低,可能不足以维持神经元胞体的存活和轴突再生,出现施万细胞基底膜破坏,导致远端轴突长入困难甚至移植失败[16-17]。
本研究体外预处理大鼠坐骨神经,模拟周围神经Wallerian变性,诱导施万细胞表达ENTFs,并观察施万细胞的凋亡情况和免疫原性变化,然后将表达ENTFs的周围神经冷冻保存,观察冷冻保存后神经的生物活性,及同种异体移植后对神经再生的影响,以探讨ENTFs促进冷冻保存周围神经异体移植后神经再生的可能性。
1 材料与方法
1.1 实验动物
SPF级雌性Sprague-Dawley大鼠138只,体质量(200±20) g,重庆医科大学动物中心提供,动物生产许可证号SCXK(渝)2012-0001。SPF级雌性Wistar大鼠153只,体质量(200±20)g,成都达硕实验动物有限公司提供,动物生产许可证号SCXK(川)2015-030。根据《医学实验动物管理实施细则》和重庆医科大学医学研究伦理委员会的要求,所用动物实验研究均严格按照动物福利与伦理原则处理。12 h黑白交替,相对湿度为65%~75%,室温22~24 ℃。
1.2 试剂与仪器
胶质细胞源性神经营养因子(glial cell line-derived neurotrophicfactor,GDNF)、神经生长因子(nerve growth factor,NGF)、主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅱ、CD8单克隆抗体:美 国ABCAM公 司。Bcl-2、Bax、Caspase-3、MHC-Ⅰ单克隆抗体:美国AFFⅠNⅠTY公司。CD68单克隆抗体:美国NOVUS公司。β-actin单克隆抗体:北京博奥森生物技术有限公司。GAPDH单克隆抗体、山羊抗兔ⅠgG二抗、山羊抗鼠ⅠgG二抗:美国EARTHOX公司。神经丝(neurofilament,NF)200单 克隆抗体:武汉博士德生物工程有限公司。高糖型DMEM培养基、胎牛血清(fetal bovine serum,FBS)、DMSO:美国HYCLONE公司。双抗(青霉素-链霉素):上海碧云天生物技术有限公司。海藻糖:北京索莱宝科技有限公司。乙二醇:成都市科龙化工试剂厂。triton X-100:北京鼎国昌盛生物技术有限责任公司。Calcein-AM:日本东仁化学科技有限公司。碘化丙啶(propidium iodide,PⅠ):武汉赛维尔生物科技有限公司。BCA蛋白浓度测定试剂盒:上海碧云天生物技术有限公司。大鼠白细胞介素(interleukin,ⅠL)-2、干扰素(interferon,ⅠFN)-γ、肿 瘤 坏 死 因 子(tumor necrosis factor,TNF)-α ELⅠSA试剂盒:上海沪尚生物科技有限公司。
电泳仪、凝胶成像系统:美国BⅠO-RAD公司。H-7500型透射电镜:日本HⅠTACHⅠ公司。TCS-SP2型激光扫描共聚焦显微镜:德国LEⅠCA公司。BL-420N机能实验系统:成都泰盟。BX53正置显微镜:日本OLYMPUS公司。低温高速离心机:德国SⅠGMA公司。
1.3 动物造模与分组
1.3.1 坐骨神经取材及体外预处理
将138只Sprague-Dawley大鼠适应性喂养5 d后,随机取12只备用(9只作为移植阶段供体大鼠,3只用作冻存后新鲜神经对照组),余126只2%戊巴比妥钠30 mg/kg腹腔注射麻醉,无菌条件下切取双侧坐骨神经段15 mm,0.9% NaCl注射液冲洗,切取神经后大鼠断颈处死。随机将252条坐骨神经置于含有10%FBS和1%青霉素-链霉素的高糖型DMEM预处理液中,37 ℃、5% CO2恒温培养箱培养1 d (A组,n=42)、3 d (B组,n=42)、7 d (C组,n=42)、14 d (D组,n=42)和21 d(E组,n=42),每2天换液,设置新鲜神经对照组(F组,n=42)。
1.3.2 冷冻保存液配制、坐骨神经冷冻保存及复温
在高糖型DMEM溶液(含0.2 mol/L海藻糖、10%FBS、1%青霉素-链霉素)中分别加入5%乙二醇和5%DMSO、10%乙二醇和10% DMSO、20%乙二醇和20%DMSO,配制成含5%、10%、20%冷冻保护剂的冷冻保存液。
将上述6组坐骨神经依次分别置于含5%、10%冷冻保护剂的冷冻保存液中室温静置各10 min,然后置于含20%冷冻保护剂的冷冻保存液中,4 ℃放置30 min,-20 ℃放置1 h,-80 ℃放置1 h,最后将其置于液氮中保存4周。
坐骨神经在液氮中保存4周后,置于37 ℃水浴锅中复温3 min,然后依次置于含10%、5%冷冻保护剂的冷冻保存液中各10 min,最后置于高糖型DMEM溶液(含10%FBS和1%青霉素-链霉素)中。
1.3.3 移植术受体分组及手术方法
健康成年SPF级雌性Wistar大鼠153只,其中144只作为受体大鼠,9只作为供体大鼠。另取上述9只Sprague-Dawley大鼠为供体大鼠。用上述冷冻保存后的A组、B组、C组、D组、E组、F组坐骨神经(每组取18条)和9只Sprague-Dawley大鼠新鲜坐骨神经(G组,n=18)修复对应Wistar大鼠(A′组、B′组、C′组、D′组、E′组、F′组、G′组)坐骨神经10 mm缺损,设置Wistar大鼠同系移植对照组(H′组),每组18只。
手法方法:受体大鼠术前禁食12 h,2%戊巴比妥钠30 mg/kg腹腔注射麻醉,剃毛,常规消毒、铺巾,于右股后外侧行斜行切口,沿肌间隙钝性分离,暴露、游离坐骨神经干,于梨状肌下缘5 mm处整齐切除坐骨神经造成10 mm缺损;将供体神经段整齐修剪至10 mm,6倍手术显微镜下,以9-0带线缝合针行神经外膜无张力间断缝合4~6针,0.9%氯化钠注射液冲洗术区,4-0缝合线逐层缝合,麻醉苏醒后按组分笼饲养。手术均由同一人操作完成,术后大鼠均不做特殊处理。
1.4 检测指标
1.4.1 Western blotting
冷冻保存前,取各组神经组织约30 mg (从18条坐骨神经中取出),剪碎,加入10 ml/kg裂解液,冰上裂解15 min,匀浆后4 ℃静置1 h,4 ℃、12 000 r/min离心15 min,取上清,BCA蛋白浓度测定试剂盒检测浓度。
上样量100 μg,12% SDS-PAGE凝胶电泳,70 V电泳30 min后100 V电泳80 min,恒流300 mA转膜90 min至PVDF膜上,5%脱脂牛奶室温封闭2 h,TBST洗膜,加一抗(GDNF 1∶5000;NGF 1∶10000;Bcl-2 1∶1000;Bax 1∶1000;Caspase-3 1∶1000;βactin 1∶5000;MHC-Ⅰ1∶2000;MHC-Ⅱ1∶1000;GAPDH 1∶5000)4 ℃孵育过夜,TBST洗膜,加相应二 抗(山羊抗兔ⅠgG 1∶10000;山羊抗鼠ⅠgG 1∶10000)室温孵育2 h,TBST洗膜,ECL显色,凝胶成像系统成像,GDNF、NGF、Bcl-2、Bax、Caspase-3以β-actin为内参,MHC-Ⅰ、MHC-Ⅱ以GAPDH为内参;用Ⅰmage J软件进行定量分析,分别用目的蛋白与内参蛋白的灰度值比值表示蛋白的相对表达量。生物学重复6次。
1.4.2 冷冻保存后坐骨神经生物活性
Calcein-AM/Propidium Ⅰodide荧光染色,激光共聚焦显微镜观察冷冻保存后坐骨神经细胞存活与死亡情况。取上述冷冻保存4周后未用于移植的坐骨神经,每组6条,复温,另取上述备用3只Sprague-Dawley大鼠,切取坐骨神经6条作为新鲜神经对照组(G组),剪切成长3 mm神经段,室温下1% triton X-100通透30 min,PBS缓冲液冲洗,Calcein-AM 20 μmol/L避光孵育30 min,PBS缓 冲液冲洗,Propidium Ⅰodide 100 μg/ml避光孵育15 min,PBS缓冲液避光冲洗,防荧光淬灭甘油封片,激光共聚焦显微镜观察荧光强度,激发波长490 nm (绿色荧光)和535 nm (红色荧光),活细胞呈绿色荧光,死细胞呈红色荧光。
1.4.3 移植后一般情况
观察移植后大鼠术口愈合、足趾溃疡、移植侧肌肉萎缩情况,取材时观察移植神经断端吻合情况及粘连情况。
1.4.4 移植术后免疫排斥反应
移植术后1周,每组选取6只大鼠,2%戊巴比妥钠30 mg/kg腹腔注射麻醉,于右股后外侧原切口进入,沿肌间隙钝性分离,暴露、分离移植侧坐骨神经段,切取移植神经段8 mm,4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋,纵切5 μm;脱蜡后,PBS缓冲液冲洗5 min×4次,山羊血清37 ℃封闭1 h,加一抗(CD81∶100;CD681∶100)孵育过夜,PBS缓冲液冲洗5 min,共4次,加相应荧光二抗37 ℃避光孵育1 h,PBS缓冲液避光冲洗5 min,共4次,滴加防荧光淬灭甘油封片,荧光显微镜下观察拍照。
移植术后1周,上述大鼠截取移植神经段后,心脏取血,室温下静置20 min后,3000 r/min离心20 min,取上清,ELⅠSA检测ⅠL-2、ⅠFN-γ、TNF-α水平。
1.4.5 移植术后电生理检测
移植术后20周,每组取6只大鼠,2%戊巴比妥钠30 mg/kg腹腔注射麻醉,于右股后外侧原切口进入,沿肌间隙钝性分离,暴露、分离移植坐骨神经段,于梨状肌下缘3 mm处神经干放置刺激电极,同侧外踝关节上10 mm腓肠肌上放置接收电极,地线远离两电极接地,刺激电流4 mA,刺激频率1 Hz。用BL-420N生物信号采集与分析系统测定肌肉复合动作电位(compound muscle action potential,CMAP)和神经传导速度(nerve conduction velocity,NCV)。
1.4.6 移植术后腓肠肌肌肉湿重比
电生理检测后,完整剥离上述大鼠双侧腓肠肌,吸干其表面残留液体并称重,以自身非移植侧作为对照,计算移植术后各组腓肠肌湿重比。

1.4.7 移植术后再生神经NF200免疫荧光染色
电生理检测后,切取上述大鼠移植神经段8 mm,按照上述免疫荧光染色法(一抗NF200 1∶100),荧光显微镜观察移植神经NF200荧光强度。
1.4.8 移植术后再生神经组织学分析
移植术后20周,每组取6只大鼠,切取大鼠移植神经段8 mm,2%戊二醛4 ℃固定过夜,1%锇酸固定2 h,梯度丙酮脱水,环氧树脂包埋。半薄切片,甲苯胺蓝染色,CCD光谱测量系统,每个样本随机选5张切片,每张切片随机取5个视野,采用Ⅰmage-Pro Plus 6.0分析再生有髓神经纤维数量;每组选取两个样本,超薄切片、醋酸铀-柠檬酸铅双重染色,透射电镜观察再生神经超微结构,Ⅰmage-Pro Plus 6.0计算再生神经髓鞘厚度。
1.5 统计学分析
2 结果
2.1 Western blotting
GDNF蛋白表达从高到低依次为:D组、C组/E组、A组(P<0.05);C组、D组和E组与F组比较均有显著性差异(P<0.05)。NGF蛋白表达从高到低依次为:D组、C组、E组、A组(P<0.05);C组、D组和E组与F组比较均有显著性差异(P<0.05)。见图1、表1。

图1 各预处理组坐骨神经GDNF、NGF蛋白表达

表1 各预处理组坐骨神经GDNF、NGF蛋白表达
Bax蛋白表达从高到低依次为:E组、C组/D组、A组/B组(P<0.05);与F组相比,B组、C组、D组和E组表达均增加(P<0.05),A组与F组比较无显著性差异(P >0.05)。Bcl-2蛋白表达从低到高依次为:D组/E组、C组、A组/B组(P<0.05);与F组相比,B组、C组、D组和E组表达下降(P<0.05),A组与F组比较无显著性差异(P >0.05)。Bax/Bcl-2比值与Bax蛋白表达趋势基本一致。Caspase-3蛋白表达从高到低依次为:D组/E组、B组/C组、A组(P<0.05);与F组相比,B组、C组、D组和E组表达增加(P<0.05),A组与F组比较无显著性差异(P >0.05)。见图2、表2。
在预处理组中,MHC-Ⅰ表达从低到高依次为D组/E组、B组/C组、A组(P<0.05);MHC-Ⅱ表达则为E组、D组、A组/B组(P<0.05)。与F组相比,A组~E组MHC-Ⅰ、MHC-Ⅱ蛋白表达均下降(P<0.05)。见图3、表3。
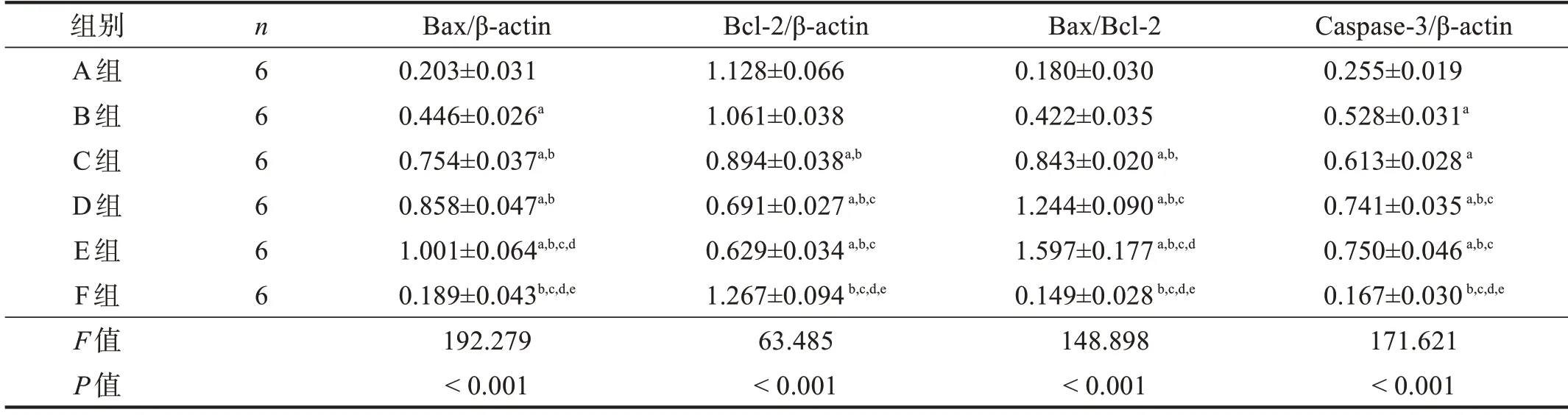
表2 各预处理组坐骨神经Bcl-2、Bax、Caspase-3蛋白表达

图2 各预处理组坐骨神经Bcl-2、Bax、Caspase-3蛋白表达
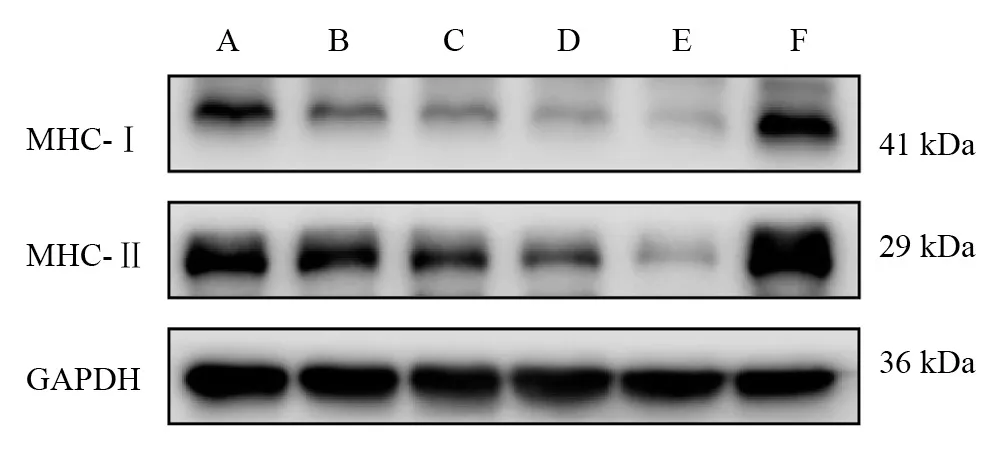
图3 各预处理组坐骨神经MHC-Ⅰ、MHC-Ⅱ蛋白表达
2.2 冷冻保存坐骨神经细胞生物活性
G组神经纤维绿色荧光强、分布广泛,可见零星红色荧光分布。A组~F组仍可见神经纤维绿色荧光,但荧光强度较G组弱,红色荧光较G组多。与F组相比,A组~E组绿色荧光强度减弱,红色荧光强度增强,其中,A组绿色荧光强度最强,红色荧光强度最低,B组次之,C组、D组和E组最差。见图4。
2.3 同种异体神经移植后检测
2.3.1 移植后一般情况
实验期间大鼠无死亡,术后伤口无感染和坏死。同种异体移植术后1周,各组移植神经段稍肿胀,与周围组织无粘连。移植术后3周,各组右下肢肌肉出现不同程度的萎缩,除H′组外,其余各组(A′组4只、B′组4只、C′组3只、D′组2只、E′组2只、F′组5只、G′组5只)移植侧出现足趾红肿、溃疡、缺失等改变,术后8~10周以后溃疡陆续愈合。移植术后20周,各组移植神经段与周围组织均出现不同程度粘连,G′组粘连最重,F′组次之,H′组最轻,远近端吻合口稍膨大,无神经瘤形成。

表3 各预处理组坐骨神经MHC-Ⅰ、MHC-Ⅱ蛋白表达
2.3.2 免疫排斥反应
移植术后1周,H′组血清中ⅠL-2、ⅠFN-γ、TNF-α水平较低,G′组较高。与G′组相比,C′组、D′组、E′组ⅠL-2、ⅠFN-γ、TNF-α水平降低(P <0.05)。与F′组相比,C′组、D′组、E′组ⅠL-2水平降低(P <0.05),E′组ⅠFN-γ 水平降低(P <0.05),C′组、D′组、E′组TNF-α水平降低(P <0.05),其他组间比较均无显著性差异(P >0.05)。在各预处理冷冻保存移植组中,D′组、E′组ⅠL-2水平较低,A′组、B′组、C′组较高(P <0.05);各组间ⅠFN-γ 水平无显著性差异(P >0.05);D′组、E′组TNF-α 水平最低,C′组次之,A′、B′组最高(P <0.05)。见表4。
2.3.3 电生理检测
H′组CMAP、NCV较优,G′组和F′组较差,但D′组、H′组间和F′组、G′组间均无显著性差异(P >0.05)。与F′组相比,B′组、C′组、D′组和E′组CMAP、NCV较优(P <0.05),A′组与F′组间无显著性差异(P >0.05);在预处理冷冻保存移植组中,D′组CMAP、NCV最优,C′组和E′组次之,A′组和B′组最差(P <0.05)。见图7、表5。
2.3.4 腓肠肌肌肉湿重比
H′组腓肠肌湿重比较高,G′组和F′组较低,但D′组与H′组间和F′组与G′组间均无显著性差异(P >0.05)。与F′组相比,C′组、D′组和E′组腓肠肌湿重比较高(P <0.05),但A′组、B′组、F′组间无显著性差异(P >0.05);在预处理冷冻保存移植组中,D′组腓肠肌湿重比最高,C′组、E′组次之,A′组、B′组最差(P <0.05)。见表6。
2.3.5 再生神经NF200
H′组绿色荧光强度最高、分布均匀,G′组荧光强度最低、散在分布。与H′组相比,A′组~F′组绿色荧光较弱。与F′组相比,A′组~E′组绿色荧光较强;在各预处理冷冻保存移植组中,D′组绿色荧光强度最高、分布均匀,C′组次之,A′组和B′组最差。见图8。
2.3.6 再生神经组织学分析
H′组有髓神经纤维数最优,G′组最差,但D′组和H′组间无显著性差异(P >0.05)。与F′组相比,B′组、C′组、D′组和E′组有髓神经纤维数较多(P <0.05),但A′组与F′组间无显著性差异(P >0.05)。在各预处理冷冻保存移植组中,D′组有髓神经纤维数最多、分布均匀,C′组和E′组次之,A′组和B′组最差(P <0.05)。见图9、表7。
H′组和D′组可见大量有髓神经纤维,纤维粗细均匀,髓鞘厚;C′组和E′组再生有髓神经纤维数量较多,分布广泛、髓鞘较厚;A′组和B′组再生有髓神经纤维数量较少,分布较广泛,髓鞘较薄;G′组再生有髓神经纤维数量少,直径细,髓鞘薄,分布稀疏。H′组有髓神经纤髓鞘厚度最优,G′组最差,但D′组与H′组间无显著性差异(P >0.05)。与F′组相比,B′组、C′组、D′组和E′组有髓神经纤髓鞘厚度较优(P <0.05),但A′组与F′组间无显著性差异(P >0.05)。在各预处理冷冻保存移植组中,D′组有髓神经纤髓鞘厚度最优,C′组和E′组次之,A′组和B′最差(P <0.05)。见图10、表7。

表4 移植术后1周,各组血清IL-2、IFN-γ、TNF-α水平(ng/L)

表5 移植术后20周各组CMAP和NCV比较
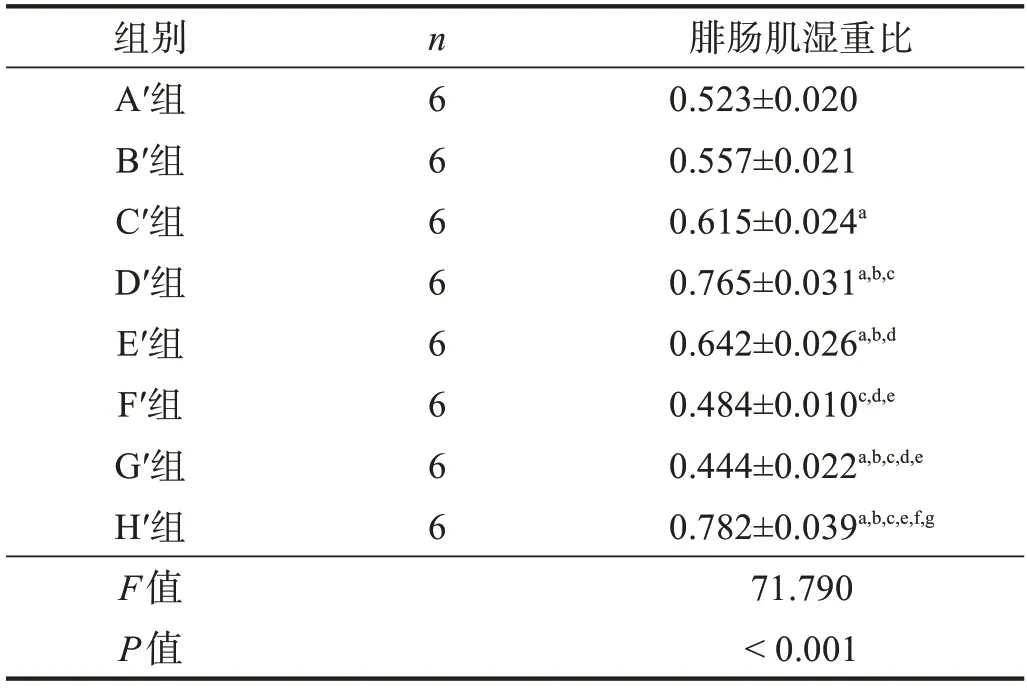
表6 移植术后20周各组腓肠肌湿重比

表7 移植术后20周各组轴突密度与髓鞘厚度比较
3 讨论
自体神经移植因来源有限、供区并发症等缺点,不能满足临床对周围神经缺损,尤其是长段缺损修复的需要。同种异体神经具有与自体神经相同的组织结构,可能是自体神经理想的替代物。周围神经冷冻保存可以为临床提供神经缺损修复所需要的神经移植物,从而使同种异体神经代替自体神经修复周围神经长段缺损成为可能[3-4]。
去细胞神经具有低免疫原性,同时神经内部的三维支架结构和细胞外基质的活性成分得以保持,并且可以体外长期保存,异体移植后能支持受者神经轴突再生[5-6]。有学者在去细胞神经移植物中添加NTF,移植后的神经再生优于单纯去细胞异体神经移植[18]。然而,NTFs半衰期短,如何在去细胞移植物中长期稳定释放是运用的难点[19-20]。运用控释技术将GDNF复合到去细胞神经移植物中,GDNF的长期持续释放促进移植后的神经再生和功能恢复[21]。因此,NTFs的持久释放对周围神经长段缺损修复后的轴突再生尤为重要。
施万细胞是周围神经的主要结构和功能细胞,能合成和分泌多种NTFs和黏附分子,对周围神经损伤后的神经再生具有非常重要的作用[7]。有研究证实,在去细胞的神经移植物中添加施万细胞,术后受体神经再生明显优于单纯去细胞异体神经移植[10]。因此,周围神经冷冻保存时维持施万细胞的生物活性,对神经移植后的神经再生具有积极作用。我们的前期研究发现,周围神经冷冻保存能维持施万细胞的生物活性,异体移植后的排斥反应较弱,能支持移植后的神经再生[11]。
本研究体外预处理大鼠坐骨神经,体外模拟周围神经Wallerian变性,诱导施万细胞表达ENTFs,然后将表达ENTFs的周围神经冷冻保存,最后将冷冻保存后的神经进行同种异体移植,结果发现,体外预处理大鼠坐骨神经能诱导其施万细胞表达ENTFs;高表达ENTFs的坐骨神经Bcl-2表达下降,Bax、Caspase-3表达增加,Bax/Bcl-2比值增高,MHC-Ⅰ、MHC-Ⅱ表达下降;高表达ENTFs的坐骨神经冷冻保存4周后,虽然存活施万细胞数量减少,但同种异体移植后免疫反应较弱,能促进移植后受者神经再生和功能恢复。

图4 各组坐骨神经比较(Calcein-AM/Propidium Ⅰodide染色,激光共聚焦显微镜,×400,bar=50µm)
ENTFs主要由施万细胞合成和释放,施万细胞作为周围神经的主要结构和功能细胞,在生理条件下经逆向运输ENTFs至神经元胞体,提供营养支持,促进神经元成熟、分化[22];周围神经损伤后,轴突、髓鞘崩解,其远端发生Wallerian变性,施万细胞在转录因子c-Jun的作用下去分化,转变为具有促再生表型的修复施万细胞,释放大量ENTFs,如GDNF、NGF等,这些ENTFs在周围神经损伤后对施万细胞的存活、轴突的生长和走向起着十分重要的营养和诱导作用[23-24]。GDNF能促进运动神经元的存活[25];NGF能促进感觉神经元的存活[26]。然而,在同种异体神经移植后的局部微环境中,由于施万细胞分泌的NTFs浓度过低,可能不足以维持神经元胞体的存活和轴突再生,出现施万细胞基底膜破坏,导致远端轴突长入困难甚至移植失败[16-17]。因此,促进周围神经施万细胞分泌ENTFs可能会改善神经异体移植后的轴突再生和功能恢复。

图5 移植术后1周A′~D′组移植神经段CD8+T细胞、巨噬细胞入侵情况(免疫荧光染色,×200)
本研究通过体外预处理大鼠坐骨神经不同时间,模拟周围神经Wallerian变性,诱导其施万细胞表达ENTFs,结果显示,体外预处理7 d以上可促进坐骨神经ENTFs表达,以14 d效果最佳。随后将预处理后表达ENTFs的坐骨神经冷冻保存4周,同种异体移植修复坐骨神经缺损,结果显示,表达ENTFs的坐骨神经再生有髓神经纤维数量多、髓鞘厚,CMAP高,NCV快,以预处理14 d效果最佳。
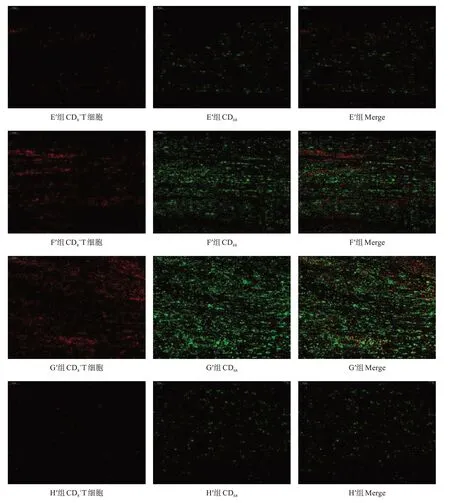
图6 移植术后1周E′~H′组移植神经段CD8+T细胞、巨噬细胞入侵情况(免疫荧光染色,×200)
ENTFs主要由施万细胞合成和释放,施万细胞的存活情况在一定程度上决定损伤周围神经的再生潜能。细胞凋亡的发生是在多种凋亡相关基因的调控下进行的,Bcl-2、Bax与神经元的存活关系密切,二者之间的比值决定细胞是凋亡还是存活[27];而Caspase-3的激活在神经元凋亡中起着极其重要的作用,被认为是细胞死亡前的终末事件[28-29]。

图7 移植术后20周各组CMAP波形
本研究检测预处理神经Bcl-2、Bax蛋白表达,结果显示:与新鲜神经对照组(F组)相比,坐骨神经预处理组中7 d组、14 d组和21 d组Bcl-2表达下降,Bax表达增强,Bax/Bcl-2比值升高。同时,我们还检测Caspase-3蛋白表达,与新鲜神经对照组(F组)相比,坐骨神经预处理组中7 d组、14 d组和21 d组Caspase-3表达也增强,这与Bax表达、Bax/Bcl-2比值结果一致。将预处理坐骨神经冷冻保存4周后,Calcein-AM/Propidium Ⅰodide荧光染色观察保存后神经的细胞存活情况,结果显示,与新鲜神经冷冻保存组(F组)、新鲜神经组(G组)相比,各预处理冷冻保存组神经纤维绿色荧光(代表活细胞)减弱,红色荧光(代表死细胞)增强;在预处理冷冻保存组中,1 d组绿色荧光强度最强,红色荧光强度最低,3 d组次之,7 d组、14 d组、21 d组最差。这与预处理神经施万细胞凋亡情况一致。这些结果表明,预处理时间将影响坐骨神经施万细胞的存活。
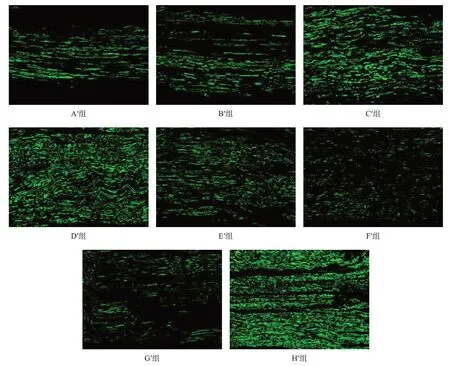
图8 移植术后20周各组移植神经段再生神经NF200(免疫荧光染色,×400)
免疫排斥反应是异体组织器官移植成功的关键。异体组织器官移植后的免疫反应包括体液免疫反应和细胞免疫反应。目前认为细胞免疫应答是同种异体神经移植产生免疫排斥反应的主要机制,T细胞和T细胞是主要的效应细胞[30]。活化的T细胞通过释放ⅠL-2、ⅠFN-γ 和TNF-α 等炎性细胞因子募集和活化巨噬细胞,引起宿主炎性细胞浸润和移植组织损伤[31];而T细胞则可通过分泌穿孔素、颗粒酶等物质直接杀伤宿主靶细胞[32-33]。在移植免疫反应中,T细胞识别MHC-ⅠⅠ分子,而T细胞识别MHC-Ⅰ分子[34],移植物MHC-Ⅰ、MHC-ⅠⅠ水平的高低在很大程度上决定移植后排斥反应的强弱[35]。施万细胞作为周围神经的抗原提呈细胞(antigen-presenting cell,APC),除了具有表达MHC-Ⅰ类分子外,还具有表达MHC-ⅠⅠ类分子的能力,是异体神经移植后出现免疫排斥反应的主要原因[36]。
本研究检测预处理神经MHC-Ⅰ、MHC-Ⅱ分子表达,结果显示:各预处理组神经的MHC-Ⅰ、MHC-Ⅱ蛋白表达均低于新鲜神经对照组(F组),表明预处理后的周围神经具有较低的免疫原性,这些神经在冷冻保存后可能对减轻神经异体移植后的排斥反应具有重要的作用。同时,本研究还检测Bcl-2、Bax和Caspase-3蛋白表达,结果显示:预处理组中7 d组、14 d组和21 d组Bcl-2表达降低,Bax、Caspase-3表达均增加。预处理神经的MHC-Ⅰ、MHC-Ⅱ蛋白表达下降可能与预处理过程中施万细胞凋亡增加有关。随后,将预处理后表达ENTFs的坐骨神经冷冻保存4周,预处理组中7 d组、14 d组和21 d组神经的活细胞明显低于新鲜神经冷冻保存组(F组)和新鲜神经组(G组),这与预处理阶段各组施万细胞凋亡情况一致。最后,本研究观察预处理冷冻保存的坐骨神经异体移植后排斥反应和受者神经再生情况,结果显示:移植术后1周,与新鲜神经冷冻保存移植组(F′组)、同种异体新鲜移植组(G′组)相比,预处理冷冻保存移植组(A′~E′组)移植物中T细胞、巨噬细胞入侵及受者血清ⅠL-2、ⅠFN-γ、TNF-α水平较低,尤其是7 d移植组、14 d移植组和21 d移植组更低;移植术后20周,预处理冷冻保存移植组中7 d移植组、14 d移植组和21 d移植组受者神经再生和功能恢复优于新鲜神经冷冻保存移植组(F′组)和同种异体新鲜移植组(G′组)。这些结果说明,冷冻保存后的具有较低免疫原性的预处理神经,异体移植后受者排斥反应降低,促进了移植后受者神经的再生和功能恢复。

图9 移植术后20周各组移植神经段再生神经(甲苯胺蓝染色,bar=50 μm)
ENTFs主要由施万细胞合成和释放,施万细胞的活性在一定程度上决定周围神经移植物的再生潜能。然而,施万细胞作为周围神经的主要表达MHC-Ⅰ、MHC-Ⅱ抗原分子的细胞,是同种异体移植后出现免疫排斥反应的主要原因[37]。如果将周围神经施万细胞的活细胞控制在一定的范围内,则可能既降低周围神经免疫原性又保留其存活施万细胞在异体移植后持续分泌ENTFs的能力,这对异体移植后的受者神经再生和功能恢复具有重要意义。在本研究中,体外预处理大鼠坐骨神经成功地诱导其ENTFs表达,高表达ENTFs的坐骨神经虽然活细胞减少,但其免疫原性也下降,异体移植后排斥反应降低,能促进移植术后受者神经再生和功能恢复。然而,能高表达ENTFs的预处理坐骨神经存活的施万细胞却减少,是因预处理时间较长导致坐骨神经的存活施万细胞减少,还是因预处理液中的营养成分不足以维持长时间体外培养过程中施万细胞存活?还需进一步研究并探讨其可能机制和改进措施。

图10 移植术后20周各组移植神经段再生神经(透射电镜,×6000,bar=2 μm)
