经皮椎间孔镜与腰椎融合手术治疗巨大型腰椎间盘突出症的疗效比较
2020-04-23杨刚田雅峰于健韩昆朱艳风董军格
杨刚 田雅峰 于健 韩昆 朱艳风 董军格
经皮脊柱内镜技术对椎管内进行减压的概念最早是由Kambin等[1-4]提出来的。该技术从经皮椎间盘切除术发展到杨氏技术(YESS)[5,6],再发展到了目前应用范围最广的经皮椎间孔镜技术(TESSYS)[7]。椎间孔镜(PELD)手术与传统开放手术相比因其疗效好、切口小,失血少、恢复快,已经得到了广大临床工作者的认同。但是对于患有巨大型椎间盘突出的患者,因突出到椎管内的髓核体积较大、导致术中术者可操作空间小、通道移动范围有限、手术可视范围较小,能否彻底的切除突出到椎管内的巨大髓核是每个手术医师不得不面临和思考的问题。本研究回顾性研究了67例分别行两种手术的巨大型腰椎间盘突出患者,旨在对比PELD与传统的开放融合手术对于治疗巨大型腰椎间盘突出患者的临床疗效以及优缺点,为临床工作的实际提供参考。
1 资料与方法
1.1 一般资料 选择2014年2月至2018年1月我院田雅峰主任行腰椎手术的67例巨大腰椎间盘突出患者的临床信息资料进行了回顾性分析。 根据手术方法分为PELD组(n=36)和腰后路椎板减压植骨融合内固定术(PLIF组,n=31),其中 PELD组中L3~4节段5例,L4~5节段21例,L5~S1节段10例;PLIF组中 L3~4节段3例,L4~5节段19例,L5~S1节段9例。本研究已经河北省中医院伦理委员会批准。
1.2 纳入与排除标准
1.2.1 纳入标准:①影像学显示单节段的巨大型腰椎间盘突出患者(经2名临床医师对术前的腰椎MRI手术节段轴位像进行分析,确认突出的髓核面积占椎管面积>50%);②患者在行手术治疗前接受了至少3个月的正规、系统的保守治疗后症状不缓解;③过伸过屈位腰椎X线无腰椎不稳;④无椎体畸形。
1.2.2 排除标准:①椎间盘突出合并椎体结核、退化性畸形、半椎体畸形、腰椎管狭窄;②既往行腰椎手术病史,二次或多次复发的腰椎间盘突出患者;③≥2个相邻节段的腰椎间盘突出患者。
1.3 手术方法
1.3.1 PELD组:患者取轻度屈髋屈膝俯卧位, C型臂下定位手术节段,透视腰椎正位,通过克氏针标记三条线,一条为脊柱正中线,一条为手术节段下一椎体的上缘的水平线,一条为通过此节段下一椎体患者患侧上关节突上缘与前两条线相交点的连线,以交点为起点沿第三条线延伸13 cm处为穿刺线,透视腰椎侧位,标记手术节段上下相邻椎体关节突后缘连线,定位完成后,局部麻醉,在 C型臂的引导下将18 G穿刺针由浅入深穿刺至下位椎体的上关节突的前上缘,至下一椎体的后上缘,以穿刺针为中心行一长8 mm的横行切口,拔出穿刺针插入导丝,保留导丝,拔出穿刺针,以导丝为中心双级扩张导管行通道扩张,环锯切割扩大椎间孔, 置入工作通道。 用髓核钳将髓核摘出,咬钳咬除黄韧带,探查和松懈神经根及硬硬脊膜,若有出血则电凝止血,同时修整纤维环裂口,如有椎间盘钙化,则用环锯及咬钳将钙化椎间盘咬除。在确认巨大髓核清除干净、神经根充分减压后将工作通道移出。 伤口缝合一针。
1.3.2 PLIF组:患者全身麻醉后取俯卧位,C型臂定位手术节段,以手术节段为中心腰后正中线行一长约5 cm皮肤切口。切开筋膜,棘上韧带逐层剥离两侧椎旁肌肉,暴露出棘突、双侧椎板及双侧关节突关节。在C型臂引导下置入椎弓根螺钉。切除棘突及双侧椎板、下关节突,切除增生肥厚黄韧带,椎间孔修整,神经根松懈, 用髓核刮匙将此节段髓核清除,填入椎间融合器,加压固定双侧连接棒。
1.4 观察指标 对2组患者进行术前、术中、术后手术时间、术中出血量、放射暴露量、 VAS评分[8]、 JOA评分、 ODI指数[9]、住院时间, MacNab评分进行比较。MacNab评分判定疗效: 优,无痛,活动无限制;良,生活中偶尔出现腰腿痛的症状,但是不影响患者的正常生活;可,术后肢体功能改善,但仍会出现间歇性疼痛,患者通常需要改变原本的生活工作方式;差,症状较前无些许改善,需要再次行手术治疗[10]。术后均随访12个月。所有的数据都是由两名未参与实验设计的医生收集的。数据由另外一名医生进行分析。

2 结果
2.1 一般情况 2组手术患者术前患病节段分布比例差异无统计学意义(P>0.05),但是PELD组平均年龄小于PLIF组,差异有统计学意义(P<0.05);PELD组患者手术时间、术中出血量、住院时间PELD组明显小于PLIF组,差异有统计学意义(P<0.05);射线暴露量PELD组大于PLIF组(P<0.05)。见表1。
2.2 疗效比较 2组患者末次随访时下肢VAS评分较术前减轻(P<0.05),2组间比较差异无统计学意义(P>0.05);末次随访腰VAS评分较术前减轻(P<0.05),PELD组患者术后腰VAS评分低于PLIF组(P<0.05);末次随访JOA评分较术前增高(P<0.05),组间比较差异无统计学意义(P>0.05);末次随访ODI指数比术前降低(P<0.05),组间比较差异无统计学意义(P>0.05);末次随访时2组患者之间临床疗效评分比较:下肢VAS评分、JOA评分、ODI指数差异无统计学意义(P>0.05),腰VAS评分差异有统计学意义(P<0.05)见表2。

表1 2组患者数据比较

表2 2组患者术前及末次随访评分比较
2.3 2组MacNab评分比较 2组MacNab评分比较差异无统计学意义(P>0.05)。见表3。

表3 2组患者MacNab 评分比较 例
2.4 并发症 在PELD组中,3名术后患者出现并发症。有1例患者术后出现鞍区麻木、大小便无力感,术后给与患者2次/d针灸治疗,取穴如下:双刺次髎、委中、志室、关元、中极等,直刺1~1.5寸,留针20 min,1个月后患者症状好转。1例患者术后第2天的出口根神经支配区疼痛加重,经过5 d的10 mg地塞米松和250 ml甘露醇进行静脉滴注后缓解。最后1例患者术中硬脊膜撕裂,术后给予1 000 ml的葡萄糖氯化钠注射液静脉滴注1次/d补液,给以注射用头孢替唑钠抗生素2.0 g静脉滴注Q12 h以预防感染。在PLIF组,1例患者术后3个月复查腰椎CT平扫示椎间未融合导致腰椎不稳,行二次手术前路融合,术后患者恢复可。见图1、2。
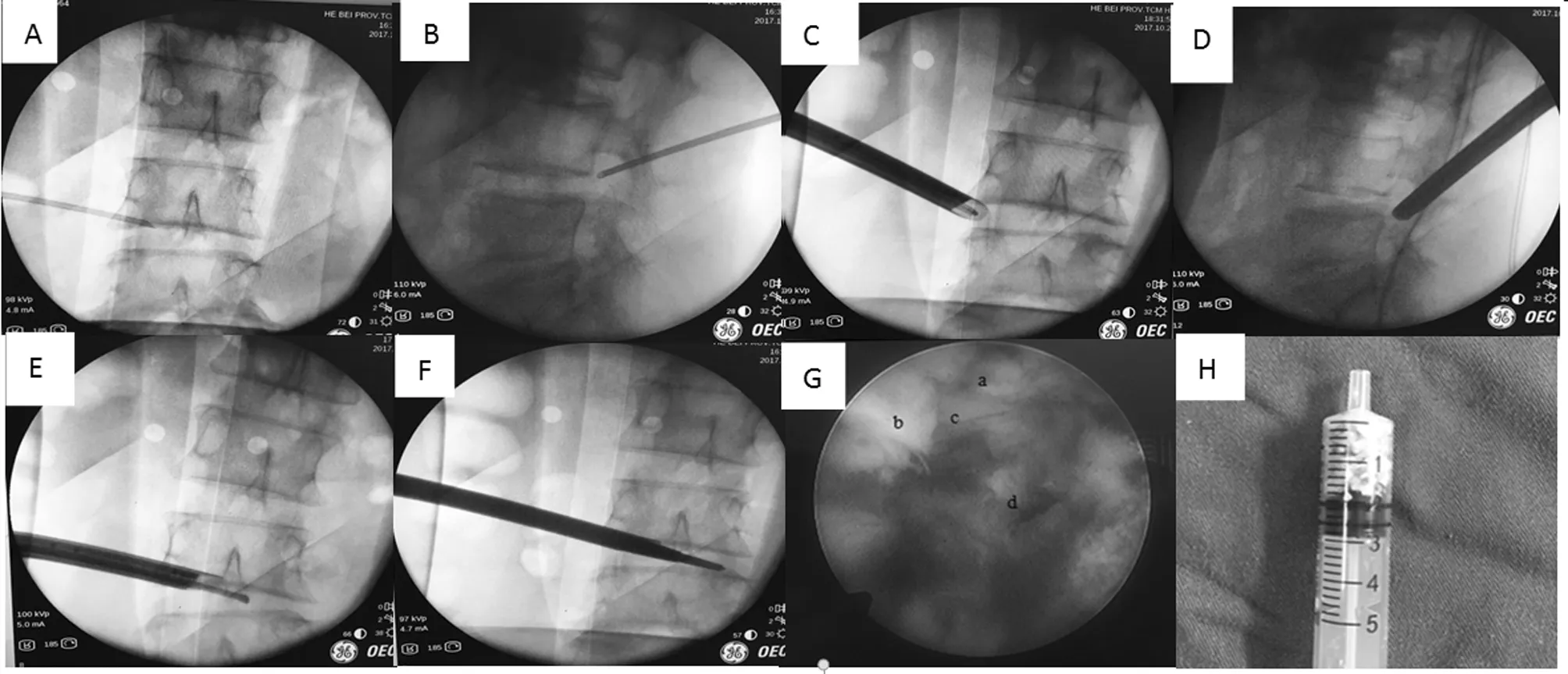
图1 穿刺针位置及手术方法。正侧位X线示穿刺针位置(A、B);将上关节突的上内侧壁切除来扩大椎间孔以置入工作通道,通道以置入椎间孔位置(C、D);由外至内逐步切除突出的巨大椎间盘(E);逐步切除巨大椎间盘至对侧,行对侧神经根减压(F);术中镜下:神经根(a),黄韧带(b),硬脑膜(c),突出的椎间盘(d)(G)取出的髓核(H)
3 讨论
当突出占椎管面积>50%时可诊断为巨大腰椎椎间盘突出[11],巨大的髓核突出会导致腰及双下肢的剧烈疼痛,往往保守治疗效果不理想,传统的开放性腰椎融合内固定手术被认为是治疗腰椎间盘突出症的金标准[12]。巨大的腰椎间盘突出手术软组织剥离范围大,肌肉损伤重,术后瘢痕形成,遗留腰痛症状。而且因为进行了手术节段的融合,会提高相邻节段退变的发生率。因此微创技术变得越来越流行,其中椎间孔镜技术效果尤其突出,椎间孔镜手术的原理是在局部麻醉下通过工作通道通过安全三角将髓核取出,手术过程中没有椎旁肌及椎板的破坏,不破坏原有的脊柱生理结构,相邻节段的椎间盘退变发生率较开放内固定手术低,术后腰部持续疼痛的发生率也较低。
1973年,Kambin和Hijikata首次提出了通过后外侧入路对椎管内进行减压的经皮脊柱内镜的概念[1-4],20世纪90年代Kambin等[13,14]再次提出椎间孔镜手术与传统的开放手术相比。有关椎间孔镜的研究最近几年也变得非常流行[15-17]。与传统的开放手术相比,椎间孔镜技术具有软组织创伤小、术中出血量少、下地活动早、相邻节段退变发生率低等优势[18,19]。因为开放手术中对椎旁肌的损伤及椎板、关节突关节的破坏以及术后瘢痕组织的形成,术后腰痛是开放性腰椎手术患者常见的术后并发症[20,21]。而椎间孔镜技术因为是通过椎间孔进行髓核摘除,术中腰后方的肌肉创伤小,所以术后患者持续腰后方肌肉疼痛发生率明显低于开放性手术,对于其中一小部分人出现腰痛症状可能是由于椎间盘的破坏导致的椎间盘源性腰痛或者是术中环锯对上关节突内侧及韧带的破坏导致[22,23]。但是受条件所限,仅限于简单的较小的腰椎间盘突出症患者。

图2 术前术后影像检查。术前矢状位MRI示L4/L5突出(A);术前轴位MRI示巨大椎间盘突出(B);术前CT 示L4/L5突出(C);术后2天复查CT示L4/5巨大突出已经取出,L4、L5神经根松懈(D)
随着椎间孔镜技术的发展以及器械的更新,椎间孔镜手术在临床上的应用范围也是越来越广,2007年Lee等[24]报道了椎间孔镜手术与开放手术分别治疗向上下远处游离的腰椎间盘突出的临床疗效,术前根据脱出的髓核游离的方向和距离进行分区,1、3区游离型椎间盘突出患者适合行PELD治疗。在2016年,Li等[25]报道了85例伴有恻隐窝狭窄的腰椎间盘突出患者行PELD手术的疗效,术后优良率90.6%,仅有3人(3.5%)术后症状不缓解。2017年Sun等[26]报道了对了相邻节段退变患者(ASD)进行椎间孔镜手术在手术时间、术中出血量、住院时间有优势的情况下临床疗效不次于甚至优于开放椎间融合手术。
因为穿刺点的定位以及置入通道需要,根据周跃等[28]2010年的一项研究,为有针对性的穿刺和套管插入而进行的X射线荧光镜的次数最高可高达32次。但是目前随着技术的成熟以及器械的不断发展均可以减少X射线照射剂量,在我们的此次研究中,PELD组X光照射次数为(10.3±2.4)次,同时计算比较了术中辐射剂量总量,剂量为(11.1±2.7)mGy。
PELD手术的优势:(1)术中不剥离腰后方两侧的椎旁肌肉,不损伤椎板及关节突关节,医源性组织结构损伤小,卧床时间较开放手术短;(2)手术时间短,术中不进行内固定物的置入,无需进行椎间融合;(3)切口仅8 mm,术中肌肉暴露少,损伤小,出血量少;(4)局麻手术,术中可与患者交流,若术中神经根激惹时可及时发现,防止损伤神经根;(5)术中大量持续0.9%氯化钠溶液对椎管内的冲洗,故切口及深部组织感染风险低。
PELD手术注意事项:(1)术中使工作通道从头部到尾部,从腹侧到背侧移动保证能顺利彻底地去除髓核;(2)术前仔细分析CT和MRI等图像,直接将通道置入到椎间盘突出的部位可减轻神经根刺激,减少手术时间;(3)置入通道时视术中情况使用环锯选择性切掉上关节突的内侧部分以扩大椎间孔面积,为手术过程中通道操作提供方便,扩大可视术野;(4)对于巨大的椎间盘突出患者,通道置入时需从椎间孔处逐步透视、减压,逐步置入操作通道,禁忌直接将通道置入突出间盘中心位置;(5)术中减压过程中要看到硬膜囊随心跳出现波动,神经根减压松懈充分彻底,然后才能结束手术。
本研究认为PELD是治疗LDH的一项很有前途的手术。虽然PELD的学习曲线陡峭[30],但是因为局麻下手术,术中可即时与患者交流,从而避免持续剧烈刺激或损伤神经根,避免出现严重的并发症,所以PELD学习曲线是可以接受的[31]。严格执行操作规则以及熟练掌握的解剖学知识可以显著缩短学习曲线。
PELD是一个疗效确切、创伤小、恢复快的手术方式。然而,需要进行更多的前瞻性随机临床研究和大样本量试验以进行进一步的研究。
