密度对小豆叶片发育和光合特性以及产量的影响
2020-04-23王洪皓何伟锋
王洪皓,乔 辉,何伟锋,赵 秋
(1.辽宁省经济作物研究所, 辽宁 辽阳 111000;2.辽阳市灯塔市国有粮食资产管理中心 ,辽宁 辽阳 111300 )
红小豆是我国主要的食用豆类作物。长期以来,红小豆一直被认为是低产作物,管理粗放、产量和效益双低,因此围绕红小豆栽培技术开展的研究十分有限。通常,栽培技术研究与特定品种相配套,包淑英等[1]针对‘吉红12号’、杨万军等[2]针对‘张红1号’、张红梅等[3]针对‘苏红3号’、张春明等[4]针对‘晋小豆5号’,都配套了具有地域特色的栽培技术。蒋彬等[5]针对华南地区的自然气候条件,推荐了‘通H058’、‘京农24’等7个品种为主栽品种,并系统配套了栽培技术。
通过调节农作物栽培密度,最大程度地发挥作物的增产潜力,一直是农业工作者的研究重点。薛仁风等[6]研究比较了不同种植密度和种衣剂处理条件下红小豆的生长和生理特性,认为15万株/hm2+6.25%亮盾-精甲·咯菌腈处理的小区和公顷产量最高,是9个组合中最适合‘辽引红小豆4号’的田间栽培模式。赵秋[7]等研究表明,‘辽红小豆8号’在辽阳地区的适宜播期为6月20—30日,适宜密度19.5~21万株/ hm2。张春明等[8]通过研究玉米间作条件下不同小豆品种的光合特性,认为不同小豆品种的产量与净光合速率的高低相对应。王天奇等[9]分析了不同小豆资源花期叶绿素含量与农艺性状之间的相关性,认为从野生小豆到栽培小豆的演化过程中,相对叶绿素含量呈上升趋势,并且叶绿素含量的增加有利于获得较高产量。
为找寻适于辽宁省的小豆栽培密度,本研究以‘辽红小豆1号’和‘辽红小豆8号’为材料,通过比较红小豆的叶片发育、不同时期叶绿素及可溶性蛋白含量以及光合特性,探讨增加密度对红小豆增产的机理,以期为红小豆高产与高效生产提供理论和技术依据。
1 材料与方法
1.1 试验的基本情况
本试验于2016—2017年在辽宁省经济作物研究所内试验田进行,播种方法和田间管理同一般生产田。试验地前茬为玉米,0~20 cm土壤有机质含量2.42 g/kg,速效N 104 g/kg,速效P 34 g/kg,速效K 16 g/kg。土壤pH值为6.2。
1.2 试验材料
辽宁省经济作物研究所近年选育的红小豆品种‘辽红小豆1号’(6月16日播种,6月24日出苗,7月30日分枝,7月28日开花,9月15日成熟,生育期81 d,百粒重11 g),‘辽红小豆8号’(6月16日播种,6月24日出苗,7月30日分枝,8月15日开花,10月10日成熟,生育期106 d,百粒重25.6 g)。
1.3 试验设计
采用裂区—随机区组设计,主区为品种,副区为密度。每品种设6个密度水平:13.5万株/hm2(A1),15.0万株/hm2(A2),16.5万株/hm2(A3),18.0万株 /hm2(A4),19.5万株 /hm2(A5),21.0万株/hm2(A6)。完全随机区组,3次重复,小区面积20 m2。
1.4 测定时间和方法
分别于2个品种苗期、分枝期、开花期、结荚期、成熟前,取主茎上数第3片展开叶进行检测。共测定叶绿素含量、光合指标、叶片可溶性蛋白质含量、叶面积指数、比叶重,产量等项目,每个时期测定调查3次取其平均值。成熟后测定产量。
光合指标(Pn)采用美国产CI-30IPS 光合测定系统在晴天上午测定,开放气路系统, CO2浓度340~360μL/L,光通量密度1 500μE/(m2· s)左右。
叶绿素含量(ChI)采用苏正淑等[10]的方法,叶片中可溶性蛋白质含量(Pro)参照张龙翔[11]等考马斯亮蓝法测定。叶面积指数测定采用经验公式法:叶长×最大叶宽×0.75×单位面积总叶数。比叶重的测定用叶干重与叶面积之比。产量测定选取15m2小区测产。
1.5 数据处理与分析
采用2016、2017两年的数据,取平均数。再利用DPS9.5进行处理和分析,利用EXCEL2007作图。
2 结果与分析
2.1 叶片发育特性
2.1.1 叶面积变化趋势 由图1可见:‘辽红小豆8号’的叶面积明显大于‘辽红小豆1号’。从苗期开始,叶面积呈逐渐增大,直到开花期达到最大值,然后开始下降。2个品种的峰值都出现在开花期,分别为66.17 cm2(辽红小豆1号),和93.48 cm2(辽红小豆8号);叶面积的差距在开花期达到最大,约41.27%。在分枝期生育期较长的‘辽红小豆8号’表现出了随密度增加叶面积缩小的趋势;开花期2个品种都表现出了叶面积随密度增加而缩小的趋势;结荚期叶片加厚,这个趋势再次消失。从分枝期开始,‘辽红小豆1号’在18.0万株/hm2时叶面积最大。
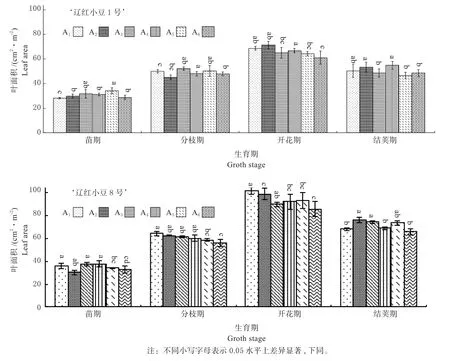
图1 2个红小豆品种叶面积变化情况Fig.1 Leaf area of 2 adzuki bean cultivars
2.1.2 比叶重变化趋势 由图2、图3可见,苗期‘辽红小豆 1号’的比叶重大于‘辽红小豆8号’,之后‘辽红小豆8号’的比叶重发育较快,后3个时期基本持平。从生育时期上,‘辽红小豆1号’比叶重前3个时期基本持平,结荚期明显提高,达到56.11 g/cm2;‘辽红小豆8号’比叶重呈现稳定的上升趋势,同样在结荚期达到最高的58.94 g/cm2。不同的密度处理间,2个品种表现出相反的趋势,‘辽红小豆1号’中间处理比叶重较小,而‘辽红小豆8号’中间密度处理比叶重较大。

图2 ‘辽红小豆1号’比叶重变化情况Fig.2 Specific leaf mass of ‘adzuki bean Liao No.8’

图3 ‘辽红小豆8号’比叶重变化情况Fig.3 Specific leaf mass of ‘adzuki bean Liao No.8’
2.1.3 叶绿素含量变化趋势 由图4可见,‘辽红小豆8号’的叶绿素含量要稍高于‘辽红小豆1号’。从生育时期上,2个品种都表现苗期叶绿素含量较高,之后稍有下降,到结荚期再次升高。两个品种叶绿素含量的峰值都出现在结荚期,分别为45.21 mg/g(辽红小豆1号),和47.38 mg/g(辽红小豆8号)。2个品种的差距在苗期最大,为12.24%。从密度处理上,‘辽红小豆1号’并没有表现出明显的趋势,但处理4的含量一直较高;‘辽红小豆8号’则一直表现中间高、两边低的趋势,处理3、4、5一直较高;2个品种在结荚期,都是处理4(18.0万株/hm2)的叶绿素含量较高。

图4 2个红小豆品种叶绿素含量变化情况Fig.4 Chlorophy content of 2 adzuki bean cultivars
2.1.4 叶片可溶性蛋白变化 由图5可见 ‘辽红小豆1号’的可溶性蛋白含量要稍高于‘辽红小豆8号’。从生育时期上,2个品种都表现前期逐渐增加,到结荚期微有下降的趋势。‘辽红小豆1号’可溶性蛋白含量的峰值出现在开花期,为7.37 mg/g;‘辽红小豆8号’可溶性蛋白含量的峰值出现在开花期,为7.40 mg/g;2个品种分枝期差距最大,达到20.46%、之后迅速缩小。‘辽红小豆1号’的可溶性蛋白在第1、第4、第5个处理一直表现较高;‘辽红小豆8号’的情况类似。
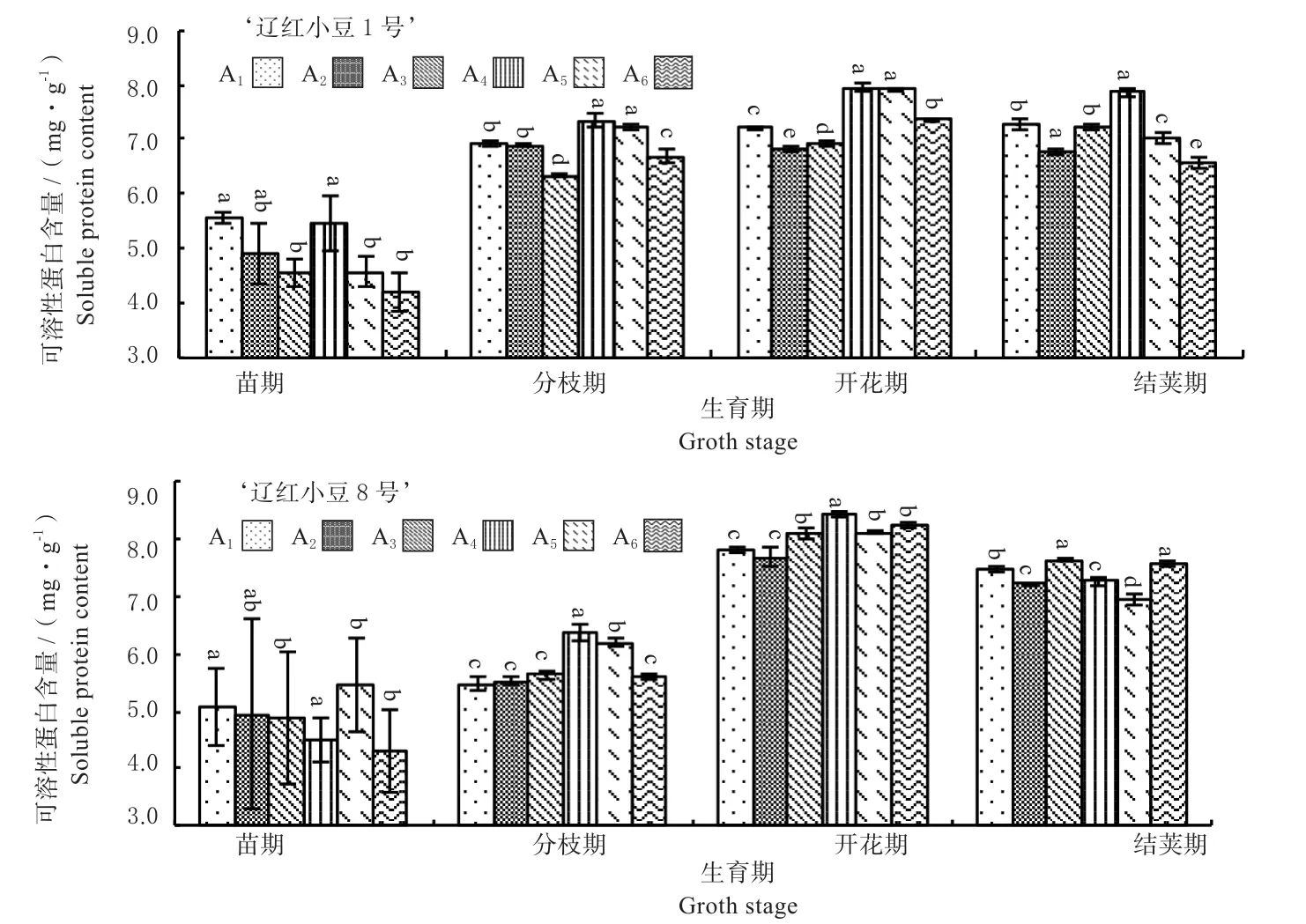
图5 2个红小豆品种叶片可溶性蛋白变化趋势Fig.5 Change trend of soluble protein content of 2 adzuki bean cultivars
2.2 叶片光合特性变化
2.2.1 蒸腾速率(Tr) 由图6可知,‘辽红小豆1号’的Tr值在前期要稍高于‘辽红小豆8号’。从生育时期上,两个品种都表现随着生育时期的延长,Tr值逐渐下降,‘辽红小豆1号’的下降趋势更加明显。两个品种的峰值都出现在苗期,分别为‘辽红小豆1号’苗期Tr值为10.51 mmol/(m2·s),‘辽红小豆8号’苗期Tr值为9.12 mmol/(m2·s),差距达到15.26%,之后,随着Tr值的下降,差距也逐渐缩小。从密度处理上,‘辽红小豆1号’仅在开花期表现出随密度增大Tr值下降的趋势;而‘辽红小豆8号’在分枝期和开花期都表现第4、第5处理Tr值较高;两个品种在结荚期各密度之间的Tr值差异都不明显。
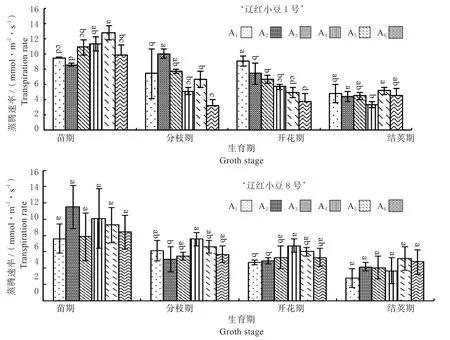
图6 2个红小豆品种蒸腾速率变化趋势Fig.6 Change trend of transpiration rate of 2 adzuki bean cultivars
2.2.2 光合速率(Pn) 由图7可见,‘辽红小豆1号’的Pn值要高于‘辽红小豆8号’;从生育时期上,分枝期和开花期的Pn值要高于苗期和结荚期。2个品种的峰值都出现在开花期,‘辽红小豆1号’Pn值为17.54 mmol CO2/(m2·s),‘辽红小豆8号’Pn值为16.48 mmol CO2/(m2·s),结荚期10.49 mmol CO2/(m2·s);差距最大为苗期,达到17.46%。密度处理方面,‘辽红小豆1号’的第2个处理始终表现Pn值较高,同时,第4、第5个处理也表现较高;‘辽红小豆8号’除苗期外,第4、第5个处理始终表现出较高的光合速率。
2.2.3 气孔导度(Gs) 气孔导度会影响到胞间CO2浓度,理论上气孔导度下降会导致胞间CO2浓度的增加[10]。由图8、图9可知,‘辽红小豆1号’的Gs值在分枝期和开花期明显高于‘辽红小豆8号’;从生育时期上,2个品种都表现随生育时期的延长,由低到高再逐渐下降的趋势。2个品种Gs值的峰值都出现在分枝期,分别为‘辽红小豆1号’3 269.67 mmol/(m2·s),‘辽红小豆 8号 ’1 585.00 mmol/(m2·s),此时差距也最大,达到106.29%。在密度处理上,Gs值在苗期并没有表现出明显的规律,但在其他3个时期都表现第4、第5个密度处理Gs值比较高。

图8 ‘辽红小豆1号’气孔导复变化趋势Fig.8 Change trend of stomatal conductance of ‘adzuki bean Liao No.1’
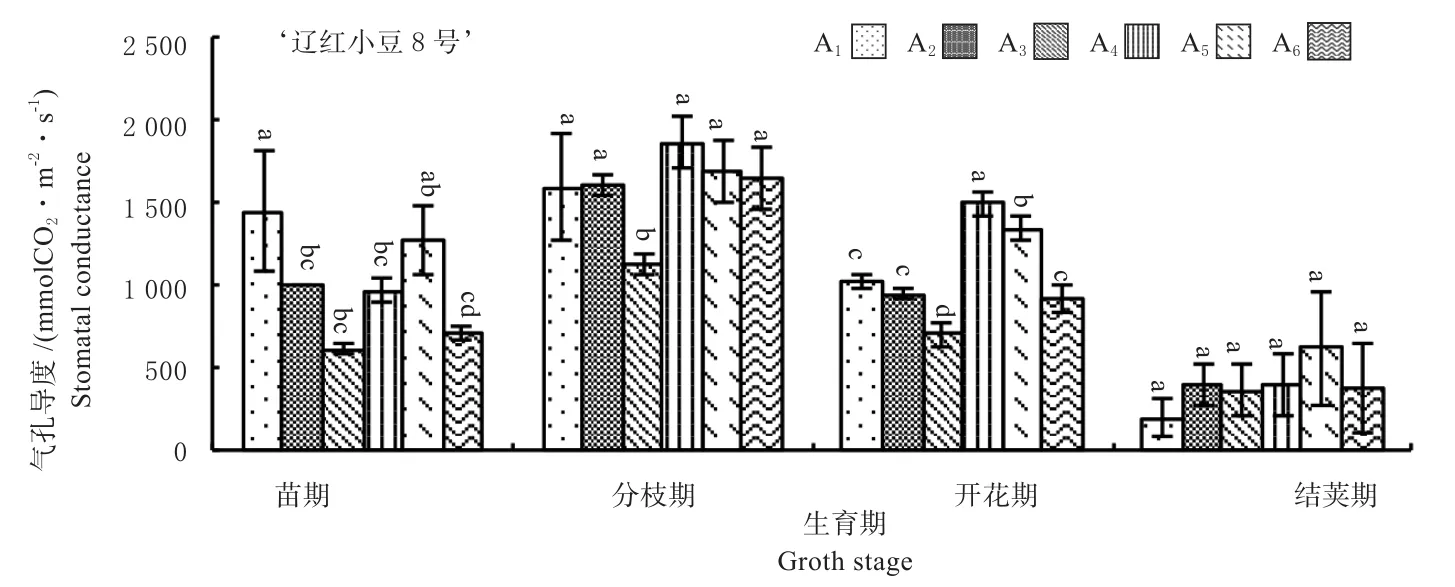
图9 ‘辽红小豆8号’气孔导度变化趋势Fig.9 Change trend of stomatal conductance of ‘adzuki bean Liao No.8’
2.2.4 胞间CO2浓度(Ci)变化趋势 由图10可见,2个品种的Ci值差异不明显,苗期和分枝期‘辽红小豆8号’的Ci值较高,开花期和结荚期则是‘辽红小豆1号’的Ci值较高。2个品种都表现出随生育时期延长逐渐下降的趋势,这一点在‘辽红小豆8号’上表现更明显。2个品种的峰值都出现在苗期,‘辽红小豆1号’的Ci为309.28 mmol CO2/(m2·s),‘辽红小豆8号’的Ci值为313.22 mmol CO2/(m2·s),差距最大的是结荚期,达到11.48%。
从密度处理上看,2个品种在苗期第2个处理Ci值较高;分枝期和开花期都表现第4、第5个处理较高;‘辽红小豆1号’结荚期仍然是第4、第5个处理较高,‘辽红小豆8号’则表现为第3、第6个处理较高。
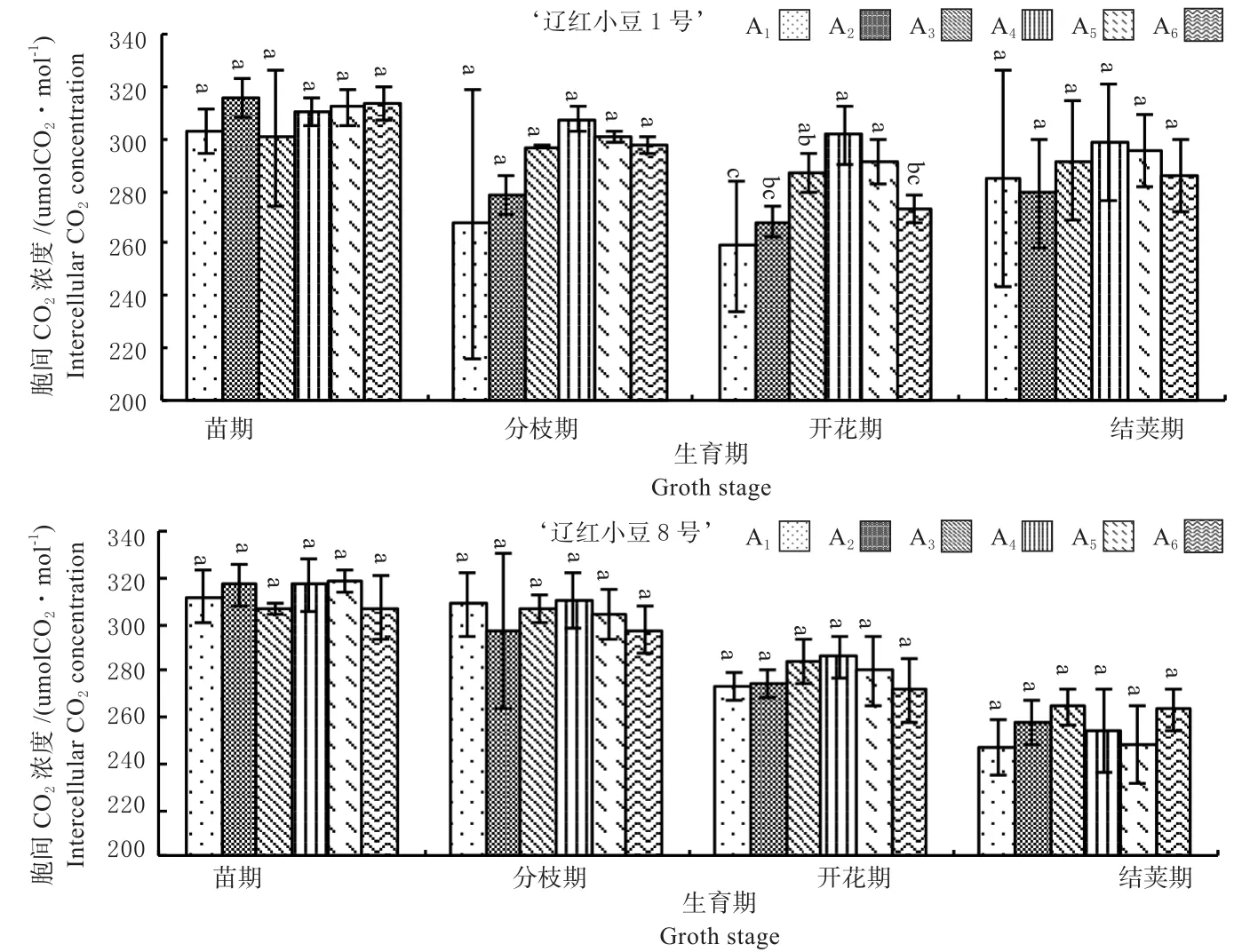
图10 2个红小豆品种胞间CO2浓度变化趋势Fig.10 Change trend of intercellular CO2 concentration of 2 adzuki bean cultivars
2.3 产量和植株表型性状
由表1、表2可见,‘辽红小豆8号’的产量明显高于‘辽红小豆1号’,高出15.34%,这与作物本身的种性有关。‘辽红小豆8号’生育期较长、叶面积较大,这就决定了其合成并积累了较多的干物质;虽然株高较矮,但是单株结荚多、荚大荚长、单荚粒数较多,尤其百粒重明显高于‘辽红小豆1号’,是高产形成的基础。
2个品种不同密度间的产量差异都达到了显著水平,其中‘辽红小豆1号’的差异更大一些。植株的各表型性状中,2个品种的单株荚数差异都达到了显著水平,但未达到极显著水平。‘辽红小豆1号’的单荚粒数和百粒重差异也达到了显著水平,而‘辽红小豆8号’的主茎节数差异达到了显著水平。其余株高、主茎分枝数、荚长、的差异都达到了极显著水平。

表1 ‘辽红小豆1号’产量性状统计Table 1 Plant characters and yield of ‘adzuki bean Liao No.1’

表2 ‘辽红小豆8号’产量性状统计Table 2 Plant characters and yield of ‘adzuki bean Liao No.8’
3 讨论
3.1 生育期对红小豆的影响
本试验选用2个红小豆品种, ‘辽红小豆1号’生育期81 d,‘辽红小豆8号’生育期106 d。2个品种在叶片发育和光合特性方面趋势基本相同,根据姜武[13]、周竹青[14]的研究结果,植物的光合作用不仅受到温光水等外部资源和条件的影响,还受到植物本身遗传特性的制约。因此,试验中选用的两个红小豆品种,其总体的光合特性变化规律相同,但是由于生育期不同,所以‘辽红小豆1号’的光合指标值要高于‘辽红小豆8号’。红小豆播种时(6月20日)气温较高,出苗后很快进入雨季,适合红小豆生长发育。‘辽红小豆1号’由于生育期较短,植株由营养生长迅速转入生殖生长,其中苗期、分枝期、开花期有一定的重叠,作为主要营养器官的叶片的生长受到抑制[15]。‘辽红小豆8号’生育期较长,各生育阶段区分明显且发育充分,所以叶片各项指标在不同生育时期所表现的特点更加明显,同时叶片较大,也直接决定了其最终产量较高。
3.2 种植密度对红小豆叶片发育和光合作用的影响
本试验中种植密度对红小豆光合作用的影响主要表现在分枝期和开花期,除‘辽红小豆1号’的蒸腾速率随密度增加而降低外,所监测的4个指标,基本都是第4个(18.0万株/hm2)、第5个(19.5万株/hm2)处理的值较高,这一点与理论预期不相符。理论上来说,随着密度加大,群体的通风透光条件恶化,单个植株(叶片)所获得的温光水资源降低,光合能力应有所下降。但在本试验中,却表现为密度较高的处理光合指标较高,可见,光合作用的强度与所接受的光照、温度和通风条件并非简单线性相关,还受到其他条件的约束,如农田小气候等,也会影响到植株的光合能力[12],进而影响到产量。
4 结论
(1)随着生长发育,2个品种的叶面积均呈先增加后减少的趋势,比叶重逐渐加大,叶绿素含量先下降再升高,叶片可溶性蛋白含量逐渐增加。
(2) 随着生长发育,2个品种的叶片光合能力呈逐渐下降趋势,‘辽红小豆1号’的光合能力高于‘辽红小豆8号’;种植密度对叶片发育和光合作用的影响主要表现在分枝期和开花期。
(3) 根据本试验的结果,种植密度为18.0万株/hm2时,生育期较短的‘辽红小豆1号’产量较高;种植密度为19.5万株/hm2时,生育期较长的‘辽红小豆8号’产量较高。相比之下,种植生育期较长的品种、适当增加其密度,更有利于获得较高的收益。
