全身免疫炎症指数预测卒中相关性肺炎
2020-04-23刘红兵李友凤孙文先孙石磊李玉生许予明
曾 喜,李 屾,刘红兵,李友凤,孙文先,王 台,吴 军,孙石磊,李玉生,宋 波,许予明
急性缺血性卒中(acute cerebral ischemic stroke,AIS)具有高发病率、高致残率、高死亡率的特点,占卒中的80%~85%[1,2];卒中相关性肺炎(stroke-associated pneumonia,SAP)是卒中最常见的并发症之一,指的是原无肺部感染,入院后出现肺实质感染性炎症[3],导致患者住院时间延长,增加致死致残率,造成社会经济负担。目前在AIS患者发生SAP的相关研究中,A2DS2评分量表[4],AIS-APS评分量表[5],PANTHERIS评分量表[6]等是目前公认的预测SAP较好的工具。同时研究证明,T-淋巴细胞、降钙素原、白细胞介素-6、中性粒淋巴细胞比值等生物标记物也是AIS发生SAP的独立危险因素[7~11]。
全身免疫炎症指数(systemic immune-inflammation index,SII),作为一种结合中性粒细胞、血小板和淋巴细胞计数三种细胞功能的新型炎症指数,具有更强的稳定性,在食管癌、口腔鳞癌、非小细胞性肺癌等恶性肿瘤研究中被广泛应用[12~14],然而,关于SII与AIS患者发生SAP的关系鲜有报道。本前瞻性研究目的是探讨SII与AIS患者发生SAP的相关性。
1 对象与方法
1.1 研究对象 本研究基于郑州大学第一附属医院神经内科前瞻性纳入的卒中数据库,该数据库得到郑州大学第一附属医院伦理委员会批准,对符合纳入标准的患者均以书面知情同意书形式告知患者或其授权委托人[15]。本研究前瞻性分析2015年1月~2016年12月期间登记的发病24 h内入院的703例急性脑梗死患者。纳入标准:(1)符合世界卫生组织的诊断标准[16];(2)年龄不小于18岁;(3)卒中发病时间为24 h内;(4)病例资料完整。排除标准:(1)患者入院前2 w内有感染史;(2)患者目前正在服用类固醇等免疫抑制剂类药物或合并有肝肾功能不全、恶性肿瘤、自身免疫性疾病、血液病等疾病史。
1.2 资料收集 收集患者人口学特征及临床资料,包括性别、年龄、个人史(吸烟,饮酒)、既往史(高血压,糖尿病,冠心病,卒中史,心房颤动,高脂血症),入组患者入院时由专业的神经医师对其进行国立卫生研究院卒中量表(national institutes of health stroke scale NIHSS)评分,另外,在入院24 h内抽取其肘中静脉血进行血常规检查,计算SII值(×109/L),SII=P(×109/L)×N(×109/L)/L(×109/L),其中P、N和L分别是外周血小板、中性粒细胞和淋巴细胞计数。
1.3 结局指标 结局指标:发生SAP:诊断标准参考2015年诊断共识[17],即:(1)以下3项至少具备1项:①无其他明确原因的发热>38 ℃;②外周血白细胞计数>12×109/L或<4×109/L;③年龄≥70岁的老年人无其他明确原因出现意识改变。(2)同时以下4项至少符合2项:①新出现的脓性痰,或持续24 h痰液性状改变,或呼吸道分泌物增多,或呼吸道引流次数增加;②新出现的咳嗽或原有症状加重,或呼吸困难或呼吸频率加快(>25次/min);③肺部听诊可闻及湿罗音、喀喇音或支气管呼吸音;④气体交换功能下降,如氧饱和度下降(氧合指数≤240)或氧需求量增加。(3)合并胸部X片改变(连续≥2次):新出现或进展性的持续存在的肺部渗出、实变或空洞。
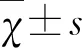
2 结 果
2.1 急性脑梗死患者发生卒中相关性肺炎(SAP)与SII及其基本资料比较 见表1。前瞻性分析703例急性缺血性卒中患者,其中<18岁4例,31例缺乏完整临床资料,27例既往2 w内有感染或合并有肝肾功能不全、恶性肿瘤等疾病,最终641例纳入分析。其中男性422例(65.83%),女性219例(34.17%),年龄平均(60.22±12.48)岁,未发生SAP 591例(92.20%),发生SAP有50例(7.80%);单因素分析结果显示,SAP组年龄、入院NHISS、SII值及房颤比例高于非SAP组,组间差异比较具有统计学意义(P<0.05);性别、吸烟、饮酒、高血压、糖尿病、既往卒中、冠心病、高脂血症病史两组间比较无显著差异(P>0.05)。
2.2 急性脑梗死患者发生卒中相关性肺炎(SAP)与SII(四分位)的多因素 Logistic 回归分析 见表2。依据SII四分位数将研究对象分组。多因素 Logistic 回归分析显示,与低四分位数组相比,高四分位数组AIS患者发生SAP的风险增加8.083倍,差异有统计学意义(95%CI2.673~24.442;P<0.001)。年龄[优势比(0dds ratio,OR)1.073,95%可信区间(confidence interval,CI)1.040~1.107,P<0.001],NHISS评分(OR1.103,95%CI1.033~1.178,P=0.003)也是AIS患者发生SAP的独立危险因素。
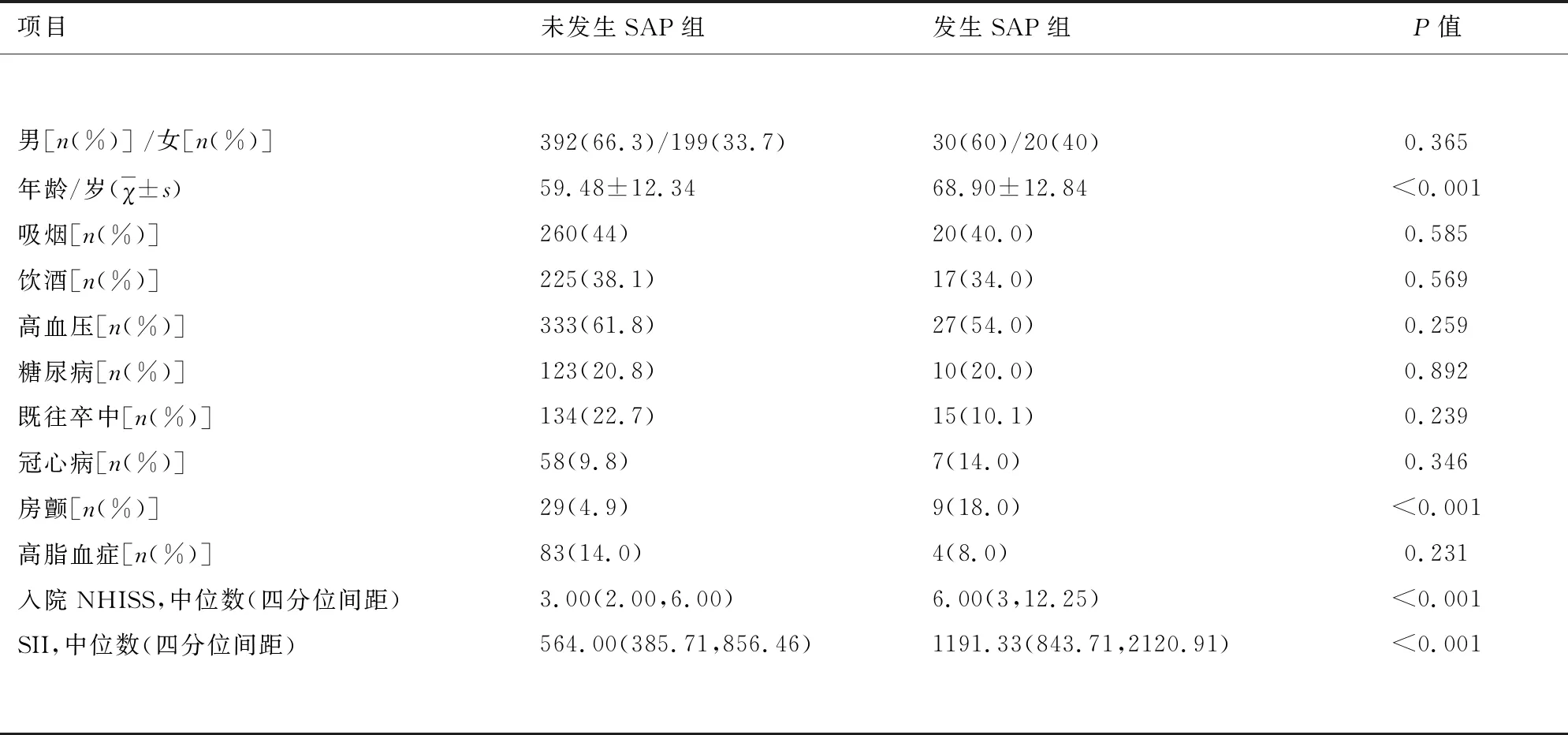
表1 卒中相关性肺炎与SII及基本资料比较
NHISS:美国国立卫生研究院卒中量表;SII:全身免疫炎症指数
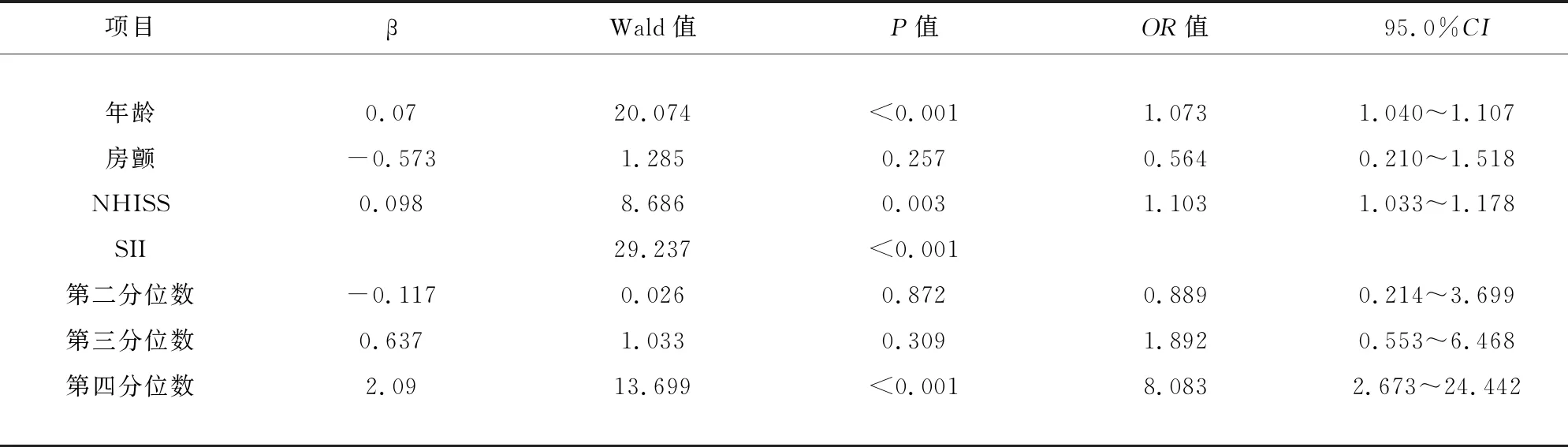
表2 卒中相关性肺炎与SII多因素分析
NHISS:美国国立卫生研究院卒中量表;SII:全身免疫炎症指数
2.3 SII对急性脑梗死患者发生卒中相关性肺炎的预测价值 以SII四分位数将研究对象分组,比较四组SAP的发生率(见图1):第一组SAP发生率为2.48%,第二组发生率为2.53%,第三组和第四组发生率为5.60%和20.63%,组间比较具有统计学差异(P<0.001)。受试者工作特征(ROC)曲线分析结果显示,SII预测急性脑梗死患者相关性肺炎的曲线下面积为0.781(95%可信区间0.708~0.854;P<0.0001),SII最佳截断点为810.84,当SII处于最佳截断点时,预测其发生SAP的敏感性为80.0%,特异度为71.9%(见图2)。
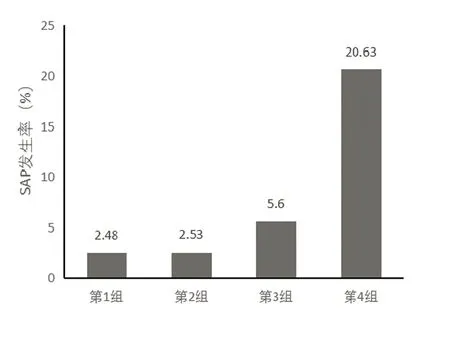
图1 SII不同分组对SAP发生率的比较
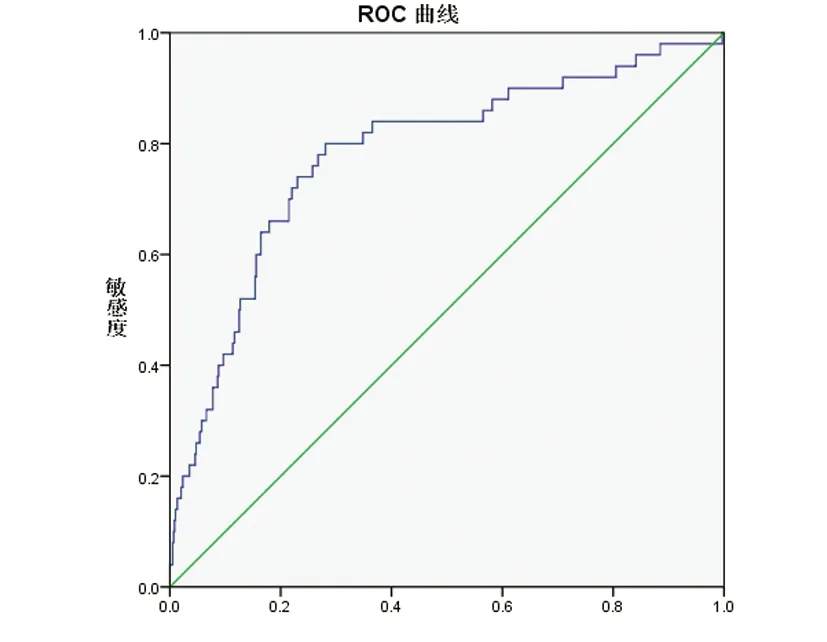
图2 SII预测SAP的ROC曲线,曲线下面积为0.781(95%可信区间0.708~0.854;P
3 讨 论
本研究探讨了全身免疫炎症指数(SII)与急性脑梗死患者(AIS)发生卒中相关性肺炎(SAP)的相关性。结果显示(1)SAP组SII值高于非SAP组。(2)与低四分位数组相比,高四分位数组AIS患者发生SAP的风险增加8.083倍,差异有统计学意义(95%CI2.673~24.442;P<0.001)。
SII,最早由Hu等提出[18],SII值的升高多由中性粒细胞和血小板升高,淋巴细胞水平降低所致,通常表明患者的炎性反应增强,免疫反应减弱。Deng等在晚期肺腺癌研究中发现SII是第一代TKI治疗的晚期EGFR突变肺腺癌患者生存率低的独立预测因素[19]。Zhang等在胰腺癌研究中表明高SII是晚期胰腺癌预后不良的独立危险因素[20]。卒中相关性肺炎(SAP),最开始由Hilker等提出[21],后因临床发生率高(7%~38%)[11],严重影响卒中患者预后而逐渐受到重视[22,23]。既往研究指出C-反应蛋白、白细胞介素-6、白细胞介素-10等可预测SAP发生[7,8],因其操作复杂或价格昂贵等原因,应用受到一定限制,其他如中性粒淋巴细胞比值等容易监测和获取的炎症指标也有研究报道可预测AIS患者发生SAP风险[9,11],但研究中纳入患者发病时间距入院时间较长,不排除炎症指标数值本身受发病时间或入院前已发生SAP影响,干扰预测价值准确性。因此,本研究,研究对象均为发病24内入院,采用一种简单、经济、较中性粒淋巴细胞比值更能全面反映宿主免疫和炎症状态平衡的新型炎症指数[12]。
SII可作为SAP的预测指标,考虑与免疫抑制有关。目前认为,卒中后免疫抑制是诱发SAP的关键因素[24]。当脑部发生急性缺血性损伤时,中性粒细胞作为第一个从外周血管迁移到受损区域的炎性细胞[25],迅速在缺血和再灌注区域积聚,通过释放基质金属蛋白酶-9、细胞因子(如IL-6等)、趋化因子(如MCP-1)、蛋白水解酶(如酸性磷酸酶)、活性氧(如游离氧自由基)等多种物质作用于细胞外基质纤维[26,27],破坏血脑屏障。与此同时,血小板也可在炎症部位通过P-选择蛋白糖蛋白配体-1(PSGL-1)和Mac-1两种主要配体与浸润中的中性粒细胞相互作用[28],通过活化血小板、改变内皮细胞特性促使更多的中性粒细胞移行到炎症部位,加重血脑屏障损伤。一旦血脑屏障受损,为保护脑部,缓解其潜在的自身免疫性炎性反应,机体自身会引起免疫应答下调;淋巴细胞与机体免疫反应有关,而卒中后的应激状态会激活交感神经系统路径、副交感神经系统路径及下丘脑-垂体-肾上腺轴路径引起淋巴细胞凋亡或Th淋巴细胞比例改变,通过减少淋巴细胞数目或改变淋巴细胞特性导致免疫抑制[29]。机体一旦处于免疫抑制状态,相应的也将增加卒中后感染风险,尤其是卒中相关性肺炎的发病风险。
本研究局限性体现在:(1)单中心的研究,存在一定的信息及选择偏倚。(2)未对SII值进行动态监测,无法明确SII值的时间变化规律对其是否有额外的价值。高SII值的急性脑梗死患者发生SAP的可能性更高,SII是其发生卒中相关性肺炎的潜在独立危险因素。作为观测AIS发生SAP的良好指标,其简单、经济、在临床上获取方便,值得未来在在多中心大样本中进一步验证。
