马铃薯甲虫结节性硬化复合物基因LdTSC1和LdTSC2基因的克隆及功能分析
2020-04-23廖兰兰付开赟丁新华吐尔逊阿合买提郭文超
廖兰兰, 付开赟, 常 瑞, 丁新华, 何 江, 吐尔逊·阿合买提, 任 羽 , 郭文超
1塔里木大学植物科学学院,新疆 阿拉尔 843300; 2新疆农业科学院植物保护研究所,农业农村部西北荒漠绿洲作物有害生物综合治理重点实验室,新疆 乌鲁木齐 830091; 3新疆农业科学院博士后工作站/新疆农业大学博士后流动站,新疆 乌鲁木齐 830091; 4喀什大喀什大学生命与地理科学学院,新疆 喀什 844006; 5新疆农业科学院微生物应用研究所,新疆 乌鲁木齐 830091;
TSC1-TSC2即结节性硬化复合物1/2 (Tuberous sclerosis complex1/2),属于抑癌基因,位于蛋白激酶B(Akt)下游,是PI3K (phosphoinositide 3-kinase)-AKT信号通路重要的调控位点。在昆虫体内,TSC1和TSC2直接形成异二聚体(TSC1/TSC2),作为关键抑制性信号整合器发挥作用,可整合生长因子、营养、能量、细胞因子、胞外基质及环境胁迫等刺激信号,从而调节雷帕霉素靶标信号通路(mammalian target of rapamycin, mTOR),进而控制细胞的生长、代谢、增殖及凋亡。
昆虫的类胰岛素信号通路(insulin/insulin-like peptide signaling pathway, IIS)具有多种功能,主要控制体内三大营养物质蛋白质、糖、脂肪的代谢和贮存。除此之外,在生殖、寿命、协调新陈代谢和营养物利用率相关的生长方面发挥着重要作用(Vafopoulou & Xanthe,2014)。除黑腹果蝇Drosophilamelanogaster和家蚕BombyxmoriL.外, IIS在其他昆虫中仅有零星报道。在果蝇中,TSC1或dTSC2的失活都能增加细胞体积和促进细胞增殖,反之,TSC1和TSC2共同过表达会减小细胞体积,这些发现支持TSC1和TSC2可调节细胞生长的观点(Potter,2001)。IIS-TORC1信号整合生长因子、营养和能量信号调控细胞和个体的生长(周顺和李胜,2012)。TSC2是Akt下游在脂肪诱导細胞分化的关键底物,脂肪细胞分化必需激活mTORC1(Zhangetal.,2009)。研究表明,马铃薯甲虫LeptinotarsadecemlineataSay (Colorado potato beetle)幼虫经口摄入dsILP2(insulin-like protein)后,其体重、化蛹率和羽化率受严重影响(Fuetal.,2016)。近期,在果蝇中的研究发现,DOR (a new co-activator for the ecdysone receptor)是连接IIS信号和蜕皮激素(molting hormone, MH)信号参与调控昆虫变态发育时期代谢平衡的关键蛋白原因(Rénald & Pierre,2010)。ILP可刺激家蚕和长虹锥蝽RhodniusprolixusStål前胸腺分泌蜕皮激素(molting hormone, MH) (Guetal.,2012),促进烟草天蛾Manducasexta(Poster)前胸腺的生长(Kemirembeetal.,2012; Smithetal.,2014; Walsh & Smith,2011);在前胸腺以外的器官,ILPs还可刺激埃及伊蚊Aedesaegypti(L.) (Wenetal.,2010)和黑腹果蝇(Jarosch & Moritz,2011)在卵巢中合成和分泌MH。在果蝇中枢分泌细胞npc1与npc2突变体,具有幼虫致死的表型。实验证明,果蝇的蜕皮激素的缺失是npc缺失品系幼虫致死的主要原因(黄勋,2007)。以上结果表明,昆虫IIS通路和MH通路存在交叉对话的机制,但是具体通过何种方式、如何互相影响、其他类群昆虫中IIS的作用机制也都知之甚少。
马铃薯甲虫,属鞘翅目Coleoptera叶甲科Chrysomelidae,是我国对外重大检疫对象之一(郭文超,2013)。铃薯甲虫对RNA干扰非常敏感,喂食dsRNA可有效敲低对应的靶基因,便于研究 IIS下游关键节点基因TSC1和TSC2的功能,为揭示 IIS调控幼虫蜕皮的机制提供理论基础。本研究结合RNAi和qPCR,从被干扰马铃薯甲虫幼虫的糖脂代谢等生理指标为切入点来探明LdTSC1/2的生理学功能,旨在鉴定马铃薯甲虫中IIS信号级联关键因子TSC1和TSC2,弄清其生物学功能,为阐明IIS调节保幼激素(juvenile hormone, JH)和蜕皮激素信号途径的分子机理提供理论依据。
1 材料与方法
1.1 供试昆虫
马铃薯甲虫于2018年5月采自新疆农业科学院安宁渠综合试验场天敌资源繁育研究中心,饲养温度(25±1) ℃,光周期16 L∶8 D,相对湿度75%±5%。幼虫用新鲜马铃薯叶片饲喂,待发育至2龄开始用于实验。
1.2 主要试剂
总RNA提取试剂TRIzol(Invitrogen公司)、DNA Marker(TaKaRa公司)、One Step Clonging kit(南京诺唯赞公司)、DNA凝胶回收试剂盒(Omega公司)、pEASY-T3载体感受态细胞(北京全式金公司)、KpnⅠ和NOTⅠ(TaKaRa)、酵母提取液(yeast extract)和胰蛋白胨(tryptone)(Oxiod公司)、糖原含量测试盒、甘油三酯含量测试盒、葡萄糖含量测试盒和海藻糖含量测试盒(北京索莱宝公司)、总胆固醇(TC)含量测试盒(南京建成公司)。
1.3 铃薯甲虫LdTSC1/2基因克隆
在美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)在线BLAST获取马铃薯甲虫LdTSC1/2(GenBank登录号;KR075833.1、KR075843.1)基因cDNA全长,结合sidirect在线网站设计(http:∥sidirect2.rnai.jp/)300 bp左右高特异性siRNA片段,利用Primer 5.0设计克隆引物,引物设计相见表1。
PCR反应体系(25 μL);cDNA模板1 μL,dNTP 1 μL,10×Mg2+Buffer2.5 μL,上下游引物各1 μL,其余用ddH2O补齐。PCR反应条件;94 ℃60 s;94 ℃30 s,52 ℃30 s,72 ℃2 min,循环40次;72 ℃10 min。反应完成后样品通过琼脂糖凝胶电泳检测,目标条带切胶并参照胶回收试剂盒回收片段。

表1 用于构建dsRNA原核表达载体的引物
1.4 系统发育树和多重序列对比分析
通过NCBI blastx搜索、挑选并下载近缘种TSC1及TSC2序列,利用ClustalX 2.0进行序列比对,在GeneDoc中处理获得最终效果图。经ClustalX 2.0比对获得结果,在MEGA 7.0.26中进行系统发育分析,选择模型为邻接法,替代模型为泊松模型,自展次数1000次。
1.5 马铃薯甲虫LdTSC1/2基因功能的RNAi分析
1.5.1 dsRNA原核表达系统的构建 本实验用大肠杆菌EscherichiacoliHT115(DE3) RNaseⅢ缺失品系和pET-2p dsRNA表达载体均由南京农业大学赠送。载体构建方法参照Fuetal. (2014),用于构建dsTSC1和dsTSC2,dsEGFP为对照,PCR克隆获得。以1.3节中获得的各个组织的混合模板cDNA 1.0 μL,参照TaKaRa公司rTaq反应体系以25 μL反应体系进行克隆,PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,循环35次;72 ℃ 10 min。反应获得的片段连入全式金公司pEasy-T3载体,最终挑取获得的阳性克隆送南京金斯瑞测序,测序获得的结果通过GeneDoc比对序列的正确性。验证的片段通过菌液扩大培养并提取含有片段的Transit-T1载体,通过KpnⅠ和NotⅠ酶切产生黏性末端,目标片段通过琼脂糖凝胶电泳分离后通过胶回收纯化,利用T4连接酶连入已通过KpnⅠ和NotⅠ产生黏性末端的pET-2p载体,连接完成的载体转入HT115 (DE3)细胞中在含有卡那霉素(50 μg·mL-1)和四环素(12.5 μg·mL-1)的固体培养基筛选阳性克隆,并通过测序和异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)诱导发酵dsRNA验证结果。诱导发酵的步骤参照吕东(2010),在菌液重新扩大培养至D600 nm=1.0时加入IPTG至终浓度为0.1 mmol·L-1,发酵表达dsRNA 6 h即可获得稳定表达的浓度约为0.05 μg·μL-1的dsRNA。以上所用试剂盒均按照其说明书的标准化程序进行。
1.5.2 喂食dsRNA菌液的制备 将已构建好的pET-2p-TSC1/2大肠杆菌表达载体,在含有100 μg·mL-1卡那霉素的LB液体培养基中以体积比1∶100的比例扩大培养,于37 ℃ 220 r·min-1条件下震荡培养3.5 h,即D600 nm=1.0时,按1∶1000比例添加已经配好的IPTG母液(母液浓度为0.0238 g·mL-1),至终浓度为0.1 mmol·L-1,继续恒温震荡45 h,以此过程获得新鲜dsRNA。
1.5.3 喂食dsRNA的室内生物测定 选取发育一致的2龄初孵幼虫,分别设置超纯水与表达dsEGFP菌液为空白对照和阴性对照,每个处理30头,其中10头用于收样,每个处理6组生物学重复,总计处理约720头幼虫。将马铃薯叶片置于各处理的新鲜菌液中,将表达完成的菌液用CK稀释5倍后均匀涂抹于马铃薯叶片上,待风干后接入马铃薯甲虫,每24 h更换一次处理过的叶片,干扰3 d后更换新鲜叶片。干扰的第6天解剖收集足量的血淋巴和脂肪体(收集幼虫血淋巴样本须立即放入有少许苯基硫脲的1.5 mL管中);记录0和72 h体重,每天观察体表变化特征并记录试虫死亡率,直至马铃薯甲虫出现化蛹迹象,将其转移至土壤深度为512 cm的人工化蛹场地内,观察最终的死亡率、化蛹率及成虫羽化率。
1.6 实时荧光定量PCR引物设计
用Beacon Designer 7.3和GenScript在线网站(https:∥www.genscript.com/ssl-bin/app/primer)设计qPCR引物,参数选择默认。目的基因qPCR引物:LdTSC1上游引物5′-GGACAGGACAGCACTCTCAG-3′;下游引物5′-ACAACAGGGCCATTCAGCTA-3′。LdTSC2上游引物5′-TGACTTCGATTTAACAGATATCGT-3′;下游引物5′-CGGTAAGGCACTGCAAGG-3′。内参基因为ARF4和RP18 (Shietal.,2016),ARF4上游引物5′-GGACCTATCTTCAGCTATGCGT-3′;下游引物5′-CAATCCCTCGTGAAGGCCA-3′。RP18上游引物5′-ACTTCGTGTCACTGAAACTGC-3′;下游引物5′-TATCCGCACGACTTCCTGC-3′。
将收集的已调低LdTSC1/2的马铃薯甲虫利用Trizol提取(Invitrogen)总RNA,每一组样品包含34的个体,每组处理具有3次生物学重复。反转录采用One-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金)合成cDNA。qPCR反应体系为20 μL;RNA使用1 μg,qPCR Mix Buffer 10 μL,qPCR上下游引物各0.8 μL,ROX Reference Dye I 0.4 μL,剩余ddH2O补齐。qPCR的反应步骤参考ABI 7300默认反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 31 s,共40个循环。
1.7 统计分析
所有数据均给出均值±标准误,qPCR数据采用2-△△CT方法计算相对表达量,显著性水平P<0.05;存活率、化蛹率和羽化率、RNA干扰的qPCR数据利用单因素ANOVA检验,显著性水平P<0.05。
2 结果与分析
2.1 马铃薯甲虫TSC1/2的多序列比对及进化分析
在NCBI在线BLAST获取马铃薯甲虫LdTSC1基因全长,ORF包含3689 bp,编码1019个氨基酸;LdTSC2基因全长,ORF包含6011 bp,编码1800个氨基酸。通过NCBI在线BLAST将马铃薯甲虫TSC1/2基因翻译的氨基酸序列进行相似性搜索比对,将多种昆虫的氨基酸序列比对后发现,TSC1和TSC2基因编码不同的蛋白(分为hamartin和tuberin),序列之间没有相似性。TSC1编码一种分子量为130 ku的错构瘤蛋白(hamartin),但没有催化结构域(图1A)。TSC2编码分子量为200 ku抗结核菌素蛋白(tuberin),具有一个螺旋卷曲结构域(coiled-coil domain)和一个与Rap-GTP酶激活蛋白(GAP)同源的C末端(图1B)。
利用NJ系统发育构树方法发现,马铃薯甲虫LdTSC1与鞘翅目的玉米根萤叶甲DiabroticavirgiferaLeConteTSC1聚为一支(图2),自展一致度为100%;马铃薯甲虫LdTSC2与玉米根萤叶甲TSC2和赤拟谷盗TriboliumcastaneumHerbstTSC2聚为一支,自展一致度为100%;其他各目昆虫的TSC2各自聚成小类群,表明LdTSC2基因在进化过程中较LdTSC1有更好的保守性。
2.2 dsTSC1/2对马铃薯甲虫幼虫体重和化蛹率的影响
通过喂食马铃薯甲虫2龄幼虫原核表达的328/235 bp长度的dsTSC1/2,能显著降低靶标基因的表达量较(图3C、D),较dsEGFP处理组分别降低240%和160%(P<0.05)。同时能显著降低靶幼虫体重(图3A),较空白对照组,处理组幼虫平均分别降低22和23 mg(P<0.05)。相较空白对照组,处理能在幼虫的化蛹率也显著降低(图3B),相较空白对照组降低了6.0%和5.0%(P<0.05)。
2.3 敲低LdTSC1/2对马铃薯甲虫幼虫糖脂代谢及蜕皮激素合成的影响
与阴性对照试虫相比,敲低LdTSC1/2,其血淋巴中葡萄糖含量分别上升了2和3.4倍(图4A);脂肪体中的葡萄糖含量分别下降了700%倍和400%(图4B) 。在敲低LdTSC1/2的幼虫中,在血淋巴中甘油三酯含量较阴性对照,分别降低了310%和330%(图4C);脂肪体中较阴性对照,分别降低了170%和220%(图4D)。在敲低LdTSC1/2的幼虫中,海藻糖含量则均有上升;较阴性对照,在血淋巴中分别上升了1.2和1.1倍(图4E),在脂肪体中别上升了1.2和1.1倍(图4F)。

图1 TSC1/2蛋白的氨基酸序列比对
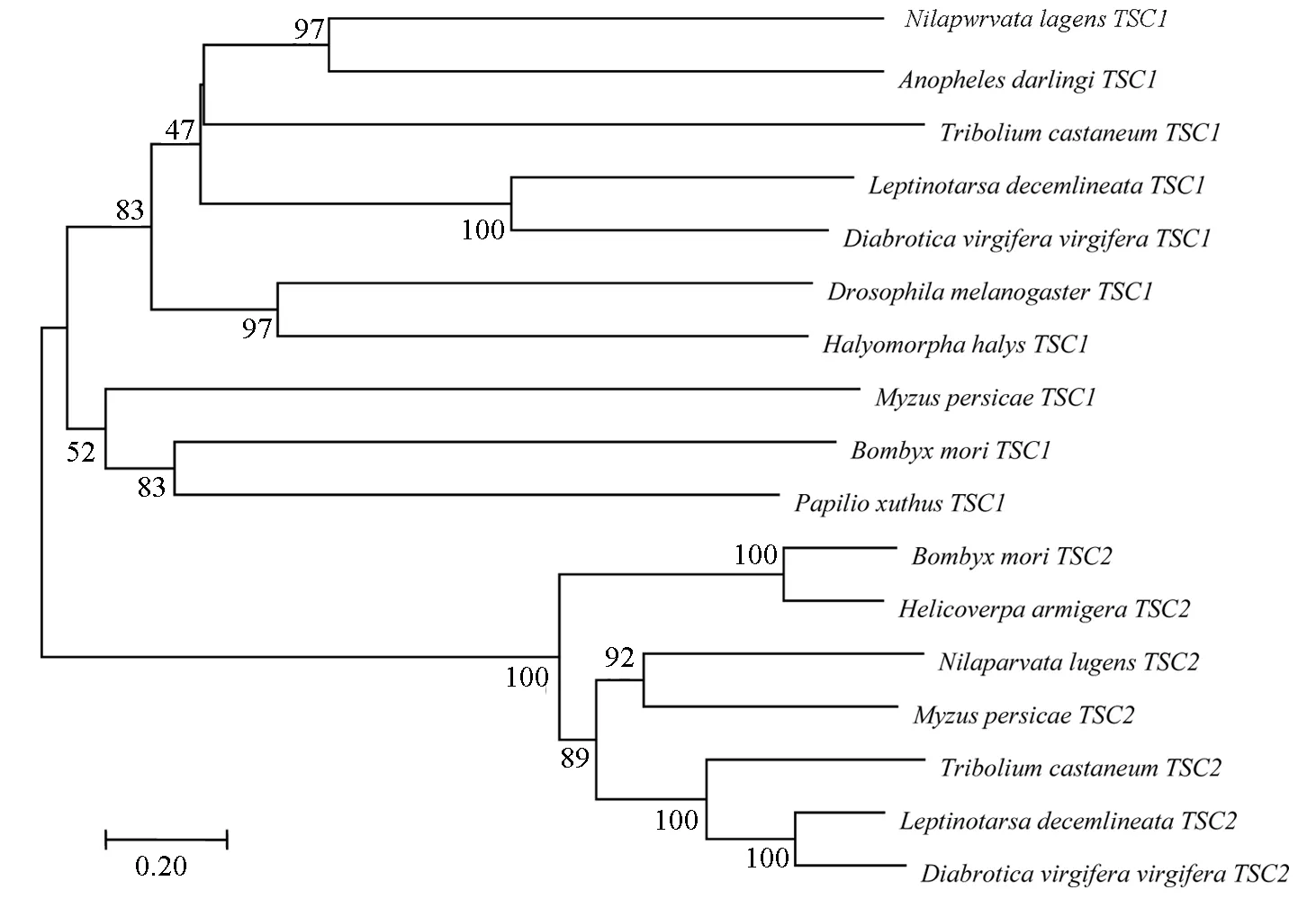
图2 基于邻接法(NJ)构建的系统发育树
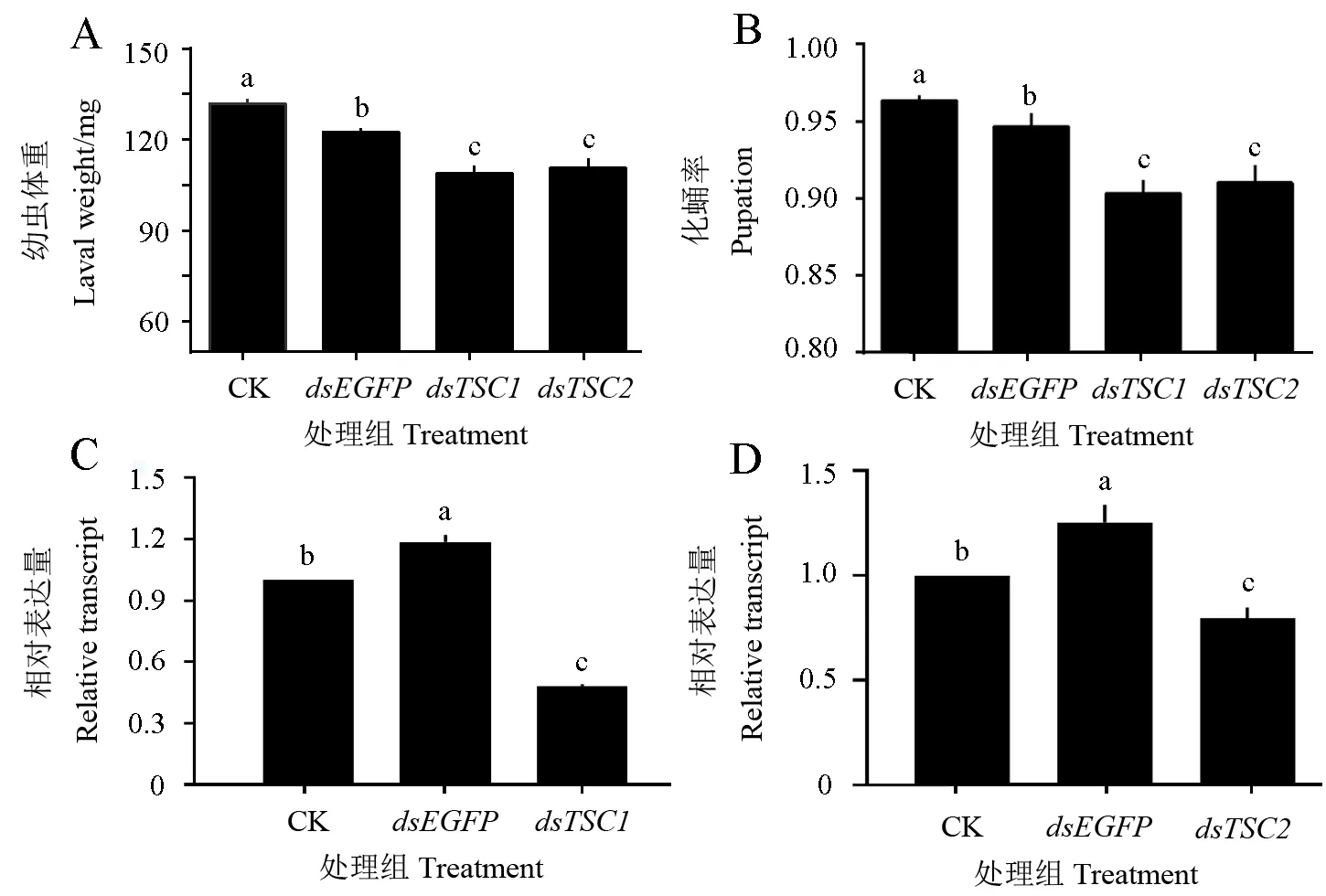
图3 敲除LdTSC1/2对马铃薯甲虫幼虫体重(A)、化蛹率(B)及LdTSC1/2相对表达水平(C、D)的影响
3 讨论与结论
研究显示,敲低LdTSC1/2后,由于TSC1/2为反式调控元件基因,因此类胰岛素信号上升,幼虫血淋巴和脂肪体的海藻糖均富集上升,葡萄糖含量显著下降,表明幼虫的血淋巴和脂肪体中葡萄糖和海藻糖的相互转化,海藻糖降解成葡萄糖和转化为甘油三酯的过程均受阻,与Xuetal. (2013)的研究结果一致。敲低LdTSC1/2后,试虫摄入的葡萄糖进入血淋巴后,在脂肪体内转化成海藻糖的速率降低,故血淋巴中葡萄糖高于对照;在脂肪体内海藻糖转化成葡萄糖用于虫体的能量供应,合成的海藻糖减少,故脂肪体内的葡萄糖低于对照。

图4 敲低LdTSC1/2对马铃薯甲虫幼虫的糖脂代谢的影响
Taponeetal. (2001)在果蝇TSC1和TSC2/gigas基因中鉴定了突变,任一基因中的失活突变均导致生长延长,也和本研究中发现处理幼虫发育受阻的结果一致。本研究未从蛋白磷酸化水平研究TSC复合体受RNAi调控下对幼虫蜕皮的影响,并测定信号通路中其他节点基因的表达变化,在未来有待通过以上技术方法和实验系统明确TSC复合体的功能。
基于RNAi研究发现,TSC1和TSC2参与并调控海藻糖的合成和代谢,敲低LdTSC1/2会下调其表达量,其糖脂代谢也会阻滞,级联反应导致虫体变小、死亡率升高及发育延迟。研究也为蜕皮激素或保幼激素参与类胰岛素信号通路和RNAi生物技术作物的环境风险评估提供了理论依据,同时为RNAi技术筛选致死候选基因奠定了一定基础。
