胃肠道5-羟色胺在炎症性肠病中的潜在生理作用
2020-04-21曹瑞华张黎梦肖再利
曹瑞华,张黎梦,肖再利
(华南农业大学动物科学学院广东省动物营养调控重点实验室,广州 510642)
5-羟色胺(5-HT)又名血清素,是一种信号分子,90%合成和储存于肠嗜铬细胞(EC),仅有5%在中枢系统分泌,通常与ATP等供能物质一起储存于细胞颗粒内,可能参与痛觉、睡眠和体温等生理功能的调节。在某些刺激因素作用下,5-HT可从囊泡颗粒内释放、弥散到血液,并被血小板摄取和储存,储存量约占全身的8%。研究发现,胃肠道中的5-HT可通过上调GPR78蛋白的表达激活内质网应激反应,参与肠道炎症反应,并且影响肠黏膜上皮细胞屏障的发展。
1 胃肠道5-HT的合成和分泌
肠道是5-HT产生的场所,肠嗜铬细胞是胃肠道5-HT的主要来源,5-HT的分布与肠嗜铬细胞的密度相关。胃黏膜是盛产5-HT的组织,5-HT储存在细胞颗粒中,并从肠腺内壁的肠嗜铬细胞(EC)中释放出来到下层的固有层,则5-HT与5-HT受体相互作用,影响肠道的各种功能,然后被5-HT选择性再摄取转运蛋白去除。5-HT影响肠道固有的主要功能,包括运动、分泌、血液流动和情绪。因此,当肠道5-HT能信号元件被破坏时,引起包括腹痛、腹泻或便秘等多种症状。在动物和人体研究中已证明,5-HT能信号元件可以对肠道内的炎症发展和严重程度产生重大影响,特别是在炎症性肠病中[1-2]。研究表明,调节各种5-HT信号成分可以改变肠道炎症及其并发症的风险。
5-HT参与肠道色氨酸代谢的关键途径,是色氨酸代谢的重要分解产物,也是褪黑素合成的前体物质[3]。色氨酸经过色氨酸羟化酶(TPH)催化首先生成5-羟色氨酸,再经5-羟色氨酸脱羧酶催化成5-HT,后者由5-HT-N-乙酰转移酶(SNAT)和N-乙酰血清素-O-甲基转移酶(ASMT)依次催化进而合成褪黑素。肠道来源的5-HT具有刺激肠道运动、促进脑-肠轴信号等功能。
2 胃肠道5-HT受体
人体的5-HT的95%来源于肠道,主要是黏膜层的肠嗜铬细胞,含有合成5-HT所需的色氨酸羟化酶。此外,少数也来源于肠神经元。EC细胞对肠腔内压力和化学刺激非常敏感,一旦肠腔内的压力升高到特定的程度即可分泌5-HT,作用于黏膜下传入神经神经元上的5-HT受体,激发蠕动反射,并调节肠道分泌功能[4]。
依据其分子结构、作用机制及生物学功能不同,5-HT受体家族主要包括 7个成员(5-HT1~5-HT7),是神经递质受体中最复杂的家族之一,几乎都为G蛋白偶联受体,仅有5-HT3R为离子门控通道受体[5]。研究表明,在胃肠道主要有5-HT1、5-HT2、5-HT3、5-HT4、5-HT7受体来调节胃肠道功能[6]。其中分布于肠神经元上的包括5-HT1A、5-HT3、5-HT4,调控神经递质的释放;分布于肠平滑肌上有5-HT2A、5-HT4、5-HT7受体,直接调控平滑肌的运动[7]。此外,在肠神经元上还发现了5-HT1P受体,介导慢速兴奋性突触后电位,但在国际药理学协会提出的5-HT受体分类中未包括该受体,因此被称为“孤独”受体[8]。5-HT受体家族的复杂性表明,5-HT可通过多种信号途径产生作用,而针对5-HT信号系统研发的各种药物也因此产生有效作用。
Edith等研究发现,当受到外界刺激时,肠黏膜释放5-HT,这表明EC细胞负责5-HT的释放[9]。随后的研究表明,胃肠管腔的各种变化,包括酸度,压力和营养浓度的改变,都会诱导肠黏膜释放5-HT[10-11]。而其他活性化合物,如胆囊收缩素(CCK)和胃动素,通过肠腔刺激其释放,说明5-HT在感知,分泌和蠕动过程中起着特殊作用[12]。值得一提的是,Spencer证明在无黏膜5-HT时肠道可以启动和进行蠕动,5-HT对于肠道蠕动的激活并不是必须的[13]。从EC细胞释放到固有层后,5-HT可以与内脏或外源性神经元投射的5-HT能受体以及邻上皮细胞和免疫细胞受体相互作用,后者可以刺激各种信号介质的分泌,并增强神经元,进而更有可能对另一种刺激作出反应或直接激活[14]。
5-HT对特定细胞活动的影响因相应的受体而不同。目前利用其结构和转导特征,已经鉴定了7种不同类别的5-HT受体,并且至少有13种不同的人类亚型,见表1[15]。
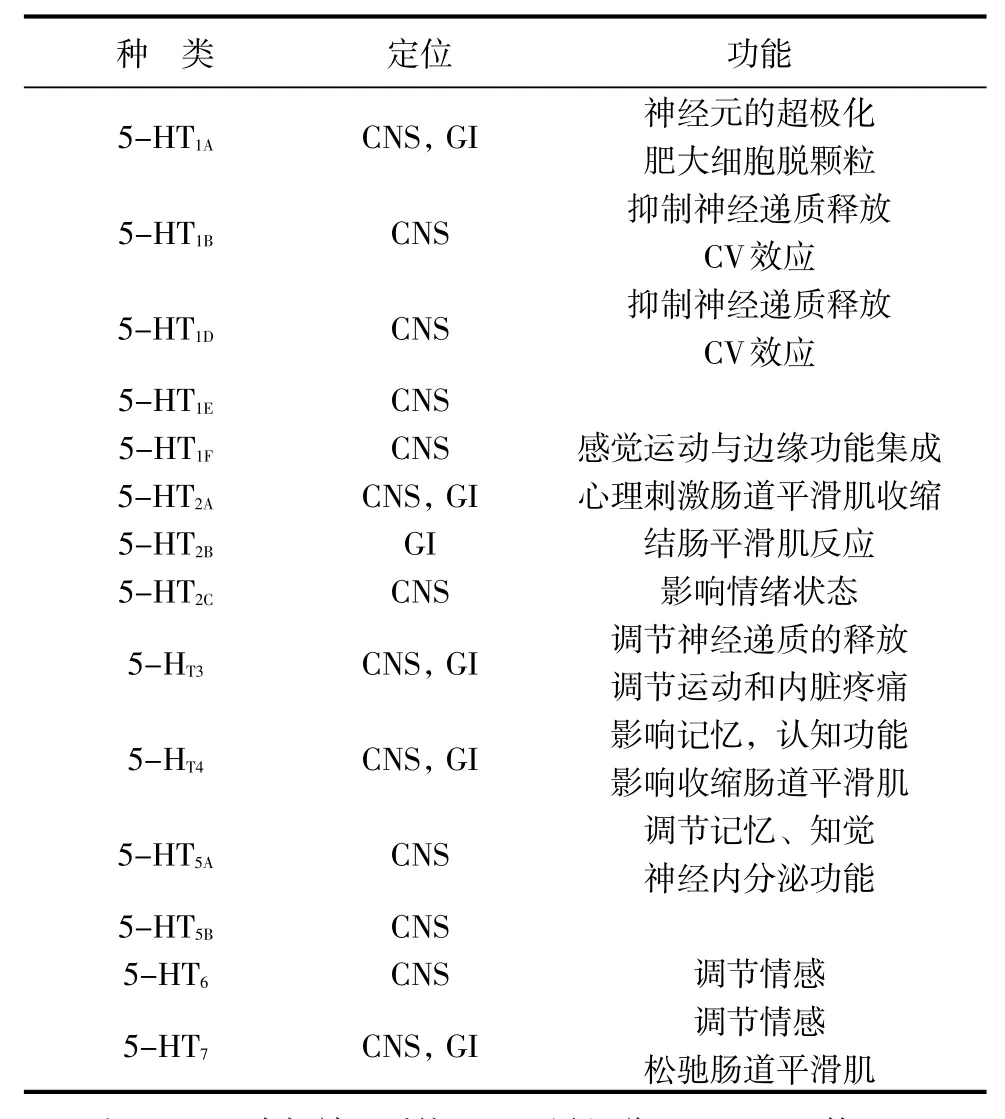
表1 5-HT受体的定位与功能
在肠道组织中发现了多种5-HT特异性受体,包括神经元以及平滑肌、上皮和EC细胞。例如,免疫细胞化学研究表明,5-HT3受体在外源性感觉神经元的上皮下端表达[16]。电生理学研究表明,当这些神经元暴露于5-HT3选择性颉颃剂时,对5-HT刺激的正常强健反应减弱[17]。此外,位于肠道平滑肌细胞上的5-HT2A受体在被5-HT激活时可以刺激肌肉收缩,从而间接激活肠壁中对5-HT敏感的神经纤维。有研究表明,与免疫功能相关的几种细胞类型,包括抗原呈递细胞、B细胞、T细胞、嗜酸性粒细胞、嗜碱性细胞和肥大细胞,表达多种5-HT受体(如5-HT1A、5-HT1B、5-HT2A、5-HT2B、5-HT4和5-HT7),并且这些受体的调节可以引起免疫活性的显著变化[18-19]。
3 5-HT在肠道中的生理功能
3.1 5-HT与胃肠运动
5-HT是色氨酸的中间代谢产物,是一种芳胺神经递质,影响肠道健康。在肠道中,色胺通过位于黏膜表面肠嗜铬细胞诱导神经递质5-HT(5-HT)的释放,5-HT通过肠神经系统神经元来刺激胃肠动力[20]。利用小鼠结肠黏膜近中段尤斯灌流发现,色胺本身可诱导电流发生显著变化,这证实其可以影响肠上皮细胞的离子分泌,而离子分泌在胃肠运动中起着重要作用[21]。因此,5-HT可能作为影响肠道转运时间的信号分子,且肠转运时间与人肠道微生物组成、多样性和代谢密切相关。
3.2 5-HT与肠道免疫
炎症性肠病通常表现为慢性腹泻或便秘。目前尚不清楚肠道细菌产生的色胺是否在其发病机制中发挥作用,其中1个特别有趣的物种是R.gnavus,其在炎症性肠病中过表达,可以产生色胺并利用粘蛋白,这表明与肠嗜铬细胞紧密共生[22]。与无菌小鼠相比,R.gnavus单菌小鼠显示出几种参与色氨酸代谢的基因诱导作用[23]。同时,R.gnavus是约90%成人和婴儿中常见的肠道微生物,该物种产生的色胺可能会影响人类健康[24]。
3.3 5-HT与肠道菌群
肠道菌群可通过多种代谢途径产生5-HT,反之,5-HT也可改变肠道菌群的组成和结构,包括厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)的比例,如若减少拟杆菌、肠杆菌的含量,则对于肠炎的发展可能起关键性的作用,是肠炎治疗的关键靶点。此外,乳酸杆菌等有益菌群相对丰度的提升,有利于肠道损伤恢复、减少炎症性肠炎反应的发生。不同种类的肠道菌群可分别产生丰富的代谢产物,如拟杆菌门可产生乙酸,丙酸和丁酸等短链脂肪酸及碳水化合物代谢物相关产物。当然,GABA、5-HT和褪黑素等神经递质类信号物质也可在肠道内被分泌,作用于神经-内分泌-免疫调节网络,实现宿主和肠道菌群之间复杂的“分子对话”。
4 5-HT在肠道炎症中的应用
炎症性肠病属于慢性胃肠道代谢性疾病,严重时可影响后肠道,引起腹泻、腹痛及痉挛等症状,与肠应激综合征(IBS)有异曲同工之处。IBD主要包括溃疡性结肠炎(UC)和克罗恩病(CD),尽管最近在治疗方面取得了进展,但许多患者仍难以找到对其疾病或症状的充分和一致的治疗。40%或更多的IBD患者最终被发现即使是最有效的治疗也是难以痊愈的[25]。一直以来,IBD发病率很高,是常见的功能性胃肠病。在美国,每年大约会发生300万例,并且临床上未出现有效的治疗手段可以治愈,一旦发生就可能持续数年,严重者甚至相伴一生[26]。目前来说,医学研究上也只能通过某些特定药物来缓解症状。上述症状与IBD相关的炎症状态,可能会受到各种不同因素的影响,包括与免疫和上皮屏障功能相关的遗传改变,饮食和肠道微生物群在内的多种环境因素,以及固有的宿主免疫因素。然而,还未被重视的潜在因素是肠道内神经内分泌信号的变化。事实上,有许多信号分子可以影响炎症或与IBD相关的症状。5-HT在这方面是最具影响力的,研究发现,在IBD病理生理的变化中,均发现有5-HT的参与及5-HT信号系统的变化,表明5-HT与IBD的发展历程有紧密的联系,这启示5-HT的含量变化可作为IBD的标志靶点[22]。IBD对肠道黏膜5-HT信号的传导见表2。
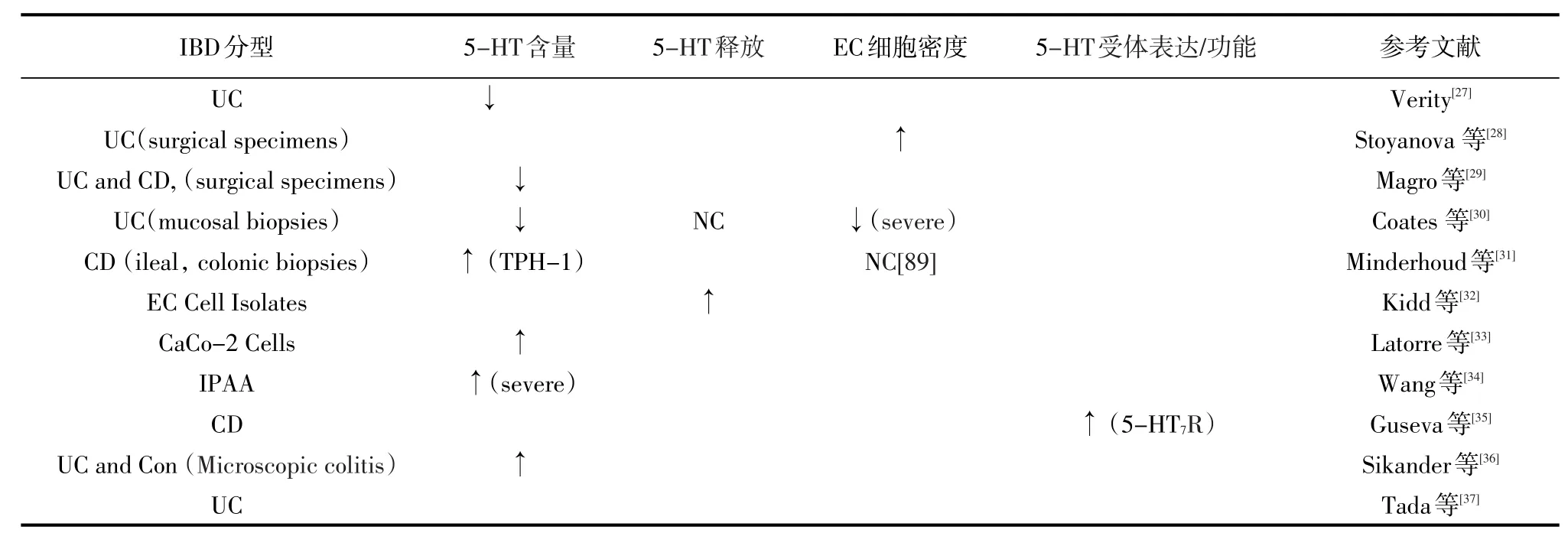
表2 IBD对肠道黏膜5-羟色胺信号的传导
小鼠、大鼠和豚鼠肠道炎症的研究显示结肠黏膜5-HT含量和EC细胞密度显著相关[38-40]。使用TNBS刺激豚鼠回肠炎的单独模型也显示小肠EC细胞增生,犬肠炎模型显示5-HT含量和EC细胞密度升高。两项涉及靶向细胞因子敲除(IL-2和IL-13)的小鼠研究没有表现出这些变化[41]。然而,利用非小鼠模型进行研究证实是因为小鼠肠道内含有5-HT的肥大细胞,而这些细胞的相对流行率可能有助于肠道炎症状态下黏膜5-HT水平的变化[42]。5-HT对炎症过程和与IBD相关的某些症状的影响极其明显。先前两项使用啮齿动物结肠炎模型的研究表明,在每种情况下应用5-HT前体5-羟色氨酸(5-HTP)会恶化炎症[21]。通过“遗传消融”或药物阻断TPH-1限制5-HT在小鼠结肠炎模型中产生的其他研究发现,炎症反应因此显著延迟或减弱[43-44]。这种效应似乎是定位于小鼠肠道黏膜中的5-HT特有的[44]。
在人类研究中,早在20世纪60年代,研究人员就开始报道IBD患者肠道中的5-HT成分发生改变[29]。然而,与健康对照组相比,5-HT含量或EC细胞密度增加[36,45]。然而,这些差异可以运用疾病的严重程度来解释。例如,包括对严重UC进行具体评估的研究表明,炎症程度最严重的患者EC细胞密度和5-HT含量显著下降[30]。5-HT的合成能力和患病率也可以在IBD相关的症状中发挥重要作用,无论疾病活动状态如何,表现出持续性肠易激综合征(IBS)样症状的结肠CD患者在结肠黏膜活检中表现出TPH-1的RNA水平升高[31]。67个患有回肠袋肛管吻合术的患者显示持续的下腹不适和肠道改变而没有明显的炎症改变,也发现在袋子活检中EC细胞密度增加[39]。目前还没有任何动物探究调查5-HT的释放调节可以对这种环境中炎症风险或严重程度的疾病产生深远影响。IBD动物模型肠黏膜5-羟色胺的信号传导见表3。
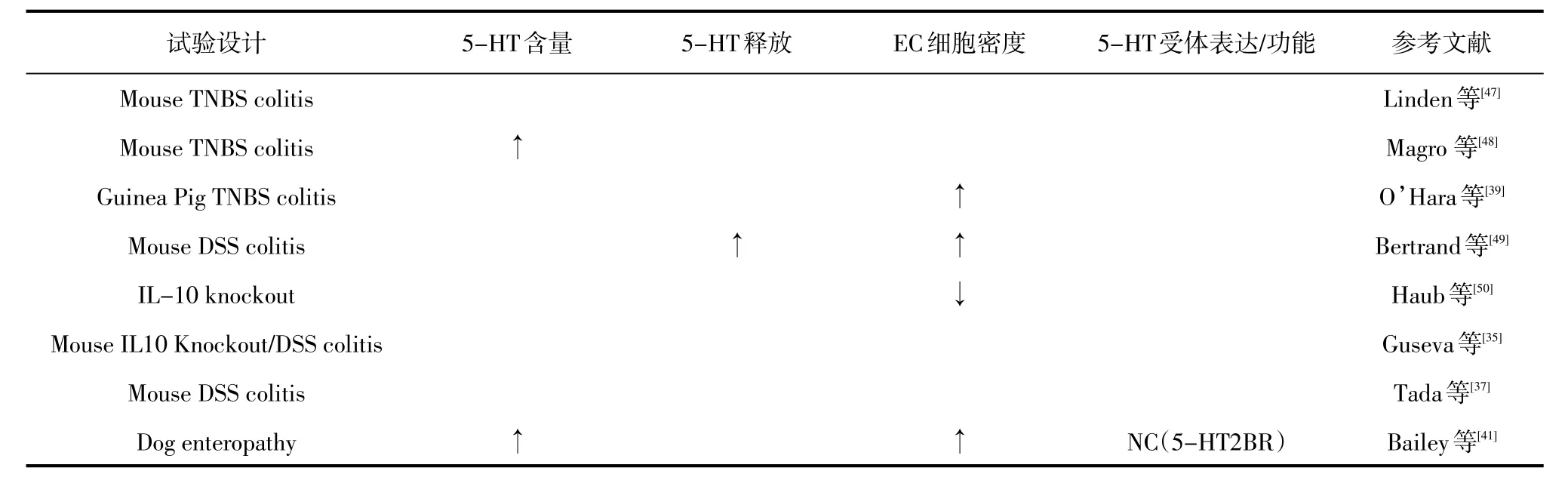
表3 IBD动物模型肠黏膜5-羟色胺的信号传导
由炎症介质IL-1 beta和LPS诱导的分离EC细胞株表现出5-HT释放增加,而观察人类IBD(UC)组织的唯一研究发现,5-HT释放与健康对照组织中看到的类似[51]。此外,在一项对经历过IPAA的85例IBD患者的研究中,在胃炎疾病活动性指数上内镜评分最严重的患者血液中5-HT水平最高[34]。很少有公开发表的研究系统地描述肠壁内5-HT受体在肠道炎症环境中的分布。然而,越来越多的报道描述肠道5-HT受体能对肠道内炎症的影响,阻断5-HT1AR活性可恶化TNB诱导的小鼠结肠炎,同时刺激5-HT1AR或抑制5-HT2AR可降低炎症的严重程度。相反,5HT2AR激动剂在大鼠的小肠中产生了促炎标记物的“超强”减少。在5-HT3R的情况下,另外两项研究纳入了小鼠和大鼠结肠炎模型,表明其颉颃作用降低了炎症的严重性[52-53]。运用动物结肠炎模型对5-HT4R激动剂的研究表明,要么对炎症没有显著影响,要么该受体对炎症有保护作用[54-55]。当然,Spohn等通过灌肠给药证明5-HT4R灌肠对小鼠肠道炎症有保护作用,但当通过腹腔注射给药时其不具有保护作用[45]。此外,用5-HT4R颉颃剂(GR113808)灌肠治疗的正常动物出现早期炎症的迹象。通过5-HT4R依赖机制,在DSS诱导的结肠炎的小鼠和豚鼠模型中也证明了肠神经元增殖增加[56]。评价肠道5-HT7R功能的研究初步表明,通过该受体的药理颉颃或基因敲除,可减少小鼠DSS结肠炎中的炎症[57]。然而,一项类似的小鼠结肠炎模型研究表明,5-HT7R可能发挥更多的保护作用,在激活时减少肠道炎症活动。
总之,5-HT受体在调节肠道炎症方面发挥着重要的作用。研究表明,5-HT1AR、5-HT2AR和5-HT4R的激活可能对肠道炎症具有保护作用,而5-HT3R更有可能恶化炎症过程,而5-HT7R影响的证据尚不明确[35]。5-HT受体调节也可能对与肠道炎症相关的症状产生显著影响,在上述小鼠巴豆油结肠炎研究中,发现应用5-HT3R颉颃剂(Ondansetron)可以解决这些小鼠中出现的5-HTP诱导的腹泻。Spohn等在小鼠DSS结肠炎模型中证明了5-HT4R激动剂改善了肠道运动,而在未治疗的小鼠中使用5-HT4R颉颃剂导致炎症的发展[55]。在小鼠的DSS结肠炎模型中也证明替加色罗改善肠动力,而在未治疗的小鼠中使用5-HT4R颉颃剂会导致炎症发展,非发炎动物的运动障碍和梗阻[55]。
5 小结与展望
5-HT由肠嗜铬细胞分泌而产生,具备调控胃肠道运动、神经功能和抵御炎症反应等多方面作用。由于其多效作用,有利于减少炎症反应和降低促炎因子分泌,可在IBD疾病治疗和临床研究中发挥积极作用。目前来说,5-HT与人类健康之间的联系仍是探索性研究,未来需要更全面地了解5-HT代谢动力学及其从出生到老年、从健康到疾病等不同生命阶段的多样功能,极大地扩展我们对肠道-宿主-微生物在健康和疾病中交叉对话的有效理解。
